ЗНО онлайн 2016 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2016 року з хімії
ТЕМА: Основні хімічні поняття. Моль. Кількість речовини. Число Авогадро.
Завдання скеровано на розуміння взаємозв’язків між кількістю газу, його об’ємом і кількістю структурних і частинок.
Кількість речовини – фізична величина, яка прямо пропорційна кількості структурних одиниць речовини в певній її порції.
Одиниця кількості речовини – моль – це порція речовини, у якій 6,02 · 1023 моль-1 структурних одиниць.
6,02 · 1023 моль-1 – стала Авогадро.
Існує пряма пропорційна залежність між кількістю речовини й кількістю структурних частинок речовини та її (рис. 1).
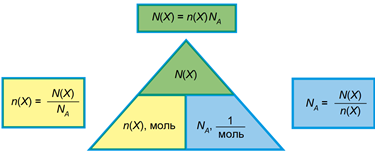
Рис. 1. Взаємозв’язок між кількістю структурних одиниць речовини, її кількістю і сталою Авогадро
Молярний об’єм – об’єм речовини кількістю 1 моль.
Існує пряма пропорційна залежність між об’ємом речовини та її кількістю (рис. 2).
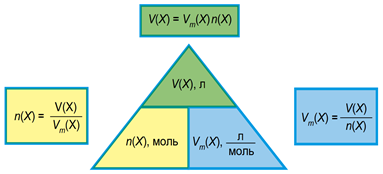
Рис. 2. Взаємозв’язок між об’ємом газу, його кількістю і молярним об’ємом
Якщо стисло:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
Карбон і Титан – елементи IV групи різних її підгруп: Карбон міститься в IV a, а Титан – у IV b підгрупі (рис. 1).
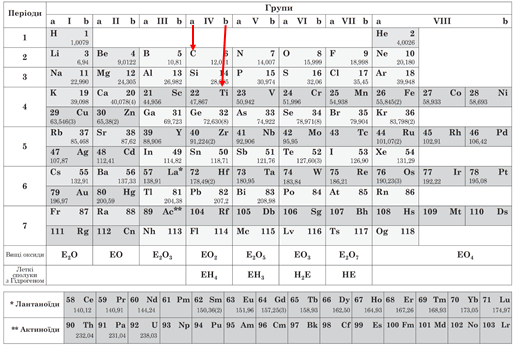
Рис. 1. Місцеположення Карбону й Титану в періодичній системі хімічних елементів
Відповідь: B.
Знайшли помилку? Пишіть на
Тема: Класифікація хімічних елементів.
Завдання скеровано на перевірку розуміння ознак класифікації хімічних елементів на металічні й неметалічні, знання місцеположення металічних і неметалічних елементів у періодичній системі.
Місцеположення металічних елементів у періодичній системі відображено на рисунку 1.
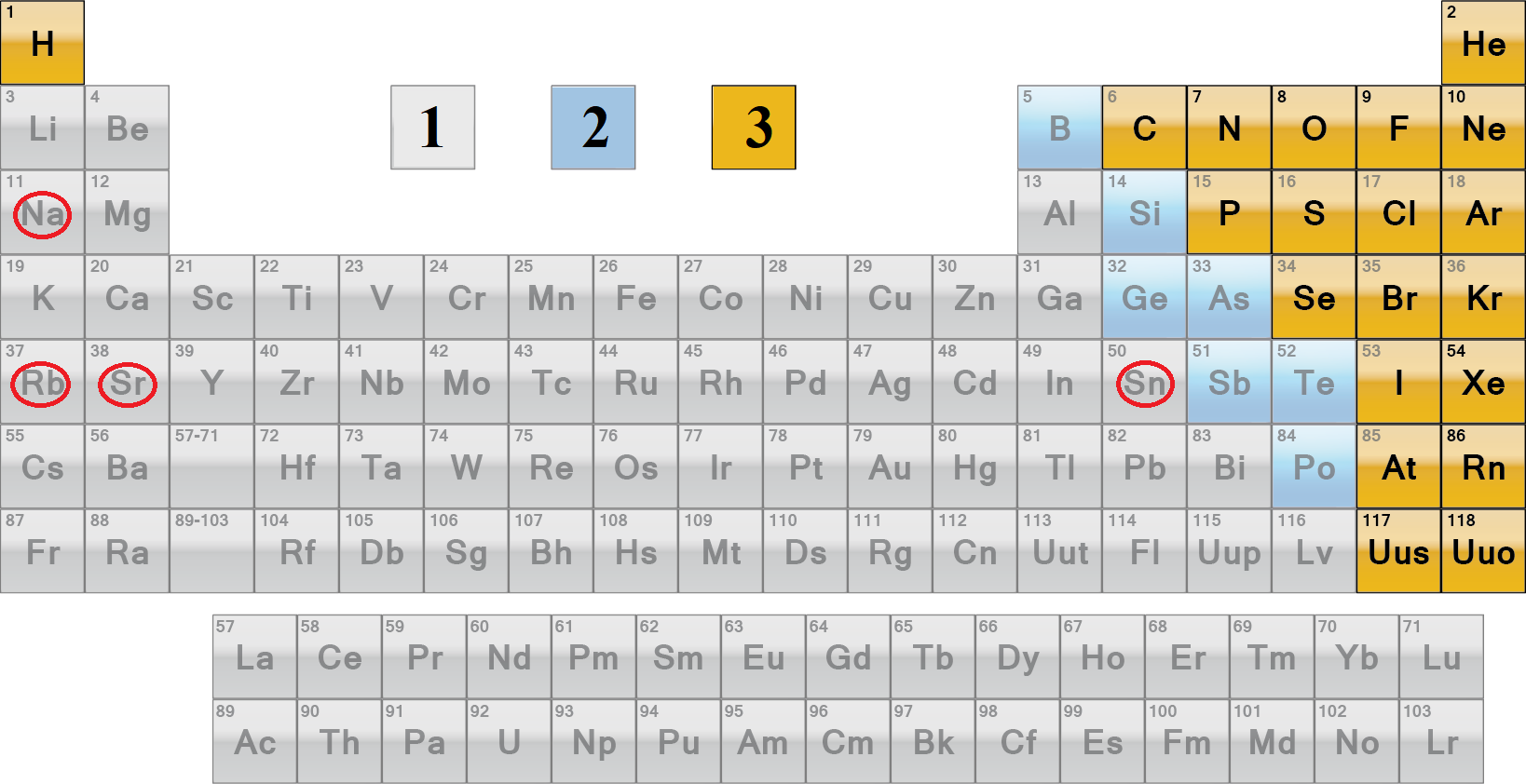
Рис. 1. Місцеположення в періодичній системі хімічних елементів – металічних (1), перехідних між металічними й неметалічними (2), неметалічних (3)
A Na, Ne, N
Б Cl, Sr, Sn
B P, As, Si
Г C, Br, Rb
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Нейтронне число \(N\) (кількість нейтронів в ядрі) дорівнює різниці між масовим \(Z\) і протонним \(A\) числами: $$ N=A-Z. $$
Якщо кількість протонів і нейтронів однакова, то нуклонне число є парним, тобто вибір потрібно зробити між нуклідами \(\mathrm{^{12}_6C,\ ^{18}_8O}\) і \(\mathrm{^{22}_{10}Ne}\).
| Нуклідний символ | \(A\) | \(Z\) | \(N\) | |
| A | \(\mathrm{^{12}_6C}\) | 12 | 6 | 6 |
| Б | \(\mathrm{^{18}_8O}\) | 18 | 8 | 10 |
| B | \(\mathrm{^{21}_{10}Ne}\) | 21 | 10 | 11 |
| Г | \(\mathrm{^{22}_{10}Ne}\) | 22 | 10 | 12 |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
\begin{gather*} \mathrm{\overset{+2}{Mg}}_x\mathrm{\overset{+2}{Ca}(\overset{+4}{Si}\overset{-2}{O}_3)_4}\\[7pt] 2x+2+4(4+3(-2))=0\\[7pt] 2x=6\\[7pt] x=3. \end{gather*}Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Протонне число 9 в елемента Флуору, 11 – у Натрію, тобто в завданні йдеться про натрій флуорид.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони (рис. 2).
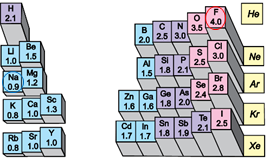
Рис. 1. Відносна електронегативність атомів хімічних елементів
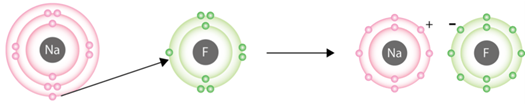
Рис. 2. Утворення йонів Натрію і Флуору
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Йонні кристали утворюють більшість солей неорганічних і органічних кислот, луги, основні й амфотерні оксиди й гідроксиди.
У кристалічних ґратках натрій флуориду містяться катіони Натрію і флуорид-аніони, тобто кристалічні ґратки в натрій флуориді йонні.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів, розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A \(\mathrm{\overset{+2}{Mn}(\overset{-2}{O}\overset{+1}{H})_2\rightarrow \overset{+2}{Mn}\overset{-2}{O}+\overset{+1}{H}_2\overset{-2}{O}}\)
Б \(\mathrm{\overset{+2}{Mn}(\overset{-2}{O}\overset{+1}{H})_2+\overset{+1}{H}\overset{-1}{Cl}\rightarrow \overset{+2}{Mn}\overset{-1}{Cl}+\overset{+1}{H}_2\overset{-2}{O}}\)
B \(\mathrm{\overset{+2}{Mn}\overset{-2}{O}+\overset{+1}{H}\overset{-1}{Cl}\rightarrow \overset{+2}{Mn}\overset{-1}{Cl}_2+\overset{+1}{H}_2\overset{-2}{O}}\)
Г \(\mathrm{\overset{+4}{\underline{Mn}}\overset{-2}{O}_2+\overset{+1}{H}\overset{-1}{\underline{\underline{Cl}}}\rightarrow \overset{+2}{\underline{Mn}}\overset{-1}{Cl}_2+\overset{0}{\underline{\underline{Cl_2}}}+\overset{+1}{H}_2\overset{-2}{O}}\)
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині. Йонно-молекулярне рівняння.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині й уміння складати йонно-молекулярні рівняння.
З-поміж карбонатів, які беруть участь у реакції, лише калій карбонат є розчинним і дисоціює у водному розчині на йони (рис. 1).
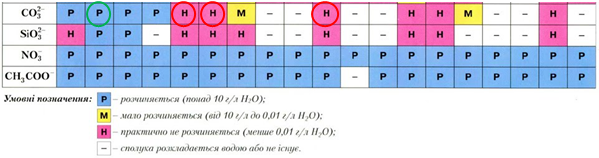
Рис. 1. Розчинність карбонатів Калію, Кальцію, Барію, Феруму(ІІ)
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
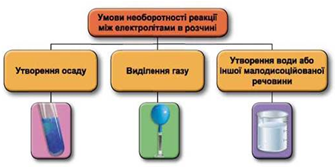
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Між собою у водному розчині не реагують натрій нітрат і калій хлорид, тому що йони, які утворюються внаслідок їхньої дисоціації, не взаємодіють між собою з утворенням слабких електролітів (газу, осаду, води тощо):
| A |
\(\mathrm{CuSO_4+2NaOH=Cu(OH)_2\downarrow +Na_2SO_4}\) \(\mathrm{Cu^{2+}+SO^{2-}_4+2Na^++2OH^-=Cu(OH)_2\downarrow +2Na^++SO^{2-}_4}\) \(\mathrm{Cu^{2+}+2OH^-=Cu(OH)_2\downarrow }\) |
| Б |
\(\mathrm{ZnCl_2+Na_2S=ZnS\downarrow +2NaCl}\) \(\mathrm{Zn^{2+}+2Cl^-+2Na^++S^{2-}=ZnS\downarrow +2NaCl}\) \(\mathrm{Zn^{2+}+S^{2-}=ZnS\downarrow }\) |
| B |
\(\mathrm{NaNO_3+KCl\ -\ }\underline{\text{реакція не відбувається}}\) \(\mathrm{Na^++NO^-_3+K^++Cl^-=Na^++Cl^-+K^++NO^-_3}\) |
| Г |
\(\mathrm{K_2SiO_3+2HCl=H_2SiO_3\downarrow +2KCl}\) \(\mathrm{2K^++SiO^{2-}_3+2H^++2Cl^-=H_2SiO_3\downarrow +2K^++2Cl^-}\) \(\mathrm{2H^++SiO^{2-}_3=H_2SiO_3\downarrow }\) |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація оксидів.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Несолетворними називають оксиди, які не взаємодіють ні з кислотами, ні з основами і солей не утворюють. До таких належить нітроген(ІІ) оксид \(\mathrm{NO}\).
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Основи. Луги. Амфотерні гідроксиди.
Завдання скеровано на перевірку знання хімічних властивостей і способів добування амфотерних гідроксидів і лугів.
Цинк гідроксид – нерозчинна речовина, його можна добути реакцією обміну між сіллю Цинку й лугом у водному розчині:
\begin{gather*} \mathrm{ZnCl_2+2KOH=\underbrace{Zn(OH)_2\downarrow}_{\text{білий драглистий}}+2KCl;}\\[7pt] \mathrm{Zn^{2+}+2OH^-\rightarrow Zn(OH)_2\downarrow}. \end{gather*}Калій гідроксид – луг, у водному розчині дисоціює з утворенням гідроксид-аніонів, під дією яких фенолфталеїн набуває малинового забарвлення: $$ \mathrm{KOH\rightarrow K^++OH^-.} $$
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знання хімічних властивостей сульфатної кислоти.
1 чиста сульфатна кислота є важкою безбарвною оліїстою рідиною
2 сульфатна кислота реагує із цинк гідроксидом: $$ \mathrm{Zn(OH)_2+H_2SO_4=ZnSO_4+2H_2O} $$
3 сульфатна кислота двохосновна, тому утворює середні (сульфати) і кислі (гідрогенсульфати) солі
4 сульфатна кислота є сильною кислотою
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання хімічних властивостей гідрогенкарбонатів.
Питна сода – тривіальна назва натрій гідрогенкарбонату – кислої солі слабкої нестійкої карбонатної кислоти. Оцтова (етанова) кислота витісняє слабшу карбонатну з її солі, нестійка карбонатна кислота розкладається на карбон(IV) оксид і воду:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Алюміній гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид \(\mathrm{Al(OH)_3}\) реагує як основа, із лугами – як кислота, тобто виявляє амфотерні властивості.
Тож для доведення його амфотерності потрібно використати сульфатну кислоту й калій гідроксид:
\begin{gather*} \mathrm{ 2Al(OH)_3+3H_2SO_4=Al_2(SO_4)_3+6H_2O};\\[7pt] \mathrm{ Al(OH)_3+3KOH=K_3[Al(OH)_6]. } \end{gather*}
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Генетичні зв’язки між речовинами, що належать до різних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати реагенти й продукти реакцій за участі неорганічних речовин.
Умові завдання відповідає купрум(ІІ) хлорид:
\begin{gather*} \mathrm{ Cu+Cl_2=CuCl_2;}\\[7pt] \text{або}\\[7pt] \mathrm{ Cu+HgCl_2=Hg+CuCl_2;}\\[7pt] \mathrm{ CuCl_2+2NaOH=Cu(OH)_2\downarrow +2NaCl;}\\[7pt] \mathrm{ Cu^{2+}+2OH^-=Cu(OH)_2\downarrow .} \end{gather*}
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
\begin{gather*} \mathrm{\overset{+3}{In}\overset{-3}{As}+\overset{+3}{In}\overset{-1}{Cl}_3\rightarrow \overset{+1}{In}\overset{-1}{Cl}+\overset{0}{As}}\\[7pt] \left. \begin{array}{ c c } \overset{+3}{\mathrm{In}}+2\overline{e}\rightarrow \overset{+1}{\mathrm{In}}& \\ \overset{-3}{\mathrm{As}}-3\overline{e}\rightarrow \overset{0}{\mathrm{As}}& \end{array}\right. \left. \begin{array}{ c c } \text{окисник, відновлення}& \\[8pt] \text{відновник, окиснення}& \end{array}\right. \end{gather*}Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють тимчасову твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасова (карбонатна) твердість води зумовлена катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^-_3}\).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Алюміній гідроксид.
Завдання скеровано на перевірку знання властивостей алюміній гідроксиду.
Алюміній хлорид реагує з натрій гідроксидом із утворенням осаду амфотерного алюміній гідроксиду, який здатен розчинятися під дією лугу:
\begin{gather*} \mathrm{AlCl_3+3NaOH=Al(OH)_3\downarrow +3NaCl;}\\[7pt] \mathrm{Al(OH)_3+3NaOH=Na_3[Al(OH)_6].} \end{gather*}
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Ферум(ІІІ) гідроксид.
Завдання скеровано на перевірку знання властивостей ферум(ІІІ) гідроксиду.
Продуктами розкладання ферум(ІІІ) гідроксиду є ферум(ІІІ) оксид і вода: $$ \mathrm{2Fe(OH)_3=Fe_2O_3+3H_2O.} $$
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Хлор. Гідроген хлорид.
Завдання скеровано на перевірку знання властивостей хлору й гідроген хлориду.
Хлор – газ жовто-зеленого кольору з різким запахом.
Гідроген хлорид – безбарвний газ із різким запахом.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Неорганічна хімія. Термічне розкладання нітратів.
Завдання скеровано на перевірку знання властивостей нітратів і класифікації хімічних реакцій за кількістю і хімічним складом реагентів і продуктів.
Кисень із натрій нітрату добувають реакцією, рівняння якої $$ \mathrm{2NaNO_3=2NaNO_2+O_2\uparrow .} $$ Реагентом є одна складна речовина, продуктами – проста й складна речовини. Це – реакція розкладання.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Способи добування амоніаку.
Завдання скеровано на перевірку знання промислового способу добування амоніаку.
У промисловості амоніак добувають синтезом з азоту й водню: $$ \mathrm{N_2+3H_2=2NH_3.} $$
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й наслідків із нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Оскільки молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями: \begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV;\\[6pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac{M}{V_m}. \end{gather*}
Тобто однакові густини в газів із однаковою молярною масою.
Молярна маса кисню 32 г/моль. Така сама молярна маса в силану \(\mathrm{SiH_4}\).
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Етин.
Завдання скеровано на перевірку знання будови молекули етину.
Згідно з гіпотезою гібридизації атоми Карбону в молекулі етину перебувають у стані sp-гібридизації. Це означає, що s-електронна орбіталь «змішується» з однією із трьох p-електронних орбіталей, утворюючи дві sp-гібридні електронні орбіталі, а дві інші p-електронні орбіталі залишаються негібридизованими (рис. 1).
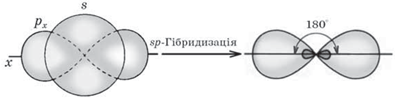
Рис. 1. 1. Схема утворення sp-гібридних електронних орбіталей атома Карбону. 2. Схема утворення σ-зв’язків у молекулі етину
sp-Гібридні електронні орбіталі двох атомів Карбону, перекриваючись, утворюють σ-зв’язок між собою і з атомами Гідрогену (рис. 2). Валентний кут у цьому разі становить 180 °.

Рис. 2. Схема утворення σ-зв’язків у молекулі етину
За рахунок перекривання негібридизованих p-електронів утворюються два π‑зв’язки (рис. 3). Ділянки перекривання p-електронів лежать поза віссю σ-зв’язку.
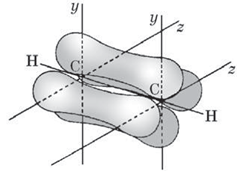
Рис. 3. Схема утворення π-зв’язків у молекулі етину
Електронна густина двох π-зв’язків зливається, набуваючи циліндричної форми, усередині якої зосереджено σ-зв’язок.
Отже, у молекулі етину між атомами Карбону є потрійний зв’язок – поєднання одного σ- і двох π-зв’язків.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани.
Завдання скеровано на перевірку знання загальної формули алканів.
Вуглеводень 2-метилбутан є представником алканів, про що свідчить суфікс -ан у його назві.
Загальна формула алканів – \(\mathrm{C}_n\mathrm{H}_{2n+2}\).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени.
Завдання скеровано на перевірку знання хімічних властивостей алкенів.
Гідратація алкену – реакція приєднання молекули води до молекули алкену за місцем подвійного зв’язку, наприклад:
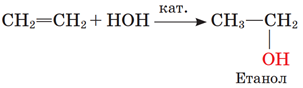
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни. Етин.
Завдання скеровано на перевірку знання природи й способів добування етину.
Етин \(\mathrm{C_2H_2}\) належить до гомологічного ряду алкінів, загальна формула яких \(\mathrm{C}_n\mathrm{H}_{2n-2}\), а не алкенів, загальна формула яких \(\mathrm{C}_n\mathrm{H}_{2n}\).
Етин добувають дією води на кальцій карбід: $$ \mathrm{CaC_2+2H_2O\rightarrow Ca(OH)_2+C_2H_2\uparrow .} $$
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени. Алкіни. Арени. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей алкенів, алкінів, бензену.
Калій перманганатом у водному розчині окиснюються циклогексен – алкен циклічної будови, бут-2-ин – алкін, бут-2-ен – алкен.
Реакції бензену зумовлені наявністю π-електронної системи, що стабілізує ядро. Через це бензен стійкий проти дії окисників, він не знебарвлює водний розчин калій перманганату.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти.
Завдання скеровано на перевірку знання хімічних властивостей спиртів.
Міжмолекулярна дегідратація етанолу полягає у відщепленні молекули води від двох молекул етанолу:
Продуктом реакції є діетиловий етер.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Альдегіди. Карбонові кислоти.
Завдання скеровано на перевірку вміння розпізнавати характеристичні (функціональні) групи.
Властивості як альдегіду, так і карбонової кислоти виявляє метанова кислота (рис. 1).
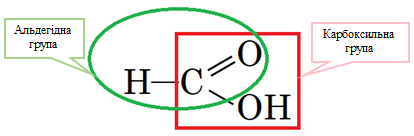
Рис. 1. Структурна формула метанової кислоти
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Жири.
Завдання скеровано на перевірку знання хімічних властивостей жирів.
У молекулах рідких жирів на відміну від твердих є подвійні карбон-карбонові зв’язки. За місцем подвійного зв’язку можлива реакція приєднання, зокрема Гідрогену, – гідрування. У результаті цієї реакції ненасичена сполука перетворюється на насичену, а рідкий жир – на твердий:
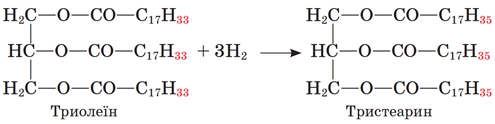
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання фізичних властивостей вуглеводів.
З-поміж вуглеводнів, назви яких наведено в умові завдання, у воді розчиняються глюкоза й сахароза.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Білки.
Завдання скеровано на перевірку знання кольорових реакцій білків.
Вовна – волокно тваринного походження, що містить білки. Те, що під дією концентрованої нітратної кислоти, тканина набуває жовтого кольору, свідчить про перебіг ксантопротеїнової реакції. Її проводять для виявлення білків, молекули яких містять залишки ароматичних амінокислот.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання генетичних зв’язків між класами органічних сполук.
Продуктом першого перетворення є натрій метаноат, унаслідок дії сильної нелеткої сульфатної кислоти на нього утворюється метанова кислота: \begin{gather*} \mathrm{CO+NaOH\rightarrow HCOONa;}\\[7pt] \mathrm{HCOONa+H_2SO_4\rightarrow HCOOH+NaHSO_4.} \end{gather*}
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
| 1 | Протонне число елемента другого періоду Флуору – 9, тобто 9 електронів в його атомі розподілено по двох енергетичних рівнях. В однозарядному аніоні Флуору на електрон більше: $$\mathrm{F^-}\ \ \ 1s^22s^22p^6$$ | B |
| 2 | Протонне число елемента четвертого періоду Кальцію 20, тобто 20 електронів в його атомі розподілено по чотирьох енергетичних рівнях. У двозарядному катіоні Кальцію на два електрони менше: $$\mathrm{Ca^{2+}\ \ \ }1s^22s^22p^63s^23p^6$$ | A |
| 3 | Протонне число Натрію 11, тобто 11 електронів в його атомі розподілено по трьох енергетичних рівнях: $$\mathrm{Na}\ \ \ 1s^22s^22p^63s^1$$ | Б |
| 4 | Протонне число елемента другого періоду Нітрогену 7, тобто 7 електронів в його атомі розподілено по двох енергетичних рівнях: $$\mathrm{N}\ \ \ 1s^22s^22p^5$$ | Г |
Відповідь: 1В, 2А, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння розпізнавати типи хімічних реакцій.
| 1 | \(\mathrm{Fe_2O_3+2Al=Fe+Al_2O_3}\) | алюмотермія | заміщення | A |
| 2 | \(\mathrm{CaCO_3=CaO+CO_2\uparrow}\) | прожарювання вапняку | розкладання | Г |
| 3 | \(\mathrm{AgNO_3+NaCl=AgCl\downarrow +\ NaNO_3}\) | якісна реакція на хлорид-аніони в розчині | обмін | B |
| 4 | \(\mathrm{S+O_2=SO_2}\) | горіння сірки в кисні | сполучення | Д |
Відповідь: 1А, 2Г, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Тривіальні назви речовин.
Завдання скеровано на перевірку знання тривіальних назв речовин..
| 1 | \(\mathrm{K_2CO_3}\) | поташ | Д |
| 2 | \(\mathrm{Na_2SiO_3}\) | розчинне скло | Б |
| 3 | \(\mathrm{NH_4Cl}\) | нашатир | Г |
| 4 | \(\mathrm{CaCO_3}\) | крейда | A |
Відповідь: 1Д, 2Б, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати типи хімічних реакцій за участі органічних речовин.
| 1 | \(\mathrm{C_3H_6+H_2\rightarrow C_3H_8}\) | гідрування | Д |
| 2 | \(\mathrm{NH_2-(CH_2)_5-COOH\rightarrow (-NH-(CH_2)_5-CO-)}_n+\mathrm{H_2O}\) | поліконденсація | B |
| 3 | 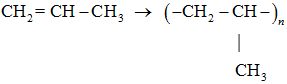 |
полімеризація | Б |
| 4 | \(\mathrm{(C_6H_{10}O_5)}_n+\mathrm{H_2O}\rightarrow \mathrm{C_6H_{12}O_6}\) | гідроліз | Г |
Відповідь: 1Д, 2В, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація органічних речовин.
Завдання скеровано на перевірку вміння розпізнавати органічні речовини й класифікувати їх.
| 1 | гліцерол | триатомний спирт | Б |
| 2 | анілін | ароматичний амін | А |
| 3 | гліцин | найпростіша амінокислота | Д |
| 4 | фруктоза | моносахарид – вуглевод | Г |
Відповідь: 1Б, 2А, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати реагенти і продукти хімічних реакцій за участі органічних речовин.
| 1 | \(\mathrm{H_2C=CH_2+Br-Br\rightarrow BrH_2C-CH_2Br}\) | 1,2-дибромоетан | Д |
| 2 | \(\mathrm{H_2C=CH_2+H-Br\rightarrow BrH_2C-CH_3}\) | бромоетан | A |
| 3 | \(\mathrm{H_2C=CH_2+H-OH\rightarrow H_3C-CH_2-OH}\) | етанол | Г |
| 4 | \(\mathrm{H_2C=CH_2+H-H\rightarrow H_3C-CH_3}\) | етан | B |
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| А | \(\mathrm{\overset{+1}{N}_2\overset{-2}{O}}\) | 2 |
| Б | \(\mathrm{\overset{+1}{Na}\overset{-3}{N}\overset{+1}{H}_2}\) | 1 |
| В | \(\mathrm{\overset{+1}{Na}\overset{+3}{N}\overset{-2}{O}_2}\) | 3 |
| 4 | \(\mathrm{\overset{+4}{N}_2\overset{-2}{O}_4}\) | 4 |
Відповідь: 1Б, 2А, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
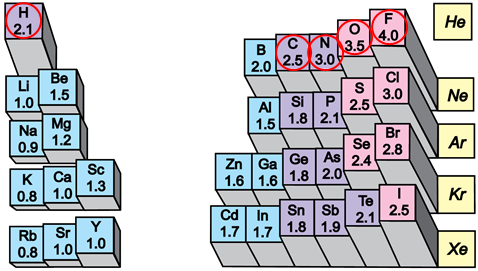
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: 1А, 2Г, 3Б, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість атомів хімічного елемента в молекулі речовини за її молекулярною формулою.
Дано:
\(M_r(\mathrm{C}_n\mathrm{H}_{2n+2})=100\)
Знайти:
\(n\ -\ ?\)
Відповідь: 7.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносну густину газу.
Дано:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{CH_4})=75\ \text{%}\)
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{O_2})=25\ \text{%}\)
\(M(\mathrm{CH_4})=16\ \text{г/моль}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(D_{\mathrm{H_2}}(\mathrm{CH_4,\ O_2})\ -\ ?\)
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
\(w_1(\mathrm{CH_3COOH})=80\ \text{%}\)
\(m_1(\mathrm{CH_3COOH})+m(\mathrm{H_2O})=400\ \text{г}\)
\(w_2(\mathrm{CH_3COOH})=5\ \text{%}\)
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}(\mathrm{H_2O})=1\ \frac{\text{кг}}{\text{л}}\)
Знайти:
\(\triangle V(\mathrm{H_2O})\ -\ ?\)
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння виводити молекулярну формулу речовини.
Дано:
\(m(X)=14\ \text{г}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
\(M(\mathrm{Cu})=64\ \text{г/моль}\)
\(V(\mathrm{H_2})=5,6\ \text{л}\)
1. Знайти:
\(M(X)\ -\ ?\)
2. Знайти:
\(m(\mathrm{Cu})\ -\ ?\)
Відповідь: 1. 56. 2. 16.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння виводити молекулярну формулу речовини.
Дано:
\(m(\mathrm{C}_x\mathrm{H}_y\mathrm{O}_z)=3,6\ \text{г}\)
\(V(\mathrm{CO_2})=5,6\ \text{л}\)
\(V_m(\mathrm{CO_2})=22,4\ \text{л/моль}\)
\(m(\mathrm{H_2O})=5,4\ \text{г}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
\(D_{\mathrm{O_2}}(\mathrm{C}_x\mathrm{H}_y\mathrm{O}_z)=2,25\)
\(M(\mathrm{O_2})=32\ \text{г/моль}\)
1. Знайти:
\((x+y+z)\ -\ ?\)
2. Знайти:
\(n(\text{структурні ізомери})\ -\ ?\)
У пентану \(\mathrm{C_5H_{12}}\) три структурних ізомери (рис. 1).
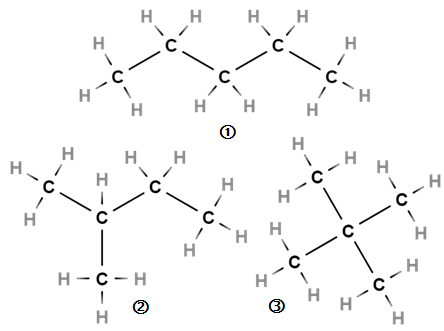
Рис. 1. Структурні ізомери пентану: 1 – пентан, 2 – 2-метилбутан, 3 – 2,2-диметилпропан
Відповідь: 1. 17. 2. 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів – \(3+2+3+1+3=12\).
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
\(V(\mathrm{CO_2})=6,72\ \text{л}\)
\(m(\mathrm{Ca(OH)_2})=14,8\ \text{г}\)
\(M(\mathrm{Ca(OH)_2})=74\ \text{г/моль}\)
\(M(\mathrm{CaCO_3})=100\ \text{г/моль}\)
\(V_m(\mathrm{CO_2})=22,4\ \text{л/моль}\)
Знайти:
\(m(\mathrm{CaCO_3})\ -\ ?\)
За умовою задачі:
За рівнянням реакції \(\mathrm{Ca(OH)_2+CO_2=CaCO_3\downarrow +H_2O:}\)
Надлишок карбон(IV) оксиду: \(n_2(\mathrm{CO_2})=0,1\ \text{моль}.\)
Він прореагує з кальцій карбонатом:
\(\mathrm{CaCO_3+CO_2+H_2O=Ca(HCO_3)_2}\).
За цим рівнянням \(n_2(\mathrm{CaCO_3})=n_2(\mathrm{CO_2})\),
\begin{gather*} n_2(\mathrm{CaCO_3})=0,1\ \text{моль}\\[7pt] n_3(\mathrm{CaCO_3})=n_1(\mathrm{CaCO_3})-n_2(\mathrm{CaCO_3})\\[7pt] n_3(\mathrm{CaCO_3})=0,2\ \text{моль}-0,1\ \text{моль}\\[7pt] n_3(\mathrm{CaCO_3})=0,1\ \text{моль}\\[7pt] m_3(\mathrm{CaCO_3})=n_3(\mathrm{CaCO_3})M(\mathrm{CaCO_3})\\[7pt] m_3(\mathrm{CaCO_3})=0,1\ \text{моль}\cdot 100\ \text{г/моль}\\[7pt] m_3(\mathrm{CaCO_3})=10\ \text{г}. \end{gather*}
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
\(m(\mathrm{C_2H_4})=2,8\ \text{г}\)
\(n(\mathrm{CO_2})_{\mathrm{CH_4}}+n(\mathrm{CO_2})_{\mathrm{C_2H_4}}=0,65\ \text{моль}\)
\(M(\mathrm{C_2H_4})=28\ \text{г/моль}\)
\(M(\mathrm{CH_4})=16\ \text{г/моль}\)
Знайти:
\(w(\mathrm{CH_4})\ -\ ?\)
Відповідь: 72.
Знайшли помилку? Пишіть на



