Розділ: Будова атома і періодична система хімічних елементів
Тема: Електронна оболонка атома
Кількість завдань: 34
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння використовувати знання про закономірності зміни властивостей хімічних елементів у періодичній системі й аналізувати склад і будову їхніх атомів.
А В атомах Флуору й Хлору різна загальна кількість електронів, бо в них різні порядкові номери і, відповідно, протонні числа.
Б Електронегативність Флуору більша, ніж електронегативність Хлору, оскільки в групах хімічних елементів електронегативність зменшується зі збільшенням протонних чисел атомів. Флуор – самий електронегативний елемент.
В Радіус атома Хлору більший, ніж радіус атома Флуору, оскільки в групах зі збільшенням кількості енергетичних рівнів в атомах хімічних елементів збільшується їхній радіус.
Г Окисні властивості хлору виражені слабше, ніж фтору, бо окисні властивості простих речовин галогенів зростають зі збільшенням електронегативності атомів відповідних хімічних елементів.
Відповідь: B.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
В нукліді
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку знання складу атома й розуміння причини його електронейтральності, уміння розрізняти атоми і прості йони.
Атом є електрично нейтральною частинкою, що складається з позитивно зарядженого ядра, яке практично визначає його масу (понад 99,9 %), й електронів, що оточують ядро й визначають розміри атома.
Протони й електрони – частинки, заряди яких однакові за абсолютною величиною і протилежні за знаком, нейтрони – електронейтральні.
Простий катіон – це позитивно заряджений йон, одноатомна частинка, що несе на собі один чи більше зарядів протона. Катіон – частинка, на яку перетворюється атом унаслідок утрати одного чи кількох електронів.
Тому для визначення простого катіона потрібно вибрати в таблиці рядок, у якому описано склад частинки з більшою кількістю протонів порівняно з електронами.
Цю умову задовольняє частинка, склад якої описано в рядку Г.
Відповідь: Г.
ТЕМА: Загальна хімія. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння складати електронні формули атомів, йонів.
| Символ хімічного елемента | Протонне число | Кількість електронів | Електронно-графічна формула |
Кількість неспарених електронів | ||
| 1 | 6 | 6 | 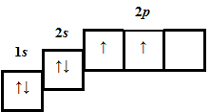 |
2 | B | |
| 2 | 19 | 19 | 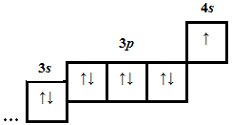 |
1 | Б | |
| 3 | 7 | 7 | 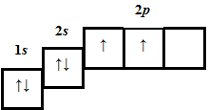 |
3 | A | |
| 4 | 20 | 18 | 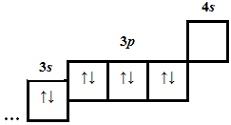 |
0 | Г |
Відповідь: 1В, 2Б, 3А, 4Г.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
| Хімічний елемент | ||
| Символ | Номер періоду в періодичній системі | |
| 5 | Б | |
| 4 | B | |
| 3 | Г | |
| 1 | A | |
Відповідь: Б В Г А.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
Тобто за умовою завдання потрібно визначити частинку, у якій кількість електронів більша за кількість протонів. Цій умові відповідає варіант відповіді A – у цій частинці кількість електронів на два більша за кількість протонів.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атомів і простих йонів. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння застосовувати знання про будову атомів і закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а радіус атома збільшується. Тому радіус атома Оксигену менший за радіус атома Сульфуру, а електронегативність – більша. В Оксигену й Сульфуру різні протонні числа, тож з огляду на електронейтральність атомів загальна кількість електронів в їхніх атомах також різна. Тобто твердження А, В і Г неправильні.
Правильним є твердження Б, оскільки Оксиген і Сульфур – елементи тієї самої головної підгрупи й утворюють леткі сполуки з Гідрогеном складу
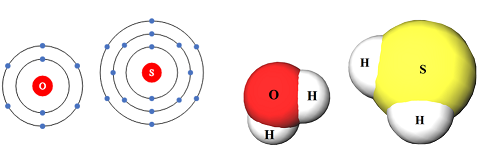
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва.
Завдання перевіряє знання електронегативності, розуміння зміни атомного радіуса та електоронегативності в групі, загальної формули летких сполук галогенів із Гідрогеном, визначення загальної кількості електронів в атомі.
Для виконання завдання необхідно розуміти, що йдеться про галогени – елементи VIIа групи. Загальна кількість електронів в атомах різна, формула летких сполук галогенів з Гідрогеном
Проаналізувавши твердження, можна зробити висновок, що правильна відповідь В.
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі. Електронегативність. Радіус атома.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах зі збільшенням протонних чисел (зверху вниз) радіус атомів хімічних елементів збільшується (рис. 1, 1), а електронегативність (рис. 1, 2) і, відповідно, окисні властивості зменшуються.
Флуор і Хлор – елементи однієї групи, але різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів (рис. 1, 1).
Тобто помилковим є твердження, наведене в рядку A.
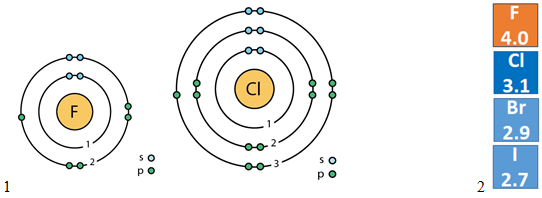
Рис. 1. 1. Будова атомів Флуору і Хлору. 2. Електронегативність галогенів
Відповідь: A.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє розуміння зміни електронегативності, радіуса атома елементів в групі та залежність властивостей елементів від радіуса атома. Зверніть увагу на виділення в умові «ПОМИЛКОВИМ»!
Необхідно розуміти, що в групі радіус атома збільшується, тому електронегативність і окисні властивості зменшується. Номер періоду показує число енергетичних рівнів в атомі. Оксиген (2 період) і Сульфур (3 період) – елементи різних періодів. Тому «ПОМИЛКОВИМ» є твердження Б.
Відповідь: Б.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо будови її атома.
Завдання скеровано на перевірку вміння встановлювати зв’язок між місцем елемента в періодичній системі, будовою його атома, формулами найважливіших сполук хімічного елемента та аналізувати їх.
Дано:
Знайти:
Магній – елемент ІІА групи періодичної системи хімічних елементів, у його атомі на зовнішньому енергетичному рівні два електрони. Відповідно в атомі шуканого елемента на зовнішньому енергетичному рівні шість електронів, тож це елемент VІА групи третього періоду.
Умову завдання задовольняє Сульфур, формула його вищого оксиду –
Відповідь: 4.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
Тобто умову завдання задовольняє пара хімічних елементів, що належать до одного періоду. Їхні протонні числа –
| Хімічний елемент | |||
| Протонне число | Символ | Номер періоду | Кількість енергетичних рівнів в атомі |
| 7 | 2 | ||
| 8 | 2 | ||
| 15 | 3 | ||
| 16 | 3 | ||
| 33 | 4 | ||
Відповідь: A.
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивості хімічних елементів у періодичній системі, зумовленої змінами в будові їхніх атомів.
Природна родина інертних елементів – Гелій, Неон, Аргон, Криптон, Ксенон і Радон. Відповідні одноатомні прості речовини – інертні гази – вирізняються тим, що мають дуже низьку реакційну здатність. Інертність зумовлено завершеністю зовнішніх енергетичних рівнів в атомах цих елементів – два електрони на зовнішньому енергетичному рівні в атомі Гелію і по вісім електронів – у решти атомів інертних елементів (рис. 1).
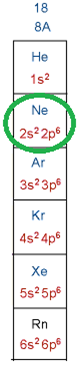
Рис. 1. Будова зовнішнього енергетичного рівня атомів інертних елементів
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність й радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Сульфуру (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Оксигену – на двох, тож радіус атома Сульфуру більший за радіус атома Оксигену |
| II | порядковий номер Неону в періодичній системі 10, у ядрі його атома 10 протонів й 11 (21 – 10) нейтронів |
| III | Хлор – елемент третього періоду, а Бром – четвертого, тому електрони в атомі Хлору перебувають на трьох, а в атомі Брому – на чотирьох енергетичних рівнях |
| IV | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Нітрогену більша за електронегативність Фосфору |
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння визначати електронну будову атома за положенням хімічного елемента в періодичній системі.
Кількість електронів в основному стані на зовнішньому енергетичному рівні атомів хімічних елементів визначають за номером групи.
| A | 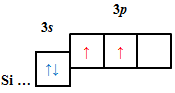 |
| Б | 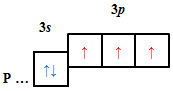 |
| В | 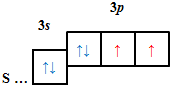 |
| Г | 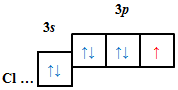 |
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати кількість енергетичних рівнів в електронній оболонці атомів за місцем хімічних елементів у періодичній системі.
Кількість енергетичних рівнів в електронній оболонці атома збігається з номером періоду, до якого належить хімічний елемент.
| Символ хімічного елемента | Номер періоду | Кількість енергетичних рівнів в атомі | |
| 2 | 2 | Б | |
| 3 | 3 | A | |
| 4 | 4 | B | |
| 5 | 5 | Г |
Відповідь: Б, А, В, Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів того самого періоду.
У періодах зі зростанням протонного числа збільшується кількість електронів на зовнішньому енергетичному рівні атомів хімічних елементів. Ця закономірність справедлива й для елементів 3 періоду (рис. 1).

Рис. 1. Будова зовнішнього енергетичного рівня атомів хімічних елементів 3 періоду
Відповідь: Г.
ТЕМА: Будова атома. Нукліди. Ізотопи.
Завдання скеровано на перевірку вміння аналізувати склад нуклідів.
Нуклідний символ – символ нукліда хімічного елемента, біля якого зазначено масове число, як лівий верхній індекс і атомний номер, як лівий нижній
| Ознака порівняння | Нуклідний символ | ||
| Висновок | |||
| Заряд ядра (дорівнює протонному числу й порядковому номеру в періодичній системі) | +8 | +8 | Мають однаковий заряд ядра |
| Кількість електронів (дорівнює протонному числу) | 8 | 8 | Містять однакову кількість електронів |
| Нуклонне число (дорівнює сумі кількості протонів і нейтронів) | 16 | 18 | Мають різні нуклонні числа |
| Кількість нейтронів (дорівнює різниці нуклонного й протонного чисел) | 8 (16 – 8) |
10 (18 – 8) |
Містять різну кількість нейтронів |
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атомів.
Завдання скеровано на перевірку знання закономірностей зміни в періодичній системі кількості енергетичних рівнів в атомах.
Кількість енергетичних рівнів в атомі хімічного елемента дорівнює кількості енергетичних рівнів у його атомі.
| Символ хімічного елемента | Номер періоду в періодичній системі хімічних елементів | Кількість енергетичних рівнів в атомі | ||
| A | 1 | 1 | 1 | |
| Б | 2 | 2 | 2 | |
| B | 4 | 4 | 4 | |
| Г | 3 | 3 | 3 |
Відповідь: А, Б, Г, В.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів хімічних елементів однієї підгрупи періодичної системи.
A у цих елементів різні протонні числа, а тому й різна кількість електронів в атомах
Б це елементи однієї підгрупи (VIIА), тому в їхніх атомах однакова кількість (7) електронів на зовнішньому енергетичному рівні
B це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів
Г це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних підрівнів
Електронна формула атома Хлору
Електронна формула атома Брому
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
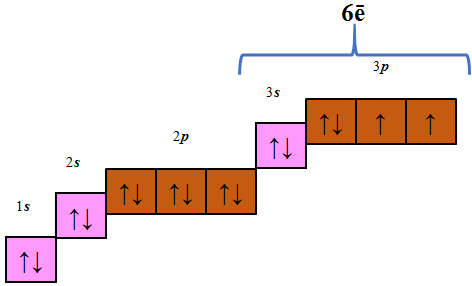
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Радіус атома.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і радіус атома.
У поданому ряду хімічних елементів збільшуються їхні протонні числа. Тому з огляду на електронейтральність атомів загальна кількість електронів на зовнішньому енергетичному рівні також збільшується.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи й у поданому ряду хімічних елементів збільшується.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується. Подані елементи належать до одного періоду, тому зі збільшенням протонного числа їхня електронегативність збільшується.
Атомний радіус – половина віддалі, на якій перебувають сусідні атоми в структурі простої речовини. Величина залежить від алотропної видозміни елемента. Також атомним радіусом називають половинну відстань між ядрами атомів того самого елемента, коли атоми зв’язані одинарним ковалентним зв’язком або перебувають у кристалі металу. У періодах зі збільшенням протонних чисел атомні радіуси зменшуються, у групах хімічних елементів – збільшуються (рис. 1). Подані елементи належать до одного періоду, тому зі збільшенням протонного числа збільшується електронегативність атомів.
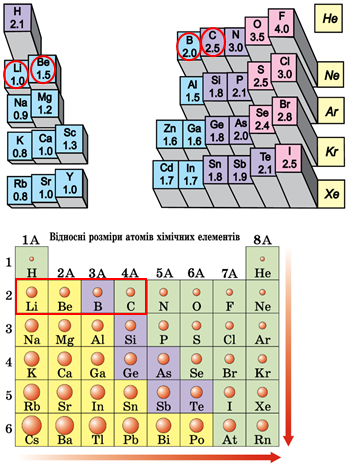
Рис. 1. Закономірності зміни електронегативності й радіуса атомів хімічних елементів у періодичній системі
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
A Натрій – хімічний елемент І А, а Хлор – VII А групи періодичної системи, в атомі Натрію один, а в атомі Хлору – сім електронів на зовнішньому енергетичному рівні
Б Натрій і Хлор – хімічні елементи третього періоду періодичної системи, електрони в їхніх атомах перебувають на трьох енергетичних рівнях
В Натрій – s-елемент, а Хлор p-елемент, тому кількість енергетичних рівнів, на яких перебувають електрони в їхніх атомах, різна
Г у Натрію і Хлору різні протонні числа, і, відповідно, різні кількості електронів в атомах
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
В атомі хімічного елемента 17 електронів (6
Відповідь: Г.
ТЕМА: Загальна хімія. Групи хімічних елементів.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у групах.
У групах хімічних елементів зі збільшенням протонного числа збільшується кількість енергетичних рівнів в атомах хімічних елементів.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Кількість енергетичних рівнів в атомі.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в атомі за його місцем у періодичній системі.
Кількість енергетичних рівнів, на яких містяться електрони в атомі, визначають за номером періоду, у якому розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів того самого періоду. З-поміж наведених це елементи з протонними числами
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
Силіцій і Сульфур – елементи третього періоду, тобто електрони в їхніх атомах містяться на трьох енергетичних рівнях:
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння порівнювати енергетичні підрівні за енергією.
Електронні хмари різних форм відрізняються силою притягання до ядра, а самі електрони розташовані навколо ядра шарами. Енергія електрона є його найважливішою характеристикою. Електрони, які розташовані в атомі в орбіталях однакової форми і розміру, мають однакову енергію. Електрони спочатку заповнюють орбіталі з нижчою енергією (рис. 1).
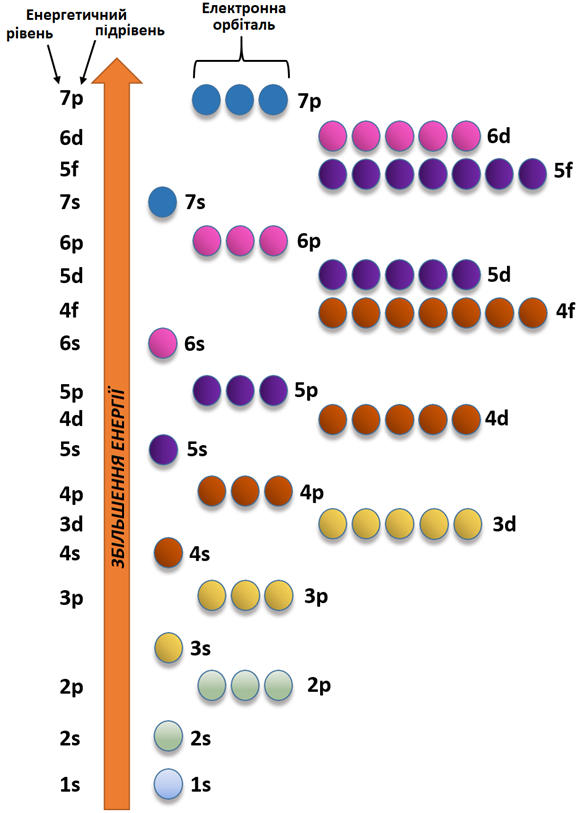
Рис. 1. Послідовність заповнення електронами енергетичних підрівнів
Відповідь: Б.
ТЕМА: Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння складати електронні формули атомів, йонів.
У катіоні
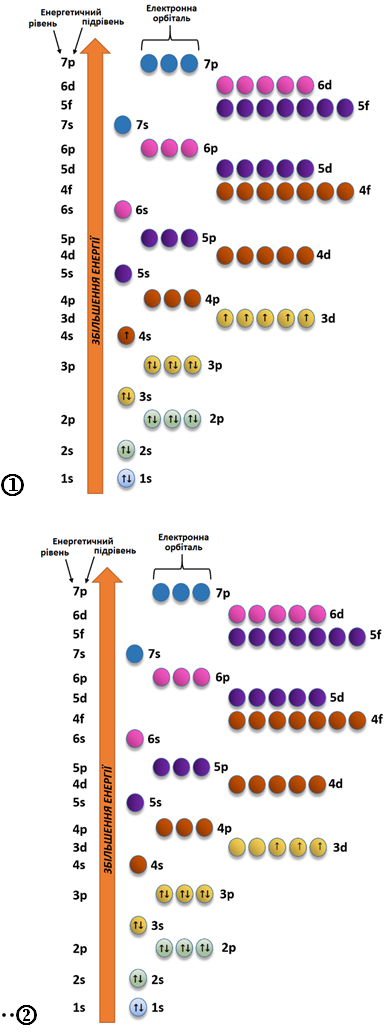
Рис. 1. Електронна будова атома Хрому (1) і катіона
Відповідь: 9.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
| Хімічний елемент | ||
| Символ | Номер періоду | |
| 2 | Г | |
| 3 | A | |
| 4 | Б | |
| 5 | B | |
Відповідь: Г А Б В.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
| Хімічний елемент | ||
| Символ | Номер періоду в періодичній системі | |
| 2 | Б | |
| 3 | A | |
| 4 | B | |
| 5 | Г | |
Відповідь: Б А В Г.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів другого періоду послідовно збільшуються номери груп, до яких вони належать, і, відповідно, кількість електронів на зовнішньому енергетичному рівні їхніх атомів.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його гідроксиду становить
Тобто йдеться про Кальцій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: Б.




