Розділ: Будова атома і періодична система хімічних елементів
Тема: Електронні формули атомів, йонів
Кількість завдань: 39
ТЕМА: Електронна будова атома. Вищі оксиди. Визначення валентності за формулою.
Завдання скеровано на перевірку знання електронних конфігурацій елементів перших трьох періодів, уміння визначати валентність елемента за формулою його оксиду, зіставляти електронні конфігурації атомів із місцем елемента в періодичній таблиці й хімічними властивостями.
Формула вищого оксиду:
Кожен атом
Тривалентний елемент міститься в групи
Отже, ідеться про Алюміній – хімічний елемент
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні формули.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів і зіставляти їх з місцем елемента в періодичній таблиці.
За кількістю електронів в електронній формулі можна визначити протонні числа й номери хімічних елементів у періодичній таблиці. Отже, наведено електронні формули Оксигену, Сульфуру, Магнію, Карбону.
Вищий оксид
Також можна було не вдаватися до визначення конкретних хімічних елементів, а проаналізувати будову зовнішнього енергетичного рівня. У вищому оксиді складу
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння аналізувати будову атомів і простих йонів, розподіл електронів у них за енергетичними рівнями.
Електронні формули частинок, назви яких наведено в умові, такі:
катіон
атом
аніон
атом
Умову завдання задовольняє катіон
Відповідь: A.
ТЕМА: Будова атома. Періодична система хімічних елементів. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння використовувати періодичну систему хімічних елементів як довідкову для складання електронних формул атомів.
| Назва хімічного елемента | Електронна формула | Кількість електронів в атомі | |
| Карбон | |||
| Неон | |||
| Магній | |||
| Сульфур | |||
Відповідь: B.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Склад і будова атомів хімічних елементів. Електронні формули атомів.
Завдання скеровано на перевірку вміння аналізувати положення хімічного елемента в періодичній системі, визначати електронні формули атомів.
Формула вищого оксиду хімічного елемента
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку знання складу атома й розуміння причини його електронейтральності, уміння розрізняти атоми і прості йони.
Атом є електрично нейтральною частинкою, що складається з позитивно зарядженого ядра, яке практично визначає його масу (понад 99,9 %), й електронів, що оточують ядро й визначають розміри атома.
Протони й електрони – частинки, заряди яких однакові за абсолютною величиною і протилежні за знаком, нейтрони – електронейтральні.
Простий катіон – це позитивно заряджений йон, одноатомна частинка, що несе на собі один чи більше зарядів протона. Катіон – частинка, на яку перетворюється атом унаслідок утрати одного чи кількох електронів.
Тому для визначення простого катіона потрібно вибрати в таблиці рядок, у якому описано склад частинки з більшою кількістю протонів порівняно з електронами.
Цю умову задовольняє частинка, склад якої описано в рядку Г.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
| Нуклідний символ частинки | Протонне число, зарядове число, порядковий номер, |
Кількість електронів в атомі | Масове або нуклонне число, |
Нейтронне число, |
| 10 | 10 | 20 | 10 (20 - 10) | |
| 11 | 10 (11-1) | 23 | 12 (23 - 11) | |
| 9 | 10 (9 - 1) | 19 | 10 (19 - 9) |
Відповідь: Г.
ТЕМА: Загальна хімія. Місце хімічного елемента в періодичній системі. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронну формулу атома хімічного елемента й визначати його місце в періодичній системі.
Кількість електронів в атомі хімічного елемента дорівнює його протонному числу та, відповідно, порядковому номеру в періодичній системі.
У завданні йдеться про Ванадій, порядковий номер якого в періодичній системі – 23.
Це – елемент V групи побічної підгрупи (VБ або 5 групи), четвертого періоду періодичної системи.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Нітрогену
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Силіцію
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома.
Завдання перевіряє розуміння поняття нуклід та йон.
Для виконання завдання необхідно розуміти, що означає умовний запис нуклідного символу. Якщо подивитися на запис нуклідного символу, то бачимо: 13 – протонне число (Z – кількість протонів в атомі), окрім цього, порядковий номер елемента показує число електронів в атомі. За умовою в завданні наведено катіон (позитивно заряджена частинка), який утворюється за умови, якщо атом віддає електрони. Заряд +3 означає, що атом віддав три електрони, тому
Відповідь: A.
ТЕМА: Загальна хімія. Протонне число. Електронна будова атомів і простих йонів.
Завдання скеровано на перевірку вміння аналізувати будову атомів і простих йонів.
| Хімічний символ | Порядковий номер у періодичній системі | Протонне число | Кількість електронів |
| 19 | 19 | ||
| 18 (19 – 1) | |||
| 20 | 20 (18 + 2) | ||
В атомі невідомого елемента
Відповідь: 20.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у групах.
Завдання скеровано на перевірку вміння порівнювати властивості хімічних елементів у групах.
У завданні наведено електронні формули атомів лужних елементів Літію, Натрію, Калію та елемента побічної підгрупи Аргентуму. Відновні властивості – здатність віддавати електрони зовнішнього енергетичного рівня – посилюються зі збільшенням радіуса атома від Літію до Калію. Срібло малоактивний метал, відновні властивості Аргентуму виражені найслабше порівняно з іншими елементами, про які йдеться в завданні.
Відповідь: Г, Б, В, А.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
Атом електронейтральний, кількість електронів в атомі збігається з його протонним числом. Бром – типовий неметалічний елемент, в його атомі сім електронів на зовнішньому енергетичному рівні. Для завершення зовнішнього енергетичного рівня атому Брому не вистачає електрона, прийнявши який він перетворюється на однозарядний аніон
| Формула частинки | Порядковий номер у періодичній системі | Протонне число | Кількість електронів |
| 15 | |||
| 34 | |||
| 36 | |||
| 54 | |||
| 35 | 36 | ||
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Електронні формули.
Завдання скеровано на перевірку вміння аналізувати електронні формули, розпізнавати електронні формули неметалічних елементів.
Особливістю атомів неметалічних елементів є те, що їхній зовнішній енергетичний рівень близький до завершення.
Умову завдання задовольняє Фосфор (протонне число
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронні формули
Завдання скеровано на перевірку вміння складати електронні формули атомів і простих йонів.
Катіон
Електронні формули атома й катіона Феруму такі:
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Електронні формули. Основний і збуджений стани атома.
Завдання скеровано на перевірку вміння складати й аналізувати електронні формули атомів в основному й збудженому станах.
Графічний варіант електронної формули атома Силіцію в основному стані наведено на рисунку 1.
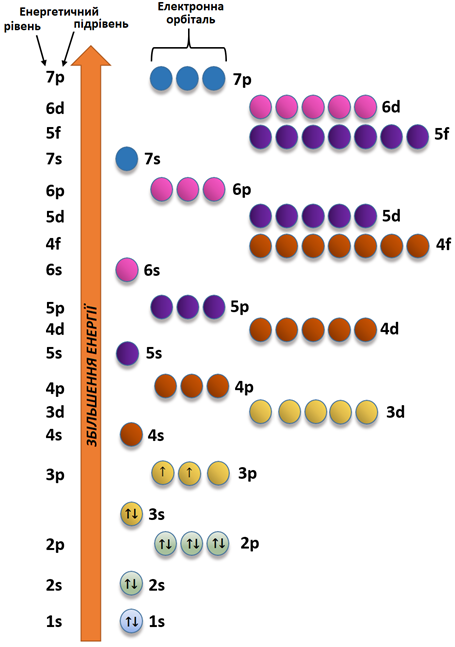
Рис. 1. Електронна формула атома Силіцію в основному стані
В атомі Силіцію в основному стані два неспарених p-електрони.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння розпізнавати електронні формули атомів і простих йонів.
Порядковий номер Магнію в періодичній системі хімічних елементів і, відповідно, його протонне число – 12. Тобто в ядрі атома Магнію 12 протонів, а навколо ядра – 12 електронів.
Порядковий номер Літію в періодичній системі хімічних елементів і, відповідно, його протонне число – 3. Тобто в ядрі атома Літію три протони, а навколо ядра – три електрони.
У катіоні Натрію (протонне число 11) на один електрон менше, ніж в атомі – 10.
У хлорид-аніоні (протонне число Хлору – 17) на один електрон більше, ніж в атомі – 18.
| Частинка | Порядковий номер хімічного елемента в періодичній системі | Протонне число |
Заряд частинки | Кількість електронів навколо ядра | Електронна формула частинки | ||
1 |
Атом Магнію |
12 | 12 | 0 | 12 | Б |
|
2 |
Атом Літію |
3 | 3 | 0 | 3 | Д |
|
3 |
Катіон Натрію |
11 | 11 | +1 | 10 | Г |
|
4 |
Хлорид-аніон |
17 | 17 | -1 | 18 | A |
Відповідь: 1Б, 2Д, 3Г, 4А.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи простих йонів.
| Символ хімічного елемента | Порядковий номер хімічного елемента в періодичній системі |
Кількість електронів | |
| в атомі | у йоні | ||
| 12 | 12 | 10 | |
| 11 | 11 | 10 | |
| 4 | 4 | 2 | |
| 3 | 3 | 2 | |
| 9 | 9 | 10 | |
| 17 | 17 | 18 | |
Відповідь: A.
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність і радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Хлору (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Флуору – на двох, тож радіус атома Хлору більший за радіус атома Флуору |
| II | порядковий номер Сульфуру в періодичній системі |
| III | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Оксигену більша за електронегативність Сульфуру |
| IV | в атомі Сульфуру |
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння визначати електронну будову атома за положенням хімічного елемента в періодичній системі.
Кількість електронів в основному стані на зовнішньому енергетичному рівні атомів хімічних елементів визначають за номером групи.
| A | 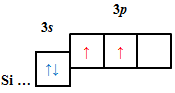 |
| Б | 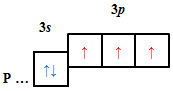 |
| В | 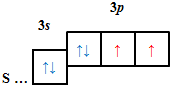 |
| Г | 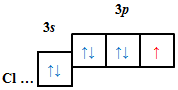 |
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атомів хімічних елементів.
Кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп періодичної системи збігається з номером групи:
| Назва хімічного елемента | Номер групи | Електронна формула | ||
| 1 | Сульфур | VIА | B | |
| 2 | Хлор | VIIА | Б | |
| 3 | Магній | IIА | A | |
| 4 | Калій | IА | Г |
Відповідь: В, Б, А, Г.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Умовний запис будови електронних оболонок атомів називають електронною формулою. Наведена в умові формула вищого оксиду
Умову завдання задовольняє електронна формула
Відповідь: B.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння визначати кількість електронів в атомі, йоні.
Порядковий номер Сульфуру в періодичній системі хімічних елементів
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронні формули атомів і простих йонів.
Завдання скеровано на перевірку вміння складати й аналізувати електронні формули атомів і простих йонів.
Усі хімічні елементи, про які йдеться в завданні, розташовані в третьому періоді, тобто електрони в їхніх атомах розподілено за трьома енергетичними рівнями. Хлор – хімічний елемент 7А групи, Магній – 2А, Сульфур – 6А, Алюміній – 3А. На зовнішньому енергетичному рівні в їхніх атомах міститься відповідно 7, 2, 6 і 3 електрони.
| 1 | Протонне число Хлору 17, тобто 17 електронів в його атомі розподілено по трьох енергетичних рівнях:
|
B |
| 2 | Протонне число Магнію 12, тобто 12 електронів в його атомі розподілено по трьох енергетичних рівнях:
|
Г |
| 3 | Протонне число Сульфуру 16, тобто 16 електронів у її атомі розподілено по трьох енергетичних рівнях. У простому аніоні Сульфуру на два електрони більше:
|
Б |
| 4 | Протонне число Алюмінію 13, тобто 13 електронів в його атомі розподілено по трьох енергетичних рівнях. В катіоні Алюмінію на три електрони менше:
|
Д |
Відповідь: 1В, 2Г, 3Б, 4Д.
ТЕМА: Загальна хімія. Склад і будова атомів хімічних елементів. Електронні формули атомів і простих йонів.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів і простих йонів.
| Частинка | Протонне число | Кількість електронів в атомі |
Електронна формула | ||
| 1 | Атом |
19 | 19 | A | |
| 2 | Атом |
9 | 9 | Д | |
| 3 | Йон |
12 | 10 | Г | |
| 4 | Йон |
16 | 18 | Б |
Відповідь: 1А, 2Д, 3Г, 4Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
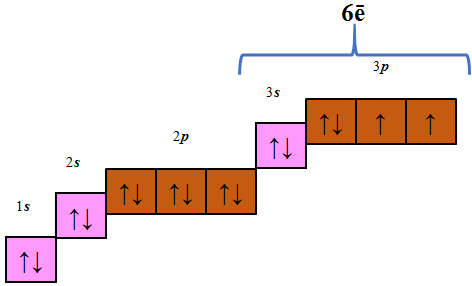
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
Усі хімічні елементи, про які йдеться в завданні, розташовані в третьому періоді, тобто електрони в їхніх атомах розподілено за трьома енергетичними рівнями. Натрій – хімічний елемент 1А групи, Магній – 2А, Силіцій – 4А, Хлор – 7А. На зовнішньому енергетичному рівні в їхніх атомах міститься відповідно 1, 2, 4 і 7 електронів.
| 1 | Протонне число Магнію 12, тобто 12 електронів в його атомі розподілено по трьох енергетичних рівнях. У двозарядному катіоні Магнію на два електрони менше: |
Д |
| 2 | Протонне число Хлору 17, тобто 17 електронів в його атомі розподілено по трьох енергетичних рівнях. В однозарядному аніоні Хлору на електрон більше: |
A |
| 3 | Протонне число Натрію 11, тобто 11 електронів в його атомі розподілено по трьох енергетичних рівнях: |
Г |
| 4 | Протонне число Силіцію 14, тобто 14 електронів в його атомі розподілено по трьох енергетичних рівнях: |
B |
Відповідь: 1Д, 2А, 3Г, 4В.
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
Електронна формула атома Натрію
Катіон
Електронна формула атома Флуору
Аніон
| Частинка | Кількість | |||
| протонів |
нуклонів |
нейтронів |
електронів | |
| 11 | 23 | 12 | 10 | |
| 9 | 19 | 10 | 10 | |
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
| 1 | Протонне число елемента другого періоду Флуору – 9, тобто 9 електронів в його атомі розподілено по двох енергетичних рівнях. В однозарядному аніоні Флуору на електрон більше:
|
B |
| 2 | Протонне число елемента четвертого періоду Кальцію 20, тобто 20 електронів в його атомі розподілено по чотирьох енергетичних рівнях. У двозарядному катіоні Кальцію на два електрони менше:
|
A |
| 3 | Протонне число Натрію 11, тобто 11 електронів в його атомі розподілено по трьох енергетичних рівнях:
|
Б |
| 4 | Протонне число елемента другого періоду Нітрогену 7, тобто 7 електронів в його атомі розподілено по двох енергетичних рівнях:
|
Г |
Відповідь: 1В, 2А, 3Б, 4Г.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
В атомі хімічного елемента 17 електронів (6
Відповідь: Г.
ТЕМА: Загальна хімія. Електронна формула. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодичній системі.
У завданні наведено електронні формули атомів елементів третього періоду. У періоді зі збільшенням кількості електронів на зовнішньому енергетичному рівні атомів посилюються неметалічні властивості хімічних елементів.
| Б | |
| A | |
| Г | |
| B |
Відповідь: Б А Г В.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Нітроген | Г | |
| 2 | Карбон | B | |
| 3 | Сульфур | Д | |
| 4 | Силіцій | A |
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів в атомах хімічних елементів дорівнює порядковому номеру елемента в періодичній системі (протонному числу).
| Назва хімічного елемента | Протонне число | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Літій | 3 | Б | |
| 2 | Купрум | 29 | Д | |
| 3 | Ферум | 26 | A | |
| 4 | Флуор | 9 | Г |
Відповідь: 1Б, 2Д, 3А, 4Г.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння порівнювати активність металів за їхнім положенням у ряду активності.
Здатність середніх солей взаємодіяти в розчині з металами можна спрогнозувати за довідковою таблицею «Ряд активності металів» (рис. 1).

Рис. 1. Ряд активності металів
Що лівіше розташований метал у цьому ряду, то він активніший. Тобто витіснятиме з розчинів солей метали, розміщені правіше від нього, легше руйнуватиметься під дією різних чинників – кородуватиме.
В умові завдання наведено фрагменти електронних формул, за якими можна визначити металічний елемент і, відповідно, метал:
| Символ хімічного елемента | Фрагмент електронної формули | Електронна формула |
Із-поміж металів, про які йдеться в умові завдання, найактивнішим є алюміній. Однак щільна оксидна плівка захищає його від корозії. Тому правильною відповіддю є залізо.
Відповідь: A.
ТЕМА: Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння складати електронні формули атомів, йонів.
У катіоні
Рис. 1. Електронна будова атома Хрому (1) і катіона
Відповідь: 9.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Карбону
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Сульфур | VI | Д | |
| 2 | Хлор | VII | Б | |
| 3 | Калій | I | Г | |
| 4 | Кальцій | II | A |
Відповідь: 1Д, 2Б, 3Г, 4А.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Алюмінію
Відповідь: Б.




