Розділ: Будова атома і періодична система хімічних елементів
Тема: Групи й підгрупи хімічних елементів
Кількість завдань: 76
ТЕМА: Періодична система хімічних елементів. Метали і неметали.
Завдання скеровано на перевірку знання ознак неметалів і їхнього місця в періодичній таблиці, уміння класифікувати хімічні елементи за їхніми фізико-хімічними властивостями.
У фрагменті таблиці наведено хімічні символи й зазначено відносні атомні маси десяти елементів. З-поміж них п’ять хімічних елементів належать до неметалічних: Бор, Карбон, Нітроген, Силіцій і Фосфор.
Такого висновку легко дійти, якщо взяти до уваги, що елементи побічних підгруп (у наведеному фрагменті таблиці це Скандій, Титан, Ванадій) є металічними. Алюміній – типовий металічний елемент, а в Галію металічні властивості виражені сильніше, ніж в Алюмінію, бо електрони зовнішнього енергетичного рівня розташовані на більшій відстані від ядра атома. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах – знизу догори.
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній таблиці.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах періодичної таблиці електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Електронегативність хімічних елементів збільшується в
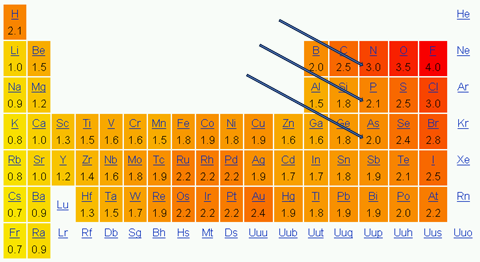
Відповідь: A.
ТЕМА: Будова атома й періодична система хімічних елементів. Групи й підгрупи хімічних елементів.
Завдання скеровано на перевірку вміння характеризувати хімічні елементи за їхнім місцем у періодичній системі.
А наведено символи хімічних елементів, що належать до різних груп:
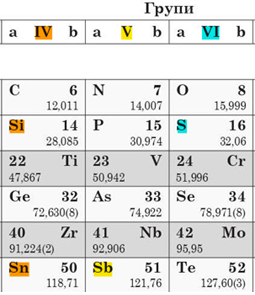
Б поміж цих елементів немає галогенів
В поміж цих елементів є металічний –
Г валентності елементів у вищих оксидах
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічний елемент.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за властивостями простих речовин, які вони утворюють.
Неметалічним елементом є Карбон. Він утворює прості речовини-неметали, вищий оксид Карбону кислотний.
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати зміни властивостей хімічних елементів і простих речовин.
Флуор, Хлор, Бром, Йод – елементи
Символи хімічних елементів розташовані в умові завдання за збільшенням їхніх протонних чисел. У групах хімічних елементів зі збільшенням протонних чисел посилюються металічні і послаблюються неметалічні й окисні властивості елементів і відповідних простих речовин, збільшуються радіуси атомів і зменшується електронегативність.
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Хімічна формула.
Завдання скеровано на перевірку розуміння терміну «лужні елементи» й уміння використовувати періодичну систему хімічних елементів як довідкову.
Елементи першої групи періодичної системи (за винятком Гідрогену) називають лужними.
У всіх них зовнішня електронна оболонка
З-поміж наведених варіантів умову завдання задовольняють елементи Літій, Натрій, Калій, хімічні символи яких
Відповідь: Г.
ТЕМА: Класифікація хімічних елементів. Лужні елементи.
Завдання скеровано на перевірку знання класифікації хімічних елементів.
До лужних належать елементи 1А групи періодичної системи (рис. 1).
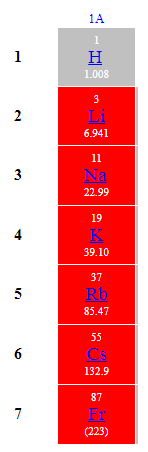
Рис. 1. Лужні елементи
Відповідь: Г.
ТЕМА: Загальна хімія. Місце хімічного елемента в періодичній системі. Найважливіші сполуки хімічного елемента – вищий оксид, гідрат вищого оксиду, летка сполука з Гідрогеном.
Завдання скеровано на перевірку вміння за місцем хімічного елемента в періодичній системі визначати формули його найважливіших сполук.
Хімічний елемент № 14 – Силіцій – міститься в IVА (14) групі періодичної системи. Відповідно формули його леткої сполуки з Гідрогеном і вищого оксиду зазначено в короткоперіодній формі періодичної системи:
Відповідь: Б.
ТЕМА: Загальна хімія. Місце хімічного елемента в періодичній системі. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронну формулу атома хімічного елемента й визначати його місце в періодичній системі.
Кількість електронів в атомі хімічного елемента дорівнює його протонному числу та, відповідно, порядковому номеру в періодичній системі.
У завданні йдеться про Ванадій, порядковий номер якого в періодичній системі – 23.
Це – елемент V групи побічної підгрупи (VБ або 5 групи), четвертого періоду періодичної системи.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Нітрогену
Відповідь: A.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів VIIА групи зі збільшенням протонного числа збільшується кількість енергетичних рівнів. Флуор, Хлор, Бром, Йод, Астат – елементи другого, третього, четвертого, п’ятого, шостого періодів відповідно, а номер періоду дорівнює кількості енергетичних рівнів в атомі.
Відповідь: Г.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння розрізняти головні й побічні підгрупи.
Періодична система хімічних елементів – це графічний вираз періодичного закону. Нині в періодичній системі
Група це вертикальна колонка періодичної таблиці. До кожної з восьми груп (короткоперіодна форма періодичної системи) входять дві підгрупи хімічних елементів.
До головних підгруп належать елементи малих періодів та їхні аналоги з великих періодів. Поміж елементів головних підгруп є як металічні, так і неметалічні. У головних підгрупах зі зростанням атомних мас поступово посилюється металічний і послаблюється неметалічний характер елементів.
Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
Умову завдання задовольняє добірка елементів ІІБ підгрупи
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його оксиду становить
Тобто йдеться про Натрій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Силіцію
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння застосовувати знання про будову атомів і закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а радіус атома збільшується. Тому радіус атома Оксигену менший за радіус атома Сульфуру, а електронегативність – більша. В Оксигену й Сульфуру різні протонні числа, тож з огляду на електронейтральність атомів загальна кількість електронів в їхніх атомах також різна. Тобто твердження А, В і Г неправильні.
Правильним є твердження Б, оскільки Оксиген і Сульфур – елементи тієї самої головної підгрупи й утворюють леткі сполуки з Гідрогеном складу
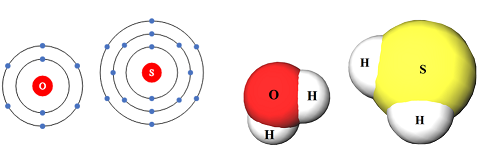
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Електронегативність. Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання і розуміння періодичного закону і зміни властивостей елементів у групах.
Для виконання завдання необхідно розуміти, що Карбон і Силіцій – елементи IV групи головної підгрупи. Необхідно знати, що електронегативність
У групі
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє знання поняття основних класів неорганічних сполук, уміння визначати елемент, який утворює кислоту, і відповідні солі за формулами солей.
Для виконання завдання необхідно знати, що солі утворюються з кислот, а кислоти утворюють неметалічні елементи. Хімічний елемент
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва.
Завдання перевіряє знання електронегативності, розуміння зміни атомного радіуса та електоронегативності в групі, загальної формули летких сполук галогенів із Гідрогеном, визначення загальної кількості електронів в атомі.
Для виконання завдання необхідно розуміти, що йдеться про галогени – елементи VIIа групи. Загальна кількість електронів в атомах різна, формула летких сполук галогенів з Гідрогеном
Проаналізувавши твердження, можна зробити висновок, що правильна відповідь В.
Відповідь: B.
ТЕМА: Металічні елементи та хні сполуки. Метали. Лужні та лужноземельні елементи.
Завдання перевіряє визначення лужних елементів та їхнє положення в періодичній системі.
Для виконання завдання необхідно знати, які елементи називають лужними і де вони знаходяться в періодичній системі. Лужні елементи – це елементи Іа групи (перша група головна підгрупа). Із запропонованих правильною відповіддю є лише Г.
Відповідь: Г.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Сила кислот.
Завдання скеровано на перевірку розуміння закономірностей зміни сили кислот – водних розчинів гідроген галогенідів.
У підгрупі галогенів зі збільшенням протонного числа хімічних елементів збільшується ступінь дисоціації і, відповідно, сила кислот. Це зумовлено зменшенням електронегативності і збільшенням радіуса атомів галогенів, збільшенням довжини зв’язку
Відповідь: В А Г Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи.
Завдання скеровано на перевірку вміння здобувати інформацію з періодичної системи періодичних елементів.
Галогени – елементи VIIА (17) групи періодичної системи. Загальна формула леткої сполуки галогену з Гідрогеном –
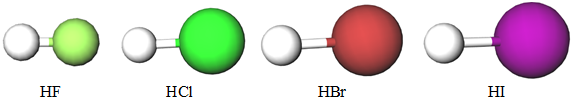
Відповідь: A.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали.
Завдання скеровано на перевірку вміння розпізнавати назви металічних елементів.
Лужні елементи належать до першої групи головної підгрупи періодичної системи (рис. 1).
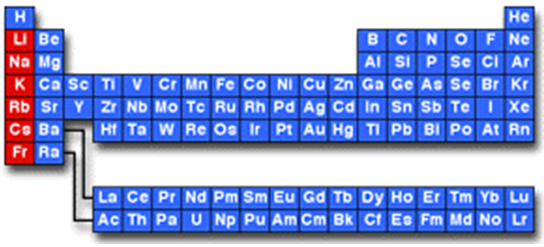
Рис. 1. Місце лужних елементів у періодичній системі
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи. Електронні формули атомів.
Завдання скеровано на перевірку вміння розпізнавати електронні формули лужноземельних елементів.
Лужноземельні елементи належать до головної підгрупи другої групи (ІІА групи), у їхніх атомах на зовнішньому енергетичному рівні два електрони.
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи.
Умову завдання задовольняють Літій, Натрій, Калій – елементи першої групи головної підгрупи (ІА групи) періодичної системи.
Відповідь: Б.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо будови її атома.
Завдання скеровано на перевірку вміння встановлювати зв’язок між місцем елемента в періодичній системі, будовою його атома, формулами найважливіших сполук хімічного елемента та аналізувати їх.
Дано:
Знайти:
Магній – елемент ІІА групи періодичної системи хімічних елементів, у його атомі на зовнішньому енергетичному рівні два електрони. Відповідно в атомі шуканого елемента на зовнішньому енергетичному рівні шість електронів, тож це елемент VІА групи третього періоду.
Умову завдання задовольняє Сульфур, формула його вищого оксиду –
Відповідь: 4.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння визначати формули найважливіших сполук хімічного елемента за його місцем у періодичній системі.
Елемент № 16 у періодичній системі – Сульфур – міститься в 6А (16) групі. В атомі цього елемента на зовнішньому енергетичному рівні шість електронів, тож його вищий ступінь окиснення
Формули його леткої сполуки з Гідрогеном, вищого оксиду й кислоти такі:
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння поняття «валентні електрони» й уміння визначати валентні можливості атомів.
Валентний електрон – електрон, що може утворювати хімічні зв’язки, в атомі, а отже, визначає поведінку атома в хімічних реакціях.
Електронна конфігурація атома Сульфуру
Електронна конфігурація атома Хрому
Сульфур і Хром – елементи різних періодів, у їхніх атомах різна кількість енергетичних рівнів і валентних орбіталей.
У бінарних сполуках із Гідрогеном Сульфур(ІІ) і Хром(ІІ) мають різні ступені окиснення:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Кислоти. Солі.
Завдання скеровано на перевірку вміння складати формули багатоосновних оксигеновмісних кислот і відповідних кислих солей.
Проаналізувавши наведені формули речовин, можна дійти висновку, що йдеться про солі двохосновних оксигеновмісних кислот, утворених хімічним елементом, ступені окиснення атомів якого в них дорівнюють +4 і +6:
Умову завдання задовольняє Сульфур, який утворює двохосновні оксигеновмісні кислоти – сульфітну
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, класифікувати хімічні елементи за будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах Берилію, Магнію, Кальцію заповнюється електронами зовнішній s-підрівень, тому вони належать до s-елементів (рис. 1).
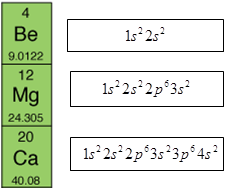
Рис. 1. Будова атомів Берилію, Магнію, Кальцію
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивості хімічних елементів у періодичній системі, зумовленої змінами в будові їхніх атомів.
Природна родина інертних елементів – Гелій, Неон, Аргон, Криптон, Ксенон і Радон. Відповідні одноатомні прості речовини – інертні гази – вирізняються тим, що мають дуже низьку реакційну здатність. Інертність зумовлено завершеністю зовнішніх енергетичних рівнів в атомах цих елементів – два електрони на зовнішньому енергетичному рівні в атомі Гелію і по вісім електронів – у решти атомів інертних елементів (рис. 1).
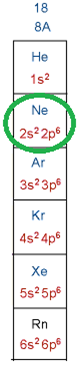
Рис. 1. Будова зовнішнього енергетичного рівня атомів інертних елементів
Відповідь: Б.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Групи хімічних елементів.
Завдання скеровано на перевірку вміння розпізнавати представників груп елементів у періодичній системі.
| 1 | Лужні елементи належать до ІА групи періодичної системи | B | |
| 2 | Лужноземельні елементи належать до ІІА групи періодичної системи | Д | |
| 3 | Галогени належать до VIІА групи періодичної системи | Г | |
| 4 | Інертні елементи належать до VIIІА групи періодичної системи | Б |
Відповідь: В, Д, Г, Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Групи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи.
До однієї підгрупи IVA (14) належать Силіцій

Рис. 1. Силіцій
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову атома за місцем хімічного елемента в періодичній системі.
За кількістю електронів на зовнішньому енергетичному рівні можна дійти висновку, що йдеться про хімічний елемент ІІІА (13) групи. Тобто формула його гідроксиду
Відносна атомна маса елемента ІІІА (13) групи Алюмінію –
Його порядковий номер і, відповідно, протонне число, –
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Умовний запис будови електронних оболонок атомів називають електронною формулою. Наведена в умові формула вищого оксиду
Умову завдання задовольняє електронна формула
Відповідь: B.
ТЕМА: Неметалічні елементи. Галогени.
Завдання скеровано на перевірку знання фізичних властивостей галогенів.
За нормальних умов
| Назва галогену | Температура плавлення, °C |
| Фтор | -220 |
| Хлор | -101 |
| Бром | -7 |
| Йод | -113,5 |
Відповідь: A.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
Періодична система хімічних елементів - це графічний вираз періодичного закону. Структурними одиницями періодичної системи є періоди і групи хімічних елементів.
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
До головних підгруп належать елементи малих періодів та їхні аналоги з великих періодів. Поміж елементів головних підгруп є як металічні, так і неметалічні. У головних підгрупах зі зростанням атомних мас поступово посилюється металічний і послаблюється неметалічний характер елементів. Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Виведення хімічної формули.
Завдання скеровано на перевірку вміння визначати хімічну формулу вищого оксиду за місцем елемента в періодичній системі хімічних елементів.
Порядковий номер 33 в періодичній системі хімічних елементів має Арсен. Це елемент 5А (15) групи. На зовнішньому енергетичному рівні в атомі Арсену п’ять електронів. Загальна формула вищих оксидів елементів цієї групи
Відповідь: 7.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Природні родини хімічних елементів. Галогени.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
Галогени – елементи VIIА (17) групи періодичної системи хімічних елементів – Флуор, Хлор, Бром, Йод, Астат. Хімічні символами галогенів утворено рядок Б:
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІ групі побічній підгрупі міститься Хром. Його порядковий номер 24, тож і протонне число цього хімічного елемент – 24.
Відповідь: Б.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння характеризувати хімічний елемент за його місцем у періодичній системі.
Елемент № 25 – Манган – міститься в VII Б групі періодичної системи. Формула його вищого оксиду
Відповідь: 9.
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку вміння порівнювати властивості галогенів.
Окиснювальні властивості галогенів зменшуються в підгрупі зі збільшенням протонного числа. Найсильніше вони виражені у фтору
Відповідь: Г.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Хімічний елемент V A групи, розташований у ІV періоді, – Арсен.
Його порядковий номер у періодичній системі – 33. Тож і протонне число Арсену дорівнює 33.
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
Протонне число хімічного елемента збігається з його номером у періодичній системі.
Лужноземельні елементи належать до ІІ А групи, із-поміж наведених цю умову задовольняє добірка
| Протонні числа | Хімічні символи | |
| A | 3; 11; 55 | |
| Б | 5; 13; 49 | |
| B | 17; 35; 53 | |
| Г | 20; 38; 56 |
Відповідь: Г.
ТЕМА: Загальна хімія. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули характерних для хімічного елемента сполук за його місцем у періодичній системі.
У завданні наведено формули двох кислих солей. Це солі, утворені двохосновними кислотами того самого хімічного елемента. Їхні хімічні формули
Це свідчить, що елемент
Відповідь: Г.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння визначати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хімічні елементи класифікують на
Берилій, Кальцій, Магній – елементи 2 А групи періодичної системи хімічних елементів. В їхніх атомах на зовнішньому енергетичному рівні перебувають два
Відповідь: Г.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули леткої сполуки хімічного елемента з Гідрогеном, вищого оксиду і його гідрату за положенням елемента в періодичній системі.
Формула вищого оксиду хімічного елемента, який утворює летку сполуку з Гідрогеном складу
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати групу й підгрупу хімічного елемента в періодичній системі.
З-поміж поданих варіантів умову завдання задовольняє добірка з трьох елементів: Силіцій, Германій, Плюмбум належать до IV А підгрупи.
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів хімічних елементів однієї підгрупи періодичної системи.
A у цих елементів різні протонні числа, а тому й різна кількість електронів в атомах
Б це елементи однієї підгрупи (VIIА), тому в їхніх атомах однакова кількість (7) електронів на зовнішньому енергетичному рівні
B це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів
Г це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних підрівнів
Електронна формула атома Хлору
Електронна формула атома Брому
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
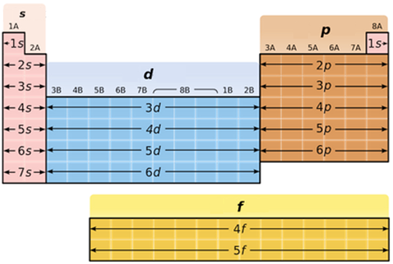
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
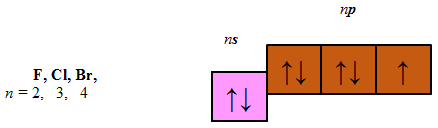
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Лужноземельні метали.
Завдання скеровано на перевірку вміння аналізувати з погляду окиснення-відновлення реакції за участі лужноземельних металів.
Лужноземельні металічні елементи належать до ІІ А групи. У їхніх атомах на зовнішньому енергетичному рівні два електрони. Щоби набути завершеного зовнішнього енергетичного рівня атоми лужноземельних елементів під час хімічних реакцій віддають електрони й, відповідно, окиснюються.
Відповідь: A.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Карбон – хімічний елемент IV А групи, Титан – IV А групи. Тобто Карбон і Титан – елементи однієї групи, але різних підгруп.
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
Лужноземельні елементи належать до ІІ А групи, із-поміж наведених цю умову задовольняє добірка
Відповідь: B.
ТЕМА: Неорганічні речовини. Періодична система хімічних елементів. Будова атома. Галогени.
Завдання скеровано на перевірку вміння характеризувати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хлор і Йод – елементи VІІ А групи періодичної системи хімічних елементів. Тому спільним у будові їхніх атомів є однакова кількість електронів на зовнішньому енергетичному рівні, яка збігається з номером групи:
Відповідь: B.
ТЕМА: Періодична система хімічних елементів. Металічні елементи.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
В атомах металічних елементів на зовнішньому енергетичному рівні перебуває від одного до чотирьох електронів. Кількість електронів в атомах елементів головних підгруп періодичної системи дорівнює номеру групи. Тому варіанти відповіді В й Г не задовольняють умову завдання.
У IV групі містяться неметалічні елементи Карбон і Силіцій.
Із-поміж груп хімічних елементів, про які йдеться в завданні, лише металічні елементи містяться в ІІ групі.
Відповідь: A.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Леткі сполуки з Гідрогеном складу
Його порядковий номер у періодичній системі – 15.
Відповідь: Г.
ТЕМА: Закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Радіус катіона менший за радіус атома того самого хімічного елемента. У періодах радіус атомів зменшується зі збільшенням протонного числа, а в групах – збільшується.
Відповідь: 1А, 2Б, 3В, 4Г.
ТЕМА: Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
Карбон і Титан – елементи IV групи різних її підгруп: Карбон міститься в IV a, а Титан – у IV b підгрупі (рис. 1).
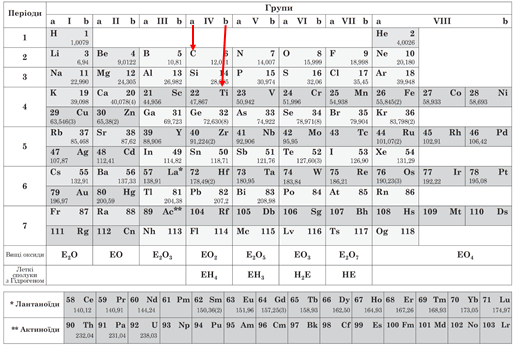
Рис. 1. Місцеположення Карбону й Титану в періодичній системі хімічних елементів
Відповідь: B.
ТЕМА: Загальна хімія. Будова атомів.
Завдання скеровано на перевірку вміння порівнювати будову зовнішніх енергетичних рівнів атомів.
На зовнішньому енергетичному рівні в атомах лужних елементів (І А група) один s-електрон, в атомах лужноземельних (ІІ А група) – два s-електрони, в атомах галогенів (VІІ А група) – два s-електрони і п’ять p-електронів, в атомах інертних елементів (VІІІ А група) – два s-електрони і шість p-електронів (за винятком атома Гелію, у якому на зовнішньому енергетичному рівні два s-електрони).
Кількість електронів на зовнішньому енергетичному рівні збільшується в ряду
Відповідь: 1В, 2Г, 3А, 4Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце хімічного елемента в періодичній системі, розрізняти групи, підгрупи, періоди.
Купрум і Калій – металічні елементи першої групи періодичної системи, але належать до різних підгруп. Купрум – хімічний елемент побічної (І Б), а Калій – головної (І А) підгрупи.
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули леткої сполуки хімічного елемента з Гідрогеном, вищого оксиду і його гідрату за положенням елемента в періодичній системі.
Хімічний елемент із протонним числом 16 – Сульфур, формула гідроген сульфіду
Відповідь: B.
ТЕМА: Загальна хімія. Хімічні формули. Сполуки Нітрогену.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Нітроген – хімічний елемент VА
Відповідь: 7.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени. Закономірності зміни властивостей хімічних елементів у групах періодичної системи.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у групах періодичної системи.
Неметалічні властивості й окисна здатність галогенів зростають у ряду
Відповідь: Б В А Г.
ТЕМА: Загальна хімія. Будова атома. Кількість електронів на зовнішньому енергетичному рівні в атомі.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні в атомі.
Кількість електронів на зовнішньому енергетичному рівні в атомі, визначають за номером групи (короткоперіодна форма періодичної системи), у якій розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів тієї самої групи. З-поміж наведених це елементи з протонними числами
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи.
Завдання скеровано на перевірку вміння використовувати періодичну систему для складання формул найважливіших сполук хімічних елементів.
Елемент № 20 Кальцій належить до ІІА групи, формула його вищого оксиду
Відповідь: Б.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Завдання скеровано на перевірку вміння визначати формулу речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Дано:
Знайти:
Відповідь: 15.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Інертні елементи.
Завдання скеровано на перевірку знання галузей застосування інертних газів.
Умову завдання задовольняє радон: радонові ванни, радіаційну терапію використовують у медицині.
Відповідь: A.
ТЕМА: Загальна хімія. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів за їхнім положенням у періодичній системі.
Фізичний зміст номера групи хімічного елемента в короткоперіодном варіанті періодичної системи – кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп.
Відповідь: B.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи й уміння аналізувати її.
До тої самої підгрупи VIA (у довгоперіодному варіанті періодичної системи це група 16) належать Оксиген, Сульфур, Телур.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
Формула вищого оксиду елемента ІV групи –
Тобто йдеться про Титан, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Карбону
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його гідроксиду становить
Тобто йдеться про Кальцій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Алюмінію
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
ТЕМА: Обчислення в хімії. Виведення хімічної формули.
Завдання скеровано на перевірку вміння визначати хімічну формулу вищого оксиду за місцем елемента в періодичній системі хімічних елементів.
Порядковий номер
Відповідь: 4.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІІ групі головній підгрупі міститься Бром. Його порядковий номер 35, тож і протонне число цього хімічного елемент – 35.
Відповідь: Г.




