Розділ: Будова атома і періодична система хімічних елементів
Тема: Йони: катіони й аніони
Кількість завдань: 35
ТЕМА: Електронна будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати електронну будову атомів і простих йонів.
В атомі Аргону 18 електронів, у катіоні
В атомі Неону 10 електронів, в аніоні
Ці хімічні елементи утворюють сіль, формула якої
Електронегативність Флуору найвища поміж хімічних елементів. Тому його атом не віддає електрони іншим атомам. Максимальний ступінь окиснення Флуору – 0.
Флуор утворює просту речовину фтор, формула якого
Кальцій – типовий металічний елемент.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
В нукліді
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку знання складу атома й розуміння причини його електронейтральності, уміння розрізняти атоми і прості йони.
Атом є електрично нейтральною частинкою, що складається з позитивно зарядженого ядра, яке практично визначає його масу (понад 99,9 %), й електронів, що оточують ядро й визначають розміри атома.
Простий аніон – мономерна хімічна частинка, що несе один або кілька негативних елементарних зарядів електрона.
Порядковий номер Брому в періодичній системі хімічних елементів – 35. У ядрі його атома 35 протонів, навколо ядра – стільки само електронів.
Приєднавши електрон, атом Брому перетворюється на простий однозарядний аніон. Тобто в Бромід-аніоні 36 електронів. За умовою завдання потрібно визначити хімічний елемент, в атомі якого на два електрони менше, тобто 34. Оскільки атом – електронейтральна частинка, то протонів у його ядрі також має бути 34. Цій умові відповідає хімічний елемент, порядковий номер якого в періодичній системі – 34, тобто Селен, хімічний символ якого
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку знання складу атома й розуміння причини його електронейтральності, уміння розрізняти атоми і прості йони.
Атом є електрично нейтральною частинкою, що складається з позитивно зарядженого ядра, яке практично визначає його масу (понад 99,9 %), й електронів, що оточують ядро й визначають розміри атома.
Протони й електрони – частинки, заряди яких однакові за абсолютною величиною і протилежні за знаком, нейтрони – електронейтральні.
Простий катіон – це позитивно заряджений йон, одноатомна частинка, що несе на собі один чи більше зарядів протона. Катіон – частинка, на яку перетворюється атом унаслідок утрати одного чи кількох електронів.
Тому для визначення простого катіона потрібно вибрати в таблиці рядок, у якому описано склад частинки з більшою кількістю протонів порівняно з електронами.
Цю умову задовольняє частинка, склад якої описано в рядку Г.
Відповідь: Г.
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати ступінь окиснення елементів у речовині.
Зазвичай як ступінь окиснення Натрію, так і Гідрогену в сполуках становить +1, а Оксигену – -2. Ураховуючи, що речовина електронейтральна, складаємо алгебраїчне рівняння і визначаємо ступінь окиснення елемента в сполуці
Відповідь: A.
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на розуміння понятть нуклідний символ, йон.
В атомі кількість електронів збігається з протонним числом
Для аніона:
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
| Нуклідний символ частинки | Протонне число, зарядове число, порядковий номер, |
Кількість електронів в атомі | Масове або нуклонне число, |
Нейтронне число, |
| 10 | 10 | 20 | 10 (20 - 10) | |
| 11 | 10 (11-1) | 23 | 12 (23 - 11) | |
| 9 | 10 (9 - 1) | 19 | 10 (19 - 9) |
Відповідь: Г.
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною і реагентом.
Пірохімічний аналіз (від грец. πυρо́ς – вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (див. рисунок).
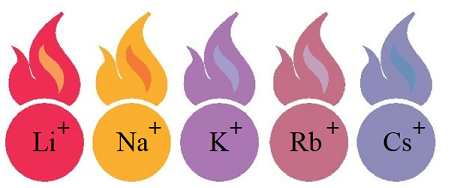
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Калію.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
Тобто за умовою завдання потрібно визначити частинку, у якій кількість електронів більша за кількість протонів. Цій умові відповідає варіант відповіді A – у цій частинці кількість електронів на два більша за кількість протонів.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома.
Завдання перевіряє розуміння поняття нуклід та йон.
Для виконання завдання необхідно розуміти, що означає умовний запис нуклідного символу. Якщо подивитися на запис нуклідного символу, то бачимо: 13 – протонне число (Z – кількість протонів в атомі), окрім цього, порядковий номер елемента показує число електронів в атомі. За умовою в завданні наведено катіон (позитивно заряджена частинка), який утворюється за умови, якщо атом віддає електрони. Заряд +3 означає, що атом віддав три електрони, тому
Відповідь: A.
ТЕМА: Лужні та лужноземельні елементи. Твердість води.
Завдання перевіряє знання визначення твердості води.
Твердість води зумовлена вмістом у воді катіонів Кальцію
Відповідь: Б.
ТЕМА: Хімічний зв'язок. Основні типи хімічного зв’язку.
Завдання на розуміння основних типів хімічного зв’язку.
Йонна сполука має йонний зв’язок, який зазвичай виникає між металічними й неметалічними елементами. Для виконання завдання необхідно вміти відрізняти за періодичною системою хімічних елементів Д.І. Менделєєва металічні та неметалічні елементи.
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини й складати рівняння електролітичної дисоціації.
Магній нітрат – сіль, дисоціює у водному розчині на катіони Магнію і нітрат-аніони:
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками калій гідрогенкарбонату є однозарядні катіони Калію та Гідрогену, двозарядні карбонат-аніон:
Згідно з принципом електронейтральності речовини сума зарядів складників дорівнює нулю.
Відповідь: Г.
ТЕМА: Загальна хімія. Протонне число. Електронна будова атомів і простих йонів.
Завдання скеровано на перевірку вміння аналізувати будову атомів і простих йонів.
| Хімічний символ | Порядковий номер у періодичній системі | Протонне число | Кількість електронів |
| 19 | 19 | ||
| 18 (19 – 1) | |||
| 20 | 20 (18 + 2) | ||
В атомі невідомого елемента
Відповідь: 20.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування можливості перебігу реакцій йонного обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
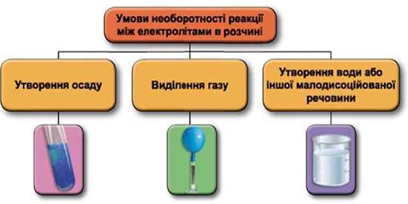
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Одночасно в розчині не можуть перебувати катіони Барію та ортофосфат-аніони, оскільки реагують з утворенням нерозчинного барій ортофосфату:
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
Атом електронейтральний, кількість електронів в атомі збігається з його протонним числом. Бром – типовий неметалічний елемент, в його атомі сім електронів на зовнішньому енергетичному рівні. Для завершення зовнішнього енергетичного рівня атому Брому не вистачає електрона, прийнявши який він перетворюється на однозарядний аніон
| Формула частинки | Порядковий номер у періодичній системі | Протонне число | Кількість електронів |
| 15 | |||
| 34 | |||
| 36 | |||
| 54 | |||
| 35 | 36 | ||
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронні формули
Завдання скеровано на перевірку вміння складати електронні формули атомів і простих йонів.
Катіон
Електронні формули атома й катіона Феруму такі:
Відповідь: Г.
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів. Якісна реакція на карбонат-аніони.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом.
Пірохімічний аналіз (від грец. πυρо́ς - вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (рис. 1).
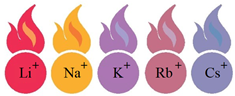
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Натрію.
Газ виділиться внаслідок дії хлоридної кислоти на натрій гідрогенкарбонат:
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи простих йонів.
| Символ хімічного елемента | Порядковий номер хімічного елемента в періодичній системі |
Кількість електронів | |
| в атомі | у йоні | ||
| 12 | 12 | 10 | |
| 11 | 11 | 10 | |
| 4 | 4 | 2 | |
| 3 | 3 | 2 | |
| 9 | 9 | 10 | |
| 17 | 17 | 18 | |
Відповідь: A.
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність і радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Хлору (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Флуору – на двох, тож радіус атома Хлору більший за радіус атома Флуору |
| II | порядковий номер Сульфуру в періодичній системі |
| III | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Оксигену більша за електронегативність Сульфуру |
| IV | в атомі Сульфуру |
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна (некарбонатна) твердість води зумовлена катіонами
Відповідь: A.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння визначати кількість електронів в атомі, йоні.
Порядковий номер Сульфуру в періодичній системі хімічних елементів
Відповідь: B.
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів більші за радіуси відповідних простих катіонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Рубідію більший за радіус атома Калію. Радіус атома Кальцію менший за радіус атома Калію, а радіус катіона Кальцію менший за радіус його атома.
Радіус частинок зменшується від атома Рубідію до катіона Кальцію в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
ТЕМА: Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати йонні сполуки.
Йонний зв’язок – зв’язок між йонами. Формули лише йонних сполук наведено в рядку Г. Кожна із цих сполук утворена катіонами металічних й аніонами неметалічних елементів. Утворення йонного зв’язку можливе за значної різниці в електронегативності хімічних елементів, коли електрони від атомів металічних елементів переходять до атомів неметалічних, унаслідок чого утворюються катіони й аніони.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді Б, В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей, у варіанті Г – атоми того самого неметалічного елемента. Натомість у натрій оксиді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Натрію й аніонами Оксигену.
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
Відповідь: А.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімічний зв’язок електростатичної природи між атомами чи групою атомів із дуже великою рiзницею в електронегативності. Валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У варіантах відповіді А, В, Г є формули речовин, утворених атомами неметалічних елементів із порівняно невеликою різницею електронегативності. Тому вони не задовольняють умову завдання. У варіанті відповіді Б наведено формули сполук металічних елементів із неметалічними. У цих елементів значна різниця електронегативності, що зумовлює утворення йонного зв’язку між катіонами лужних елементів – Натрію і Калію – й аніонами Хлору, Оксигену, Сульфуру (рис. 1).
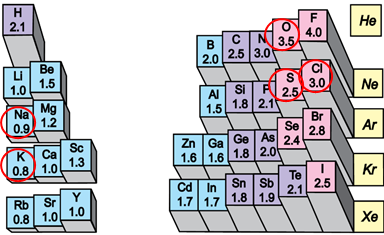
Рис. 1. Відносна електронегативність атомів хімічних елементів
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Відповідь: В.
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
Електронна формула атома Натрію
Катіон
Електронна формула атома Флуору
Аніон
| Частинка | Кількість | |||
| протонів |
нуклонів |
нейтронів |
електронів | |
| 11 | 23 | 12 | 10 | |
| 9 | 19 | 10 | 10 | |
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками польового шпату є однозарядні катіони Калію, тризарядні катіони Алюмінію, атоми Силіцію зі ступенем окиснення +4, атоми Оксигену зі ступенем окиснення –2:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: A.
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку розуміння змісту понять атом, катіон, аніон, протон, електрон, уміння аналізувати склад атомів і простих йонів.
Аніони – негативно заряджені частинки, на які перетворюються атоми внаслідок приєднання електронів. Однозарядний аніон Брому утворюється внаслідок приєднання електрона до атома Брому, кількість протонів в атомі не змінюється:
Катіони – позитивно заряджені частинки, на які перетворюються атоми внаслідок утрачання електронів. Тризарядний катіон Алюмінію утворюється внаслідок утрачання трьох електронів атомом Алюмінію, кількість протонів в атомі не змінюється:
| Частинка | Протонне число | Кількість електронів | |
| A | атом Алюмінію | 13 | 13 |
| Б | атом Брому | 35 | 35 |
| B | катіон Алюмінію | 13 | 10 |
| Г | аніон Брому | 35 | 36 |
Відповідь: Г.
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів менші за радіуси відповідних простих аніонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Оксигену більший за радіус атома Флуору (обидва – хімічні елементи другого періоду). Радіус атома Сульфуру більший за радіус атома Оксигену (обидва – хімічні елементи VІА групи), а радіус аніона Сульфуру більший за радіус атома цього хімічного елемента.
Радіус частинок збільшується від атома Флуору до аніона Сульфуру в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками фторапатиту є двозарядні катіони Кальцію, тризарядні фосфат-аніони, однозарядні флуорид-аніони:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: Г.




