Розділ: Речовина
Тема: Хімічний зв’язок. Кристалічні ґратки
Кількість завдань: 75
ТЕМА: Хімічні властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння за хімічною формулою визначати тип кристалічних ґраток речовини й прогнозувати її хімічні властивості.
| Варіант відповіді | 1 | 2 | 3 |
| А | |||
| Б | |||
| B | |||
| Г |
Натрій гідроксид
Відповідь: Г.
ТЕМА: Типи кристалічних ґраток. Електропровідність речовин. Температура плавлення як ознака будови.
Завдання скеровано на перевірку знання ознак йонних, атомних, металічних і молекулярних ґраток, уміння класифікувати речовини за типом кристалічних ґраток, зіставляти фізичні властивості (температура плавлення, електропровідність) із типом ґраток.
| Тип ґраток | Електропровідність | Температура плавлення |
| Йонні | у розчині й розплаві | Висока |
| Атомні | Дуже висока | |
| Металічні | у твердому стані | Середня – висока |
| Молекулярні | Низька |
Властивості речовини
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати склад частинок і прогнозувати типи хімічних зв’язків, в утворенні яких вони можуть брати участь.
Частинка 1 – протон, тобто може бути акцептором електронної пари, наприклад:
Частинка 2 – молекула водню, у якій два атоми Гідрогену усуспільнили електрони, утворивши ковалентний неполярний зв’язок. Тобто про водневий зв’язок не йдеться.
Відповідь: A.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку вміння за складом і властивостями речовини визначати тип кристалічних ґраток.
Кварц
Мідь
Кальцій карбонат
Мідь
Відповідь: B.
ТЕМА: Речовина. Кристалічні ґратки.
Завдання скеровано на перевірку вміння аналізувати фізичні властивості речовини й визначати за ним тип кристалічних ґраток у ній.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Фенол – речовина молекулярної будови. Унаслідок слабких зв’язків між молекулами фенолу він має порівняно невисоку температуру плавлення і характерний запах, бо молекули фенолу дифундують у повітря внаслідок руйнування міжмолекулярних зв’язків.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Кристалічні ґратки.
Завдання скеровано на перевірку вміння розпізнавати кристалічні ґратки різних типів.
У вузлах кристалічних ґраток на рисунку містяться дві однакові сполучені частинки. Цю умову задовольняє варіант відповіді Г – двохатомні молекули йоду.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, розрізняти електрони
З-поміж хімічних елементів, символи яких є в наведених формулах сполук, лише в атомі Флуору частина електронів міститься на
Умову завдання задовольняє молекула фтору.
Відповідь: Г.
ТЕМА: Хімічний зв’язок. Електронна формула молекули.
Завдання скеровано на перевірку розуміння суті ковалентного зв’язку й уміння аналізувати й тлумачити електронні формули.
В утворенні ковалентних зв’язків атома
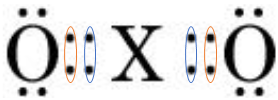
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
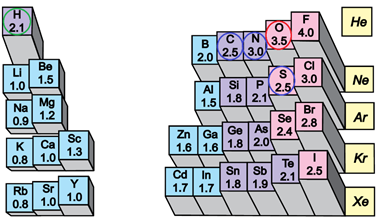
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: A.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння механізму утворення ковалентного зв’язку за донорно-акцепторним механізмом, уміння розпізнавати ковалентні зв’язки – полярні й неполярні.
І. Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона до молекули амоніаку. Тож один із чотирьох ковалентних зв’язків у катіоні амонію утворено за донорно-акцепторним механізмом. Молекула амоніаку є донором, а катіон Гідрогену – акцептором електронної пари (рис. 1).
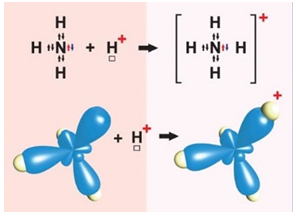
Рис. 1. Утворення катіона амонію
ІІ. Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари (рис. 2).

Рис. 2. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік більш електронегативного атома, називають полярним зв’язком. Саме такі зв’язки між атомами Гідрогену й Оксигену в молекулі води, спільні електронні пари зміщені до атома Оксигену.
Відповідь: A.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді А – В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей (рис. 1).
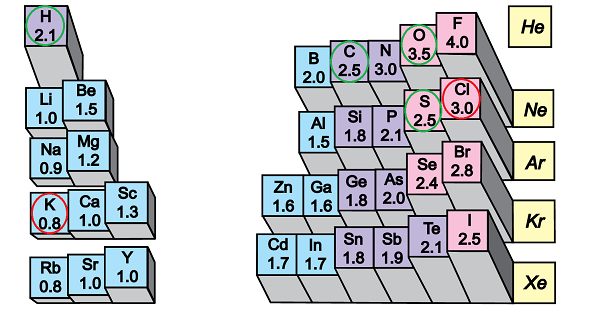
Натомість у калій хлориді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Калію і хлорид-аніонами.
Відповідь: Г.
ТЕМА: Загальна хімія. Валентність. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати валентність хімічних елементів за формулою речовини чи йона.
Валентність – здатність атомів вступати в хімічний зв’язок лише з певною кількістю інших атомів, що здійснюється в результаті взаємодії електронів верхніх електронних оболонок.
Кількісною мірою валентності атома є кількість атомів елемента, валентність якого вважають відомою, що їх здатний приєднати даний атом.
Зазвичай валентність атома визначають за максимальною кількістю одновалентних атомів (історично це атоми
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона
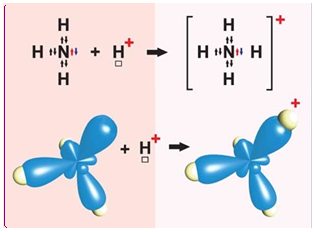
Рис. 1. Утворення катіона амонію
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати ступені окиснення хімічних елементів за формулою речовини чи йона.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Гідроген у сполуках із неметалічними елементами має ступінь окиснення
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона
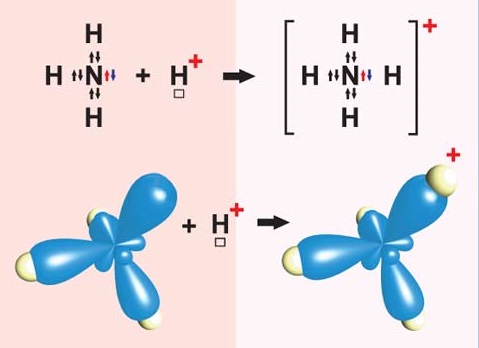
Рис. 1. Утворення катіона амонію
Відповідь: Г.
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку знання типів хімічного зв’язку й уміння визначати тип зв’язку за формулами.
Для виконання завдання необхідно знати, між якими елементами може утворитися йонний зв’язок і визначити за формулами цей зв'язок.
Йонний зв'язок – зв'язок між йонами. Йони – заряджені частинки, на які перетворюються атоми хімічних елементів, що значно відрізняються за електронегативністю (ЕН). ЕН – здатність атома елемента притягувати електрони від атомів інших елементів, у періодах і групах змінюється так само, як неметалічні властивості. Зазвичай найбільша різниця в ЕН між металами і неметалами, тому достатньо проаналізувати, у якому рядку зазначено сполуки металічних і неметалічних елементів.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).

Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку то більша, що більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: Г В А Б.
ТЕМА: Неорганічна хімія. Фосфор. Алотропні видозміни Фосфору.
Завдання скеровано на перевірку розуміння зумовленості властивостей речовин їхньою будовою.
Кристалічні ґратки - модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення й кипіння, адже молекули слабко зв’язані між собою.
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння природи хімічного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний зв’язок.
Завдання скеровано на перевірку розуміння природи ковалентного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Зі збільшенням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок між атомами неметалічних елементів, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Умову завдання задовольняє пара речовин, формули яких
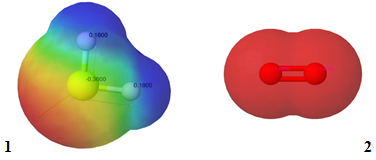
Рис. 1. Розподіл електронної густини в молекулах гідроген сульфіду (1) і кисню (2)
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний зв’язок.
Завдання скеровано на перевірку розуміння природи ковалентного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Зі збільшенням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок між атомами неметалічних елементів, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі водню хімічний зв’язок між атомами утворюється внаслідок перекривання двох s-електронних хмар кулястої форми.
Відповідь: Г.
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
У кристалічних ґратках літій гідроксиду містяться катіони Літію та гідроксид аніони.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний неполярний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів. Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул. Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
У молекулі азоту

Рис. 1. Електронна формула молекули азоту
Відповідь: Г.
ТЕМА: Карбон. Алотропія. Карбон(ІІ) оксид.
Завдання скеровано на перевірку знань про алотропні форми Карбону, хімічні властивості карбон(ІІ) оксиду, уміння розпізнавати екзо- й ендотермічні реакції.
В алмазу – алотропної модифікації Карбону – атомні, а не молекулярні кристалічні ґратки.
Ступінь окиснення атома Карбону в карбон(ІІ) оксиді дорівнює +2, а максимальний ступінь окиснення Карбону – елемента IVА групи – становить +4. Тому карбон(ІІ) оксид виявляє відновні властивості, зокрема й в екзотермічній реакції горіння:
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується (рис. 1).
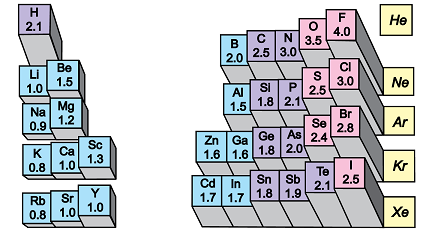
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: Г.
ТЕМА: Хімічний зв'язок. Основні типи хімічного зв’язку. Типи кристалічних ґраток
Завдання перевіряє вміння за фізичними властивостями визначати тип кристалічної ґратки.
За умовою завдання речовина летка, має запах і невисоку температуру плавлення. Такі властивості мають речовини з молекулярною кристалічною ґраткою.
Відповідь: А.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання перевіряє знання типів хімічного зв’язку, уміння за хімічною формулою визначати тип хімічного зв’язку.
Для виконання завдання необхідно знати, що ковалентний неполярний зв'язок зазвичай утворюється між однаковими атомами неметалічних елементів. Проаналізуємо формули сполук: лише одна із наведених формул містить однакові атоми неметалічних елементів, це
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічна хімія. Карбон і Силіцій.
Завдання перевіряє знання типів кристалічних ґраток.
Для виконання завдання необхідно знати, що алмаз – алотропна модифікація Карбону і має атомні кристалічні ґратки.
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
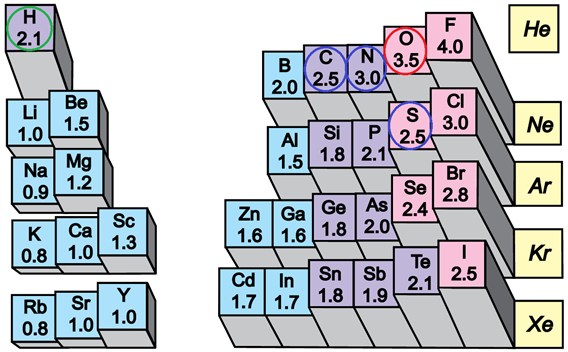
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементамипро сполуки яких ідеться, тому і зв’язок
Відповідь: A.
ТЕМА: Хімічний зв'язок. Основні типи хімічного зв’язку.
Завдання на розуміння основних типів хімічного зв’язку.
Йонна сполука має йонний зв’язок, який зазвичай виникає між металічними й неметалічними елементами. Для виконання завдання необхідно вміти відрізняти за періодичною системою хімічних елементів Д.І. Менделєєва металічні та неметалічні елементи.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку розуміння зумовленості властивостей речовини її будовою.
Металічний зв’язок за рахунок усуспільнених електронів – електронного газу – між атомами та катіонами Купруму в кристалі міді.
Йонний зв’язок між катіонами Кальцію і флуорид-аніонами в кристалі кальцій флуориду.
Ковалентний полярний зв’язок між атомами Гідрогену й Хлору в молекулі гідроген хлориду.
Ковалентний неполярний зв’язок між атомами Нітрогену в молекулі азоту.
Відповідь: 1Г, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку розуміння зумовленості властивостей речовини її будовою.
Усі метали є провідниками електричного струму.
Розплави електролітів проводять електричний струм.
Поміж речовин із ковалентним неполярним типом зв’язку є як діелектрики, так і напівпровідники.
У речовин із ковалентним полярним типом зв’язку порівняно невисокі температури плавлення.
Відповідь: 1Б, 2Г, 3В, 4А.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння особливостей утворення ковалентного зв’язку за донорно-акцепторним механізмом.
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом.
За донорно-акцепторним механізмом один атом надає електронну пару в спільне користування. Катіон амонію, наприклад, утворюється внаслідок приєднання протона
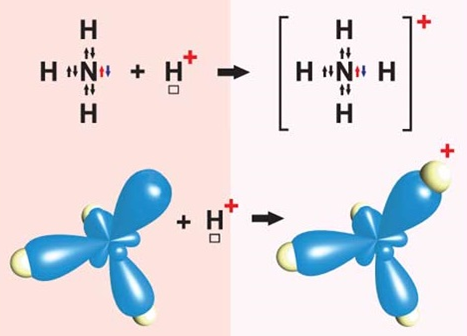
Рис. 1. Утворення катіона амонію
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Типи хімічного зв’язку. Йонний зв’язок.
Завдання скеровано на перевірку вміння розпізнавати формули сполук з йонним типом хімічного зв’язку.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони:
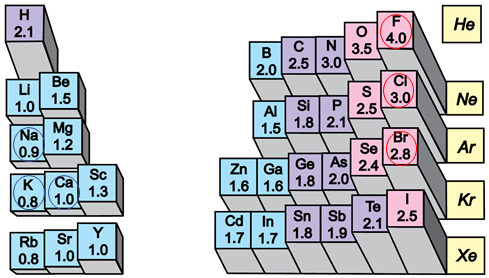
Рис. 1. Відносна електронегативність хімічних елементів
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Умову завдання задовольняє варіант відповіді натрій флуорид. Натрій – типовий металічний елемент, Флуор – типовий неметалічний. Електрон із зовнішнього енергетичного рівня атома Натрію переходить на зовнішній енергетичний рівень атома Флуору. Утворюються катіон Натрію і флуорид-аніон (рис. 1).

Рис. 1. Утворення йонного зв’язку в натрій флуориді
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття хімічний зв’язок, уміння розпізнавати речовини з ковалентним полярним типом хімічного зв’язку.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари (рис. 1).
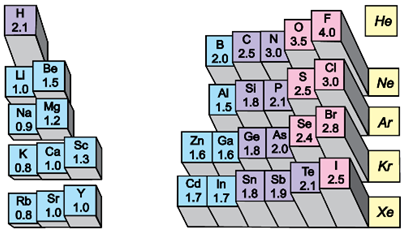
Рис. 1. Відносна електронегативність атомів хімічних елементів
Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік більш електронегативного атома, називають полярним зв’язком.
Формули речовин, утворених атомами різних неметалічних елементів, наведено в рядку Г. В інших трьох варіантах відповіді поміж формул є формули простих речовин
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток за фізичними властивостями речовини.
У йонних кристалах зв’язки між йонами міцні, тому такі речовини зазвичай мають високі температури плавлення. Електропровідність розплаву літій гідриду свідчить, що структурними частинками його кристалічних ґраток є йони, які внаслідок руйнування ґраток за високої температури переходять у розплав і є носіями електричного струму.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
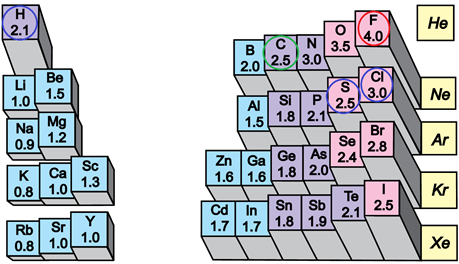
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння розпізнавати речовини з певним типом кристалічних ґраток за фізичними властивостями речовини.
Леткість, характерний запах і низька температура плавлення нафталену свідчать, що між частинками в його кристалічних ґратках сили притягання слабкі. Тобто частинками в їхніх вузлах можуть бути лише молекули, які слабко притягуються одна до одної.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
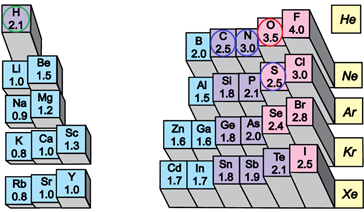
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, про які йдеться в завданні, тому і зв’язок
Відповідь: A.
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її властивостями.
Описані властивості – низька температура плавлення, леткість властиві речовинам з молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння, легко випаровується.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку у речовинах.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
У молекулі гідроген сульфіду
Тобто зв’язки між атомами Сульфуру й Гідрогену ковалентні полярні.
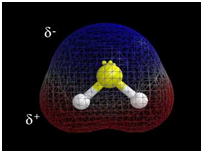
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Форми і перекривання електронних хмар. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип і спосіб утворення хімічного зв’язку.
У молекулі гідроген хлориду сполучені атом Гідрогену й атом Хлору. Хімічний зв’язок між ними утворюється за рахунок перекривання s-електронної хмари атома Гідрогену та p-електронної хмари атома Хлору (рис. 1).
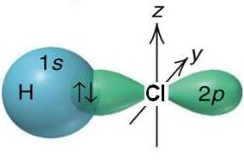
Рис. 1. Перекривання електронних хмар в молекулі гідроген хлориду
Відповідь: Г.
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати склад речовини й визначати тип хімічного зв’язку в ній.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Умову завдання задовольняє тетрахлорометан
Тобто зв’язки між атомами Карбону та Хлору ковалентні полярні (рис. 1).
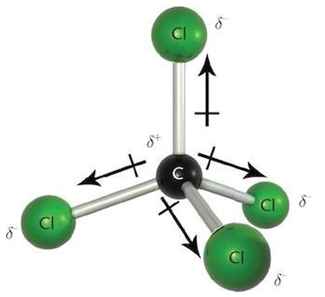
Рис. 1. Ковалентні полярні зв’язки в молекулі тетрахлорометану
Відповідь: Б.
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати речовини з ковалентним неполярним типом зв’язку.
Ковалентний зв’язок – зв’язок між атомами неметалічних елементів за рахунок спільних електронних пар. Ковалентний зв’язок неполярний, якщо електронегативність атомів хімічних елементів однакова, тобто в неметалах.
У молекулі кисню, хімічна формула якого
Відповідь: B.
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати речовини з ковалентним полярним типом зв’язку.
Ковалентний зв’язок – зв’язок між атомами неметалічних елементів за рахунок спільних електронних пар. Ковалентний зв’язок полярний, якщо електронегативність атомів хімічних елементів різна.
У молекулі гідроген сульфіду, хімічна формула якого
Відповідь: Б.
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип хімічного зв’язку в речовині за її властивостями.
Описані властивості – низькі температури кипіння і плавлення властиві речовинам iз молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, визначати тип хімічного зв’язку в речовині за її формулою.
Протонні числа атомів хімічних елементів збігаються з їхніми номерами в періодичній системі, тобто йдеться про бінарну сполуку Калію з Бромом – калій бромід, формула якого
Калій – типовий металічний, а Бром – типовий неметалічний елемент. Атом Калію легко втрачає електрон зовнішнього енергетичного рівня й перетворюється на однозарядний катіон. Атом Брому легко приймає електрон для завершення зовнішнього енергетичного рівня і перетворюється на однозарядний аніон. Хімічний зв'язок між катіоном й аніоном – йонний.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. Валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У кристалічних ґратках натрій оксиду сполучені катіони Натрію й аніони Оксигену – хімічних елементів із великою різницею електронегативностей (рис. 1).
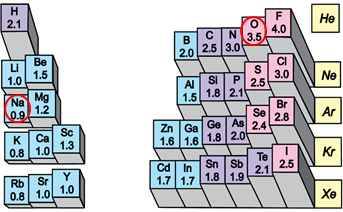
Рис. 1. Закономірності зміни електронегативності хімічних елементів у періодичній системі
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку вміння розпізнавати речовини з ковалентним неполярним типом хімічного зв’язку.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з восьми електронів. Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
У молекулі фтору спільна електронна пара однаковою мірою належить обом атомам Флуору, тому зв’язок між ними – ковалентний неполярний (рис. 1).

Рис. 1. Електронна будова молекули фтору
Відповідь: Г.
ТЕМА: Кристалічні ґратки. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип кристалічних ґраток у речовині.
Протонні числа хімічних елементів збігаються з їхніми протонними числами. У завданні йдеться про воду (протонне число Гідрогену 1, Оксигену – 8). Кристалічні ґратки у воді молекулярні – у їхніх вузлах містяться її молекули.
Відповідь: A.
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати речовини з ковалентним неполярним типом зв’язку.
Ковалентний зв’язок – зв’язок між атомами неметалічних елементів за рахунок спільних електронних пар. Ковалентний зв’язок неполярний, якщо електронегативність атомів хімічних елементів однакова, тобто в неметалах.
У молекулах галогенів, хімічні формули яких
Відповідь: A.
ТЕМА: Кристалічні ґратки. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип кристалічних ґраток у речовині.
Протонні числа хімічних елементів збігаються з їхніми протонними числами. У завданні йдеться про калій флуорид (протонне число Калію 19, Флуору – 9). Це типові металічний і неметалічний елементи з великою різницею електронегативності. Тому в цій речовині утворення хімічного зв’язку пов’язане з переходом електрона від атома Калію до атома Флуору. Між катіоном Калію і флуорид-аніоном, що утворилися, виникає йонний зв’язок. Тож кристалічні ґратки в цій речовині йонні.
Відповідь: A.
ТЕМА: Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати йонні сполуки.
Йонний зв’язок – зв’язок між йонами. Формули лише йонних сполук наведено в рядку Г. Кожна із цих сполук утворена катіонами металічних й аніонами неметалічних елементів. Утворення йонного зв’язку можливе за значної різниці в електронегативності хімічних елементів, коли електрони від атомів металічних елементів переходять до атомів неметалічних, унаслідок чого утворюються катіони й аніони.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння розпізнавати речовини з певним типом кристалічних ґраток за їхніми фізичними властивостями.
В атомних кристалах атоми зв’язані ковалентним неполярним зв’язком. Характерним прикладом таких речовин є алмаз, у кристалічних ґратках якого всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні (рис. 1).
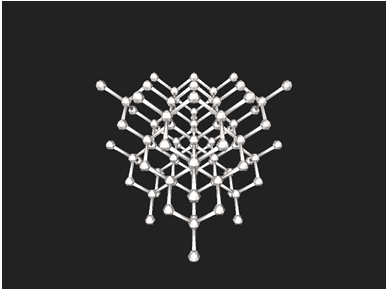
Рис. 1. Кристалічні ґратки алмазу
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді Б, В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей, у варіанті Г – атоми того самого неметалічного елемента. Натомість у натрій оксиді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Натрію й аніонами Оксигену.
Відповідь: A.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімічний зв’язок електростатичної природи між атомами чи групою атомів із дуже великою рiзницею в електронегативності. Валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У варіантах відповіді А, В, Г є формули речовин, утворених атомами неметалічних елементів із порівняно невеликою різницею електронегативності. Тому вони не задовольняють умову завдання. У варіанті відповіді Б наведено формули сполук металічних елементів із неметалічними. У цих елементів значна різниця електронегативності, що зумовлює утворення йонного зв’язку між катіонами лужних елементів – Натрію і Калію – й аніонами Хлору, Оксигену, Сульфуру (рис. 1).
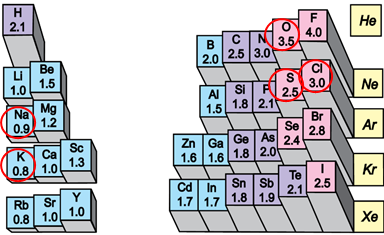
Рис. 1. Відносна електронегативність атомів хімічних елементів
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
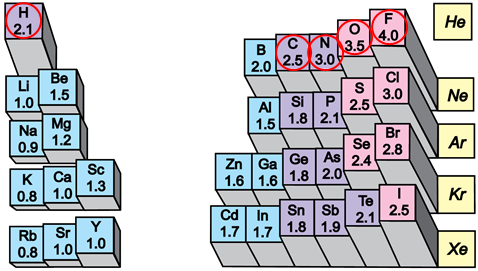
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Протонне число 9 в елемента Флуору, 11 – у Натрію, тобто в завданні йдеться про натрій флуорид.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони (рис. 2).
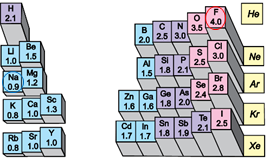
Рис. 1. Відносна електронегативність атомів хімічних елементів
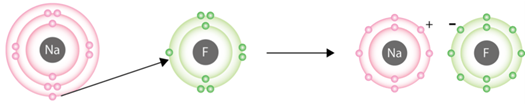
Рис. 2. Утворення йонів Натрію і Флуору
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Йонні кристали утворюють більшість солей неорганічних і органічних кислот, луги, основні й амфотерні оксиди й гідроксиди.
У кристалічних ґратках натрій флуориду містяться катіони Натрію і флуорид-аніони, тобто кристалічні ґратки в натрій флуориді йонні.
Відповідь: B.
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип хімічного зв’язку в речовині за її властивостями.
Літій гідроксид – луг, речовина йонної будови. У вузлах кристалічних ґраток літій гідроксиду містяться катіони Літію і гідроксид-аніони. Те, що водний розчин літій гідроксиду проводить електричний струм, зумовлено дисоціацією літій гідроксиду на йони, які за різниці потенціалів рухатимуться впорядковано.
Відповідь: B.
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її властивостями.
Описані властивості – низька температура плавлення, леткість властиві речовинам з молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння, легко випаровується.
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний неполярний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Умову завдання задовольняє водень, формула якого
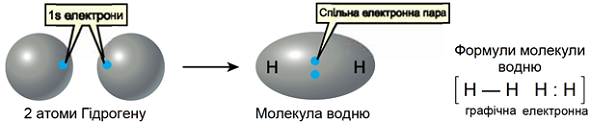
Рис. 1. Зображення ковалентного зв’язку в молекулі водню
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Умову завдання задовольняє варіант відповіді калій бромід. Калій – типовий металічний елемент, Бром – типовий неметалічний. Електрон із зовнішнього енергетичного рівня атома Калію переходить на зовнішній енергетичний рівень атома Брому. Утворюються катіон Калію й аніон Брому (рис. 1).

Рис. 1. Утворення йонного зв’язку в калій броміді
Відповідь: A.
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
У кристалічних ґратках сірки, йоду, карбон(IV) оксиду містяться молекули цих речовин.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Згідно з наведеною в завданні схемою на зовнішньому енергетичному рівні атома елемента
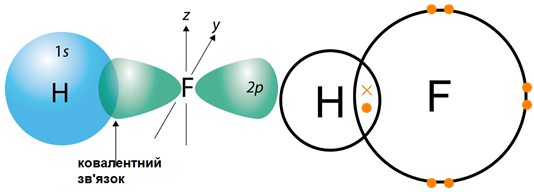
Рис. 1. Утворення ковалентного полярного зв’язку в молекулі гідроген флуориду
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген броміду хімічний зв’язок утворюється внаслідок усуспільнення пари електронів атомами Гідрогену й Брому. В утворенні хімічного зв’язку беруть участь неспарені електрони зовнішніх енергетичних рівнів:
У молекулі хімічний зв’язок між атомами утворюється внаслідок перекривання
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в речовинах.
Протонне число
Тобто йдеться про калій бромід – речовину з йонним типом хімічного зв’язку, який утворюється внаслідок переходу електрона зовнішнього енергетичного рівня атома Калію до атома Брому (рис. 1).

Рис. 1. Утворення йонного зв’язку в калій броміді
Відповідь: Б.
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її фізичними властивостями.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток і сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення й кипіння, адже молекули слабко зв’язані між собою. Молекулярні ґратки мають у твердому стані водень
Умову завдання задовольняють молекулярні кристалічні ґратки.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв`язку в сполуці за її формулою.
Умову завдання потрібно переформулювати: визначте тип хімічного зв’язку в сполуці, утвореній хімічними елементами з порядковими номерами
У кальцій броміді йонний зв’язок утворюється внаслідок переходу двох електронів зовнішнього енергетичного рівня атома Кальцію до атомів Брому (рис. 1).
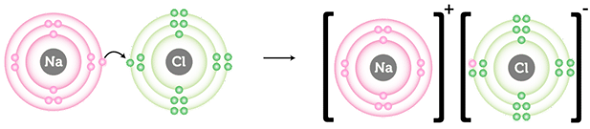
Рис. 1. Утворення йонного зв’язку в натрій хлориді
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген хлориду хімічний зв’язок утворюється внаслідок усуспільнення пари електронів атомами Гідрогену й Хлору. В утворенні хімічного зв’язку беруть участь неспарені електрони зовнішніх енергетичних рівнів:
У молекулі хімічний зв’язок між атомами утворюється внаслідок перекривання 1s-електронної хмари атома Гідрогену та 3p-електронної хмари атома Хлору (рис. 1).
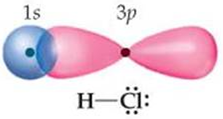
Рис. 1. Перекривання електронних хмар атомів у молекулі гідроген хлориду
Відповідь: Б.
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Карборунд – бінарна сполука неметалічних елементів, міцні зв’язки між атомами яких ковалентні. Кристалічні ґратки в карборунді атомні, тому це дуже міцний і твердий матеріал.
Відповідь: A.
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Зв’язок між йонами називають йонним.
У кальцій броміді йонний зв’язок утворюється внаслідок переходу двох електронів зовнішнього енергетичного рівня атома Кальцію до атомів Брому (рис. 1).
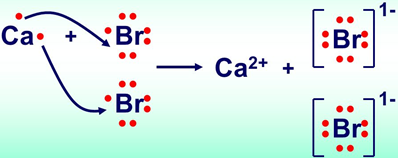
Рис. 1. Утворення йонного зв’язку в кальцій бромід
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген броміду хімічний зв’язок між атомами утворюється внаслідок перекривання кулястої 1s-електронної хмари атома Гідрогену й гантелеподібної 4p-електронної хмари атома Брому.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
У вузлах кристалічних ґраток натрій гідроксиду містяться йони – катіони Натрію і гідроксид-аніони. Тобто йдеться про йонні кристалічні ґратки.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний неполярний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів. Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул. Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Із-поміж речовин, формули яких наведено у завданні, умову задовольняє азот

Рис. 1. Електронна формула молекули азоту
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони.
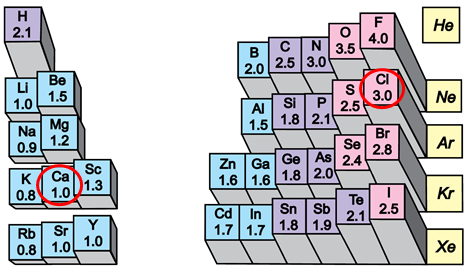
Рис. 1. Відносна електронегативність хімічних елементів
Умову завдання задовольняє кальцій хлорид. У вузлах кристалічних ґраток цієї солі містяться катіони Кальцію і хлорид-аніони.
Відповідь: B.




