Розділ: Основні класи неорганічних сполук
Тема: Кислоти
Кількість завдань: 97
ТЕМА: Реакції металів із кислотами й солей із лугами. Осадження гідроксидів.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів із кислотами, солей із лугами у водних розчинах.
1.
Залишок на фільтрі – магній гідроксид – гідроксид металічного елемента (А).
2.
Залишок на фільтрі – мідь – метал (Б).
3.
Залишок на фільтрі – мідь і магній гідроксид – метал і гідроксид металічного елемента (В).
Відповідь: 1А; 2Б; 3В.
ТЕМА: Реакції між солями, кислотами й основами.
Завдання скеровано на перевірку знання типових реакцій кислот із солями, уміння аналізувати послідовність хімічних перетворень.
Умові завдання відповідає лише варіант В:
Відповідь: B.
ТЕМА: Хімічні властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння за хімічною формулою визначати тип кристалічних ґраток речовини й прогнозувати її хімічні властивості.
| Варіант відповіді | 1 | 2 | 3 |
| А | |||
| Б | |||
| B | |||
| Г |
Натрій гідроксид
Відповідь: Г.
ТЕМА: Кислоти й основи. Значення
Завдання скеровано на перевірку вміння прогнозувати
| Варіант | Речовини | Продукт розчинення у воді речовини або продукту реакції речовини з водою | |
| А | |||
| Б | |||
| B | |||
| Г | |||
Відповідь: Г.
ТЕМА: Властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участю неорганічних сполук різних класів.
| Варіант відповіді | Схема реакції | Оцінка можливості перебігу реакції |
| А | Мідь не реагує з водою | |
| Б | Нерозчинні основи термічно нестійкі й із часом і/або внаслідок нагрівання розкладаються на оксид металічного елемента й воду | |
| B | Основні й амфотерні гідроксиди реагують із кислотами. Продукти реакції – сіль і вода | |
| Г | Активніший метал цинк витісняє мідь із розчиненої у воді солі Купруму |
Відповідь: A.
ТЕМА: Класифікація кислот за основністю. Двоосновні кислоти.
Завдання скеровано на перевірку знання формул і класифікації кислот за кількістю йонів Гідрогену, здатних до дисоціації, уміння розпізнавати двоосновні кислоти серед інших.
| Варіант відповіді | Назва кислоти | Формула кислоти | Кількість атомів Гідрогену, що утворюються внаслідок дисоціації молекули кислоти | Основність кислоти | Висновок |
| А | Карбонатна | Двоосновні | Правильно | ||
| Сульфатна | |||||
| Б | Ортофосфатна | Триосновна | Неправильно | ||
| Карбонатна | Двоосновна | ||||
| B | Сульфатна | Двоосновна | Неправильно | ||
| Етанова | Одноосновна | ||||
| Г | Сульфідна | Двоосновна | Неправильно | ||
| Нітратна | Одноосновна |
Відповідь: A.
ТЕМА: Кислоти. Основи. Реакція нейтралізації. Утворення солей.
Завдання скеровано на перевірку розуміння процесу нейтралізації між лугом (основою) і кислотою, уміння визначати продукт реакції – сіль – залежно від складу реактантів, називати солі за систематичною номенклатурою.
| Варіант відповіді | Назва й формула солі | Сіль | Висновок |
| А | Алюміній хлорид |
Є продуктом реакції між нерозчинним гідроксидом і хлоридною кислотою | Неправильно |
| Б | Літій сульфат |
Є продуктом реакції між лугом і сульфатною кислотою |
Правильно |
| B | Купрум(ІІ) нітрат |
Є продуктом реакції між нерозчинним гідроксидом і нітратною кислотою | Неправильно |
| Г | Цинк етаноат |
Є продуктом реакції між нерозчинним гідроксидом й етановою кислотою | Неправильно |
Усі кислоти, про які йдеться в завданні, розчинні у воді. Лугом (розчинною основою) є лише літій гідроксид.
Відповідь: Б.
ТЕМА: Кислоти. Луги. Реакція нейтралізації. Кількісні відношення речовин у хімічних реакціях.
Завдання скеровано на перевірку розуміння процесу нейтралізації між кислотою та основою, уміння зіставляти відношення об’ємів розчинів із відношеннями кількостей речовини в них, застосовувати поняття pH як показника рівноваги між йонами
| Варіант відповіді | Запис | Аналіз запису | Висновок |
| А | Це означало б, що кількість йонів |
Неправильно | |
| Б | Маси кислоти й лугу можуть бути рівні, але це не є достатньою умовою рівності кількості йонів |
Неправильно | |
| B | Це і є умова повної нейтралізації, унаслідок якої |
Правильно | |
| Г | Рівність мас йонів не означає рівності їхньої кількості, бо молярні маси цих йонів різні | Неправильно |
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Солі.
Завдання скеровано на перевірку вміння аналізувати формулу кислоти й визначати її основність, складати й аналізувати формули солей.
Основність кислоти визначають за кількістю атомів Гідрогену, здатних заміщуватися на атоми металічного елемента.
Сульфатна кислота
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів. Неметали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку знання властивостей розведених і концентрованих нітратної і сульфатної кислот, уміння користуватися рядом активності металів для прогнозування продуктів реакції з кислотами.
Сіль не утвориться внаслідок занурення мідної дротинки в розведену сульфатну кислоту. З концентрованими сульфатною і нітратною, розведеною нітратною кислотою мідь реагує з утворенням солі відповідної кислоти:
Відповідь: A.
ТЕМА: Неорганічна хімія. Оксиди і леткі сполуки з Гідрогеном неметалічних елементів. Індикатори.
Завдання скеровано на перевірку знання властивостей оксидів і летких сполук із Гідрогеном неметалічних елементів, уміння прогнозувати кольори індикаторів у водних розчинах лугів і кислот.
Водні розчини карбон(ІІ) оксиду й метану не містять катіонів Гідрогену чи гідроксид-аніонів, тому не діють ні на фенолфталеїн, ні на метиловий оранжевий.
Водний розчин амоніаку містить гідроксид-аніони, тому фенолфталеїн набуде під їхньою дією малинового забарвлення. Отже, цей варіант не задовольняє умову завдання:
Водний розчин гідроген хлориду містить катіони Гідрогену, під дією яких метиловий оранжевий змінює оранжеве забарвлення на рожеве:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Метали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів, основних оксидів металічних елементів, солей із кислотами.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Метали й неметали. Загальні відомості про металічні елементи та метали.
Завдання скеровано на перевірку знання відмінностей у взаємодії сульфатної кислоти різної концентрації з металами й уміння прогнозувати продукти реакцій залежно від активності металу й концентрації кислоти.
У завданні йдеться про дуже розведений водний розчин сульфатної кислоти й метал середньої активності – залізо. Продуктами цієї реакції є сіль – ферум(ІІ) сульфат і водень:
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Кислоти. Солі
Завдання скеровано на перевірку вміння аналізувати хімічні реакції, прогнозувати склад і властивості їхніх продуктів.
Унаслідок реакції між кристалічним натрій хлоридом і концентрованою сульфатною кислотою виділяється гідроген хлорид.
Водний розчин гідроген хлориду – сильна хлоридна кислота. Унаслідок дії хлоридної кислоти на натрій силікат утворюється осад силікатної кислоти (посудина 1).
Унаслідок реакції аргентум(І) нітрату з хлоридною кислотою утворюється осад аргентум(І) хлориду. (посудина 2).
Умову завдання задовольняє варіант відповіді В: в обох посудинах утворилися осади.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Кислоти. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння прогнозувати склад продуктів реакцій металів із кислотами.
У завданні йдеться про дуже розведений розчин сульфатної кислоти. У такому разі окисниками є катіони Гідрогену, а відновниками – атоми Магнію.
Натомість у концентрованих розчинах сульфатної кислоти окисниками є атоми Сульфуру кислотного залишку.
Тобто в цій реакції катіони Гідрогену відновлюватимуться до водню.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Загальна хімія. Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі хлоридної кислоти.
А натрій карбонат як сіль слабкої кислоти реагує з розбавленою хлоридною кислотою, а мідь як малоактивний метал, що розташований в ряду активності до водню, – ні
Б як цинк, розташований в ряду активності до водню, так і барій гідроксид – луг – реагує з хлоридною кислотою:
В кислотний силіцій(ІV) оксид не реагує з хлоридною кислотою, а магній як метал, розташований в ряду активності до водню, реагує з нею
Г аргентум(I) нітрат реагує з розбавленою хлоридною кислотою з утворенням нерозчинного аргентум(I) хлориду, а срібло як малоактивний метал, що розташований в ряду активності до водню, – ні
Відповідь: Б.
ТЕМА: Загальна хімія. Кислотні оксиди.
Завдання скеровано на перевірку вміння складати хімічну формулу кислоти за формулою її кислотного оксиду й навпаки.
Кислотні оксиди реагують із водою з утворенням кислот:
А
Б
В
Г
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння складати формули оксигеновмісних кислот.
Проаналізувавши наведені формули солей, можна дійти висновку, що йдеться про солі двохосновної оксигеновмісної кислоти, утвореної хімічним елементом, ступінь окиснення якого в ній дорівнює +6:
Цій умові відповідає сульфатна кислота
Відповідь: Б.
ТЕМА: Сульфатна кислота. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза й сульфатної кислоти, уміння прогнозувати хімічний склад продуктів реакцій сульфатної кислоти різної концентрації з металами.
У розведених водних розчинах сульфатної кислоти окисниками є катіони Гідрогену, а не атоми Сульфуру в кислотному залишку:
Відповідь: A.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку знання властивостей кислот, уміння складати їхні хімічні формули й класифікувати кислоти за основністю.
Хімічна формула ортофосфатної кислоти
Ортофосфатна кислота – речовина молекулярної будови, добре розчиняється у воді.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння розпізнавати речовини за хімічними властивостями.
Водень виділяється внаслідок реакції алюмінію із хлоридною кислотою:
Відповідь: B.
ТЕМА: Загальна хімія. Класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати формули неорганічних речовин різних класів.
| Оксигеновмісна органічна речовина | ||||
| Клас неорганічних сполук | Формула | |||
| 1 | сіль | складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Б | |
| 2 | оксид | бінарна сполука з Оксигеном, ступінь окиснення якого –2 | Д | |
| 3 | основа | складна речовина, утворена катіонами металічного елемента й гідроксид-аніонами | B | |
| 4 | кислота | складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами кислотного залишку | Г | |
Відповідь: 1Б, 2Д, 3В, 4Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати хімічні формули кислот.
Усі речовини, формули яких наведено, утворені атомами Гідрогену, здатними заміщуватися на атоми металічних елементів, і кислотними залишками.
Наведено формули нітратної, хлоридної та сульфатної кислот.
Відповідь: B.
ТЕМА: Загальна хімія. Неорганічні речовини та їхні властивості. Електролітична дисоціація. Якісні реакції на катіони й аніони.
Завдання скеровано на перевірку вміння доводити якісний склад неорганічних речовин за допомогою характерних реакцій на катіони й аніони в їхньому складі.
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони. Тому реагує з алюмінієм з утворенням відповідної солі та водню і з аргентум(І) нітратом з утворенням осаду аргентум(І) хлориду:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння класифікувати кислоти за основністю.
Основність кислоти визначають за кількістю атомів Гідрогену в її молекулі, які здатні заміщуватися атомами металічних елементів:
Відповідь: А Б Г В.
ТЕМА: Неорганічна хімія. Ферум(ІІ) оксид. Сульфатна кислота.
Завдання скеровано на перевірку знання властивостей ферум(ІІ) оксиду й сульфатної кислоти.
Ферум(ІІ) оксид реагує з розведеною сульфатною кислотою з утворенням ферум(ІІ) сульфату й води:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Алюміній. Нітратна кислота.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і нітратної кислоти.
Концентровану нітратну кислоту можна зберігати та транспортувати в цистернах, виготовлених з алюмінію, тому що цей метал під дією сильного окисника, яким є концентрована нітратна кислота, укривається щільним шаром алюміній оксиду.
Відповідь: A.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Фізичний зміст номера періоду та номера групи. Неорганічна хімія. Хлор. Гідроген хлорид.
Завдання скеровано на перевірку вміння визначати хімічний елемент за його місцем у періоді й групі та знання хімічних властивостей гідроген хлориду.
Елемент третього періоду, в атомі якого міститься сім електронів, – Хлор. Водний розчин його леткої сполуки з Гідрогеном – хлоридна кислота. Під дією хлоридної кислоти універсальний індикаторний папірець набуде червоного кольору.
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | B | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | двохосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | Д |
Відповідь: 1В, 2А, 3Б, 4Д.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
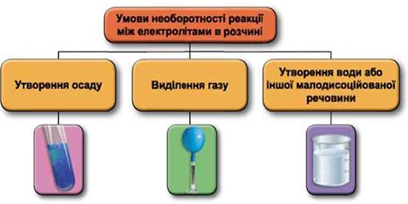
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знань про властивості сульфатної кислоти.
Двохосновна сульфатна кислота є сильним електролітом й утворює середні (сульфати) і кислі (гідрогенсульфати) солі.
Чиста сульфатна кислота – стійка речовина, тому твердження щодо її існування лише у водному розчині неправильне.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, способів добування амфотерних гідроксидів.
Алюміній в ряду активності металів розташований лівіше від водню і тому витісняє його з хлоридної кислоти:
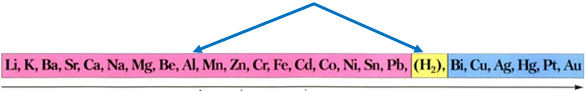
Ряд активності металів
Алюміній гідроксид – нерозчинна у воді сполука, тому його можна добути реакцією обміну між розчинною сіллю Алюмінію і лугом у водному розчині:
Тобто обидва твердження правильні.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Способи добування метану й етину.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості простих і складних речовин для прогнозування складу продуктів реакції між ними.
Проаналізувавши варіанти відповіді, можна дійти висновку, що в них ідеться про такі газуваті продукти реакцій між речовинами Х та Y:
A |
сульфур(IV) оксид |
Б |
водень |
B |
метан |
Г |
етин |
Рівняння реакції між магнієм і хлоридною кислотою:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання властивостей сполук неметалічних елементів, а саме гідроген хлориду.
Для виконання завдання необхідно знати, що гідроген хлорид у присутності води виявляє кислотні властивості та:
- дисоціює з утворення протонів Гідрогену
\(\mathrm{ (H^+)}\) , і універсальний індикаторний папірець змінить колір на червоний, що свідчить про утворення кислого середовища\(\mathrm{ (H^+)}\) . Тому І твердження правильне; - реагує з амоніаком, який у свою чергу виявляє оснόвні властивості. Унаслідок реакції утворюється білий дим – амоній гідроген хлорид
\(\mathrm{ NH_4Cl}\) . Тому ІI твердження також правильне.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ). Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а зі слабкими (катіони Гідрогену в хлоридній кислоті) – сполуки Феруму(ІІ). У реакціях із сильними відновниками (залізом) сполуки Феруму(ІІІ) відновлюються до сполук Феруму(ІІ). У реакціях обміну з ферум(ІІІ) оксиду утворюється ферум(ІІІ) хлорид.
1
2
3
4
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знання властивостей сульфатної кислоти, уміння аналізувати реагенти й прогнозувати продукти реакції, робити висновки.
У сульфатній кислоті Ступінь окиснення атома Сульфуру дорівнює +6, тобто максимально можливий для цього хімічного елемента. Тому з киснем сульфатна кислота не реагує.
Так само сульфатна кислота не реагує з кислотним карбон(IV) оксидом.
Вона реагує з осно́вним магній оксидом і з амоніаком:
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Солі. Добування солей.
Завдання перевіряє розуміння утворення середніх і кислих солей залежно від мольного співвідношення речовин у реакціях між лугами і багатоосновними кислотами.
Для виконання завдання необхідно зіставити певні кількості речовин кислот і лугів. Ортофосфатна кислота трьохосновна, тому для утворення середньої солі при взаємодії з натрій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:3. Такого співвідношення немає. Сульфатна кислота двохосновна, тому для утворення середньої солі при взаємодії з калій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:2. Таке співвідношення наведено у варіанті Г.
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Кислоти. Хімічні властивості кислот.
Завдання перевіряє знання хімічних властивостей кислот, зокрема сульфатної кислоти як сильної кислоти, уміння розрізняти основні класи неорганічних сполук.
Сульфатна кислота як сильна кислота реагує (із наведеного у завданні переліку речовин) з солями слабких кислот і основами і не реагує з кислотними оксидами. Тому з наведених варіантів правильним є лише А.
Відповідь: A.
ТЕМА: Основні поняття і закони хімії. Закон збереження маси речовин. хімічні рівняння.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовини для записування хімічних рівнянь.
Сума коефіцієнтів у хімічному рівнянні –
Відповідь: 12.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Сила кислот.
Завдання скеровано на перевірку розуміння закономірностей зміни сили кислот – водних розчинів гідроген галогенідів.
У підгрупі галогенів зі збільшенням протонного числа хімічних елементів збільшується ступінь дисоціації і, відповідно, сила кислот. Це зумовлено зменшенням електронегативності і збільшенням радіуса атомів галогенів, збільшенням довжини зв’язку
Відповідь: В А Г Б.
ТЕМА: Загальна хімія. Кислоти. Електролітична дисоціація кислот.
Завдання скеровано на перевірку розуміння електролітичної дисоціації кислот.
Універсальний індикаторний папір змінює забарвлення на червоне в кислому середовищі. Тобто в досліджуваному розчині є катіони Гідрогену.
Відповідь: A.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Сульфатна кислота. Властивості концентрованої сульфатної кислоти.
Завдання скеровано на перевірку вміння прогнозувати можливість реакції між металом і концентрованою сульфатною кислотою.
Концентрована сульфатна кислота реагує з багатьма металами, продукти реакцій наведено на схемі (рис. 1).
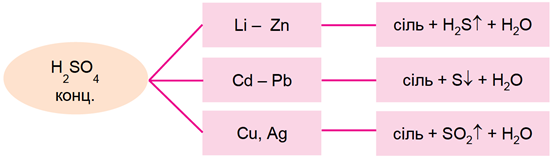
Рис. 1. Продукти реакцій металів із концентрованою сульфатною кислотою
Із-поміж металів, хімічні формули яких наведено у варіантах відповіді, лише золото стійке до дії концентрованої сульфатної кислоти.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Загальна хімія. Закон збереження маси речовин у хімічних реакціях. Хімічні рівняння.
Завдання скеровано на перевірку вміння складати хімічні рівняння.
У хімічному рівнянні
сума коефіцієнтів становить
Відповідь: 12.
ТЕМА: Неорганічна хімія. Назви неорганічних сполук.
Завдання скеровано на перевірку вміння називати неорганічні речовини за систематичною номенклатурою.
| Речовина | |||
| Формула | Назва | ||
| 1 | хлоридна кислота | Б | |
| 2 | ортофосфатна кислота | Г | |
| 3 | кальцій оксид | A | |
| 4 | фосфор(V) оксид | B | |
Відповідь: 1Б, 2Г, 3А, 4В.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати рівняння електролітичної дисоціації.
| Речовина | |||
| Назва | Рівняння електролітичної дисоціації | ||
| 1 | нітратна кислота | A | |
| 2 | алюміній сульфат | Г | |
| 3 | барій хлорид | Б | |
| 4 | калій гідроксид | B | |
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння розпізнавати формули кислот.
Молекули кислот утворені атомами Гідрогену, здатними заміщуватися атомами металів, і кислотним залишком. Умову завдання задовольняє нітратна кислота, формула якої
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку розуміння електролітичної дисоціації багатоосновних сильних кислот у розведених розчинах.
Оскільки розчин розведений, найбільше в ньому молекул води.
Сульфатна кислота як сильний електроліт дисоціює практично повністю, тому кількість сульфат-іонів – на другому місці.
На третьому місці – гідрогенсульфат-аніони – продукти неповної дисоціації сульфатної кислоти.
Сульфатна кислота – сильний електроліт, тому її молекул у розчині найменше.
Відповідь: Б Г А В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди, основи, кислоти, солі.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів, основ, кислот, солей.
| Клас неорганічних сполук | Визначення | Речовина | |||
| Формула | Назва | ||||
| 1 | кислоти | Складні речовини, утворені атомами Гідрогену, сполученими з кислотними залишками. Валентність кислотного залишку дорівнює кількості атомів Гідрогену в молекулі кислоти | сульфатна кислота | B | |
| 2 | оксиди | Складні речовини, утворені двома елементами, одним із яких є Оксиген у ступені окиснення –2 | сульфур(VI) оксид | Д | |
| 3 | основи | Складні речовини, утворені катіонами металічних елементів й аніонами гідроксильних груп. Кількість гідроксильних груп у формулі основи дорівнює ступеню окиснення металічного елемента в ній | кальцій гідроксид | A | |
| 4 | солі | Складні речовини, йонні сполуки. Середні солі утворені катіонами металічних елементів або/та амонію й аніонами кислотних залишків | кальцій сульфат | Б | |
Відповідь: 1В; 2Д; 3А; 4Б.
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Кислотні оксиди.
Завдання скеровано на перевірку вміння розпізнавати кислотні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
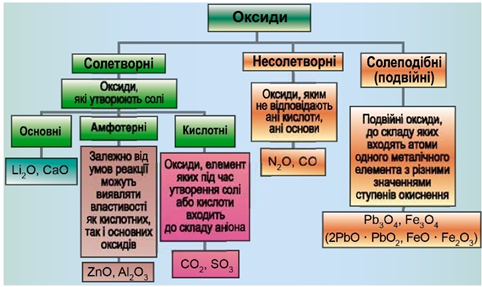
Рис. 1. Класифікація оксидів
Умову завдання задовольняє сульфур(IV) оксид, який реагує з водою з утворенням сульфітної кислоти:
Інший кислотний оксид – силіцій(IV) оксид
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей сульфатної кислоти й амоніаку.
У сульфатній кислоті ступінь окиснення атома Сульфуру +6 є найвищим можливим для елемента 6А групи, тому реакція з киснем не відбувається. Карбон(IV) оксид і силіцій(IV) оксид – вищі кислотні оксиди Карбону й Силіцію, тож не реагують із сульфатною кислотою.
Амоніак реагує із сульфатною кислотою:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості хлоридної кислоти.
A
Б
B
Г
Відповідь: Б.
ТЕМА: Генетичні зв’язки між неорганічними й органічними речовинами.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості неорганічних й органічних речовин для прогнозування продуктів хімічних реакцій.
| 1 | продуктом реакції кальцій карбіду з водою є етин | Д |
| 2 | продуктом реакції алюміній карбіду з водою є метан | Г |
| 3 | продуктом реакції алюмінію з хлоридною кислотою є водень | В |
| 4 | продуктом реакції кальцій карбонату с водою є карбон(ІV) оксид | А |
Відповідь: 1Д, 2Г, 3В, 4А.
ТЕМА: Неорганічна хімія. Ортофосфатна кислота.
Завдання скеровано на перевірку знання складу й властивостей ортофосфатної кислоти.
1 за кімнатної (20–25 °С) температури є білою кристалічною речовиною, за нагріванні до 42,35 °C перетворюється на безбарвну в’язку рідину
2 реагує з амоніаком з утворенням кислих солей
3 містить атом Фосфору у максимальному для нього ступені окиснення +5, тому не окиснюється
4 містить три атоми Гідрогену, здатні заміщуватися на атоми металічних елементів, тобто триосновна
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Гідроген хлорид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості гідроген хлориду для аналізування результатів експерименту й формулюванні висновків за ними.
Унаслідок хімічної взаємодії молекул амоніаку
Середовище водного розчину гідроген хлориду, у якому є катіони Гідрогену, кисле. Тому вологий універсальний індикаторний папірець під дією гідроген хлориду набуде червоного забарвлення, а не синього, як зазначено в першому твердженні.
Унаслідок хімічної взаємодії молекул гідроген хлориду
Тобто друге твердження правильне.
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Сульфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості сульфатної кислоти.
Сульфатна кислота реагує з металом цинком і сіллю слабкої леткої карбонатної кислоти – натрій карбонатом. Однак не реагує з вищим оксидом Карбону, який є кислотним (не реагує з кислотами) і не може бути відновником (бо атом Карбону у найвищому ступені окиснення не може віддавати електрони й окиснюватися). У сульфатній кислоті атом Сульфуру перебуває в найвищому ступені окиснення +6 і тому не може бути окиснений, і тому сульфатна кислота не реагує з киснем.
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини.
1
2
3
4
Відповідь: Б, А, Д, Б.
ТЕМА: Кислотні оксиди. Кислоти.
Завдання скеровано на перевірку розуміння поняття «кислотні дощі» й хімізму їхнього утворення.
Кислотні опади утворюються внаслідок гідратації кислотних оксидів, які містяться в повітрі:
Відповідь: Г.
ТЕМА: Метали. Залізо. Кислоти. Сульфатна кислота.
Завдання скеровано на перевірку знання хімічних властивостей заліза й сульфатної кислоти.
Нітратна й сульфатна кислоти виявляють хімічні властивості, загальні для всіх кислот, а також особливі. Вони – кислоти-окисники не лише за катіонами Гідрогену, а й за атомами Гідрогену й Сульфуру відповідно. Продукти реакцій нітратної та сульфатної кислот із металами залежать від положення металів у ряду активності, масової частки кислоти у розчині, температури тощо (рис. 1).
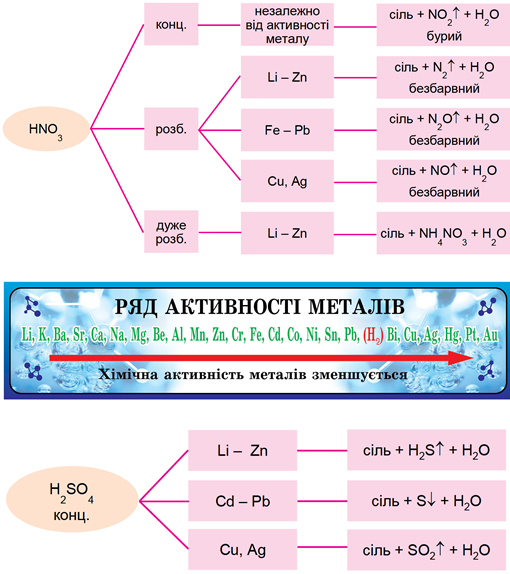
Рис. 1. Продукти реакцій нітратної і сульфатної кислот з металами залежно від положення металу в ряду активності
Умову завдання задовольняє розведена сульфатна кислота:
Відповідь: Б.
ТЕМА: Оксиди. Кислоти. Електролітична дисоціація.
Завдання скеровано на перевірку знання хімічних властивостей кислотних оксидів і продуктів електролітичної дисоціації кислот.
Сульфітна кислота дисоціює на катіони Гідрогену й сульфіт-аніони:
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони:
Продуктом розчинення сульфур(VI) оксиду у воді є сульфатна кислота, яка дисоціює на катіони Гідрогену й сульфат-аніони:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння класифікувати кислоти.
Хлоридна кислота – водний розчин гідроген хлориду
Відповідь: B.
ТЕМА: Електролітична дисоціація. Сильні та слабкі електроліти.
Завдання скеровано на перевірку вміння розпізнавати сильні та слабкі електроліти, складати й аналізувати рівняння електролітичної дисоціації.
Сульфатна й нітратна кислоти – сильні електроліти, у розведених розчинах практично повністю дисоціюють на йони:
Кількість речовини катіонів Гідрогену в розчині сульфатної кислоти вдвічі більша за її кількість речовини й становить
Етанова кислота – дуже слабкий електроліт, який незначною мірою дисоціює за рівнянням
Тобто катіонів Гідрогену в розведеному розчині етанової кислоти значно менше порівняно з іншими розчинами, про які йдеться в завданні.
Відповідь: Б.
ТЕМА: Кислотні оксиди. Кислоти. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між неорганічними сполуками, установлювати генетичні зв’язки між ними.
Сульфатну кислоти можна добути реакцією сульфур(VІ) оксиду з водою:
Відповідь: A.
ТЕМА: Неорганічні речовини. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію. Під дією концентрованих сульфатної та нітратної кислот на поверхні алюмінію утворюється стійка плівка алюміній оксиду.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакції солі з кислотою.
Сильні й нелеткі кислоти витісняють із солей слабкі, леткі, нестійкі кислоти (рис. 1).
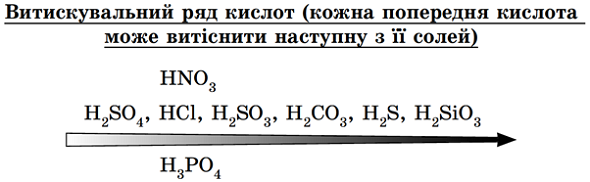
Рис. 1. Витискувальний ряд кислот
Із сильною хлоридною кислотою реагує сіль слабшої карбонатної кислоти – кальцій карбонат
Відповідь: Г.
ТЕМА: Періодична система хімічних елементів. Хімічні властивості заліза.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі заліза.
Продуктами реакції заліза з розведеною сульфатною кислотою є ферум(ІІ) сульфат і водень:
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакції солі з кислотою.
Сильні й нелеткі кислоти витісняють із солей слабкі, леткі, нестійкі кислоти (рис. 1).
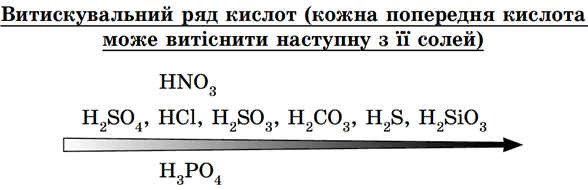
Рис. 1. Витискувальний ряд кислот
Із сильною хлоридною кислотою реагує сіль слабшої сульфітної кислоти – натрій сульфіт
Відповідь: B.
ТЕМА: Неорганічна хімія. Нітратна кислота. Окисні властивості нітратної кислоти.
Завдання скеровано на перевірку знання особливих властивостей нітратної кислоти.
Із-поміж кислот, формули яких наведено в завданні, сильні окисні властивості виявляє нітратна кислота, зокрема її кислотний залишок.
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів. Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Відносна густина газу
Його летка сполука з Гідрогеном – гідроген сульфід – виявляє у водному розчині кислотні властивості й реагує з лугом.
Відповідь: Г.
ТЕМА: Загальна хімія. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання властивостей солей карбонатної кислоти, взаємного перетворення карбонатів і гідрогенкарбонатів.
Натрій гідрогенкарбонат – кисла сіль, тому реагує з натрій гідроксидом:
Відповідь: Г.
ТЕМА: Загальна хімія. Електролітична дисоціація кислот. Сильні й слабкі електроліти.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації кислот.
Кислоти – електроліти, які під час дисоціації у водному розчині не утворюють інших катіонів окрім катіонів Гідрогену. Рівняння електролітичної дисоціації кислот, про які йдеться в завданні, такі:
Сульфатна й нітратна кислоти – сильні електроліти, тож у розведених водних розчинах дисоціюють повністю.
Кількість речовини катіонів Гідрогену вдвічі більша за кількість речовини сульфатної кислоти і становить, відповідно, 0,001 моль.
Кількість речовини катіонів Гідрогену така сама, як кількість речовини нітратної кислоти і становить, відповідно, 0,001 моль.
Етанова кислота – дуже слабкий електроліт, тому кількість речовини катіонів Гідрогену значно менша за кількість речовини етанової кислоти, тобто за 0,001 моль.
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й класифікувати неорганічні речовини за їхнім складом і властивостями (рис. 1, 2).
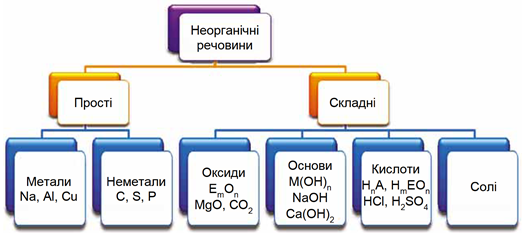
Рис. 1. Класифікація неорганічних речовин за складом. У наведених на схемі загальних формулах Е – елемент, М – металічний елемент, А – неметалічний елемент VI або VII групи періодичної системи хімічних елементів
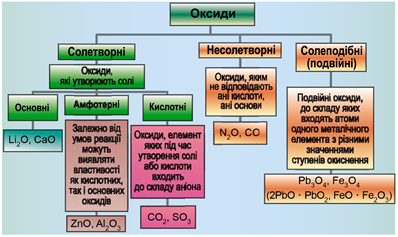
Рис. 2. Рис. 2. Класифікація оксидів
| 1 | несолетворний оксид | B | |
| 2 | кислота | Г | |
| 3 | кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти на атоми металічного елемента | Д | |
| 4 | кислотний оксид | Б |
Відповідь: 1B, 2Г, 3Д, 4Б.
ТЕМА: Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі хлоридної кислоти.
Хлоридна кислота є сильною леткою кислотою, тому реагує з амфотерним купрум(ІІ) оксидом (2), натрій силікатом (3) як сіллю слабкої кислоти, цинком (5) як металом, розташованим у ряду активності металів до водню (рис. 1).

Хлоридна кислота не реагує з міддю як металом, розташованим у ряду активності металів після водню, силіцій(IV) оксидом як кислотним і натрій сульфатом як сіллю сильної нелеткої кислоти.
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні й несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
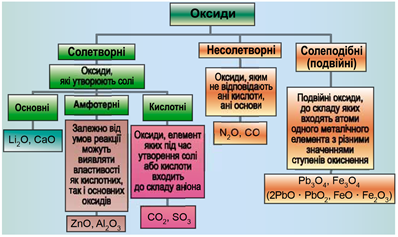
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють iз кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
A силіцій(IV) оксид – кислотний, тому реагує з натрій гідроксидом і не реагує з хлоридною кислотою
Б нітроген(І) оксид несолетворний, тому не реагує ні з натрій гідроксидом , ні з хлоридною кислотою
B магній оксид основний, тому реагує з хлоридною кислотою і не реагує з натрій гідроксидом
Г цинк оксид амфотерний, тому реагує як із натрій гідроксидом , так і з хлоридною кислотою
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні речовини різних класів.
Речовина (1) утворена катіонами Кальцію і карбонат-аніонами – кальцій карбонат, сіль (Г).
Речовина (2) містить атоми Гідрогену й кислотний залишок силікат – силікатна кислота (В).
Речовина (3) утворена катіонами Алюмінію і гідроксид-аніонами – амфотерний алюміній гідроксид (Д).
Речовина (4) – сульфур(IV) оксид, бінарна сполука Сульфуру й Оксигену, у молекулах якої ступінь окиснення атомів Оксигену становить –2 (А).
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Неорганічна хімія. Сульфатна кислота.
Завдання скеровано на перевірку знання особливих властивостей сульфатної кислоти і правил безпечного приготування її розчинів.
Густина сульфатної кислоти більша за густину води. Розчинення сульфатної кислоти – екзотермічний процес, унаслідок чого розчин сильно нагрівається.
Щоб уникнути розбризкування їдкої гарячої рідини, потрібно під час приготування розчину сульфатної кислоти концентровану кислоту тонким струменем уливати у воду за постійного перемішування.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
Речовина (1) утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, і кислотним залишком сульфітної кислоти – сульфітна кислота (Б).
Речовина (2) утворена катіонами Магнію й ортофосфат-аніонами – сіль магній ортофосфат (Д).
Речовина (3) утворена катіонами Кальцію й гідроксид-аніонами – розчинна основа кальцій гідроксид (Г).
Речовина (4) утворена катіонами Кальцію й аніонами Оксигену – основний кальцій оксид (В).
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку.
Амоніак виявляє осно́вні властивості через наявність в атома Нітрогену неподіленої електронної пари. Під час взаємодії з кислотами утворює амонієві солі:
Залежно від мольного відношення продуктом реакції може бути кисла сіль амоній гідрогенсульфат або середня – амоній сульфат:
Відповідь: Г.
ТЕМА: Неорганічні речовини. Хімічні властивості алюмінію.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі алюмінію.
Алюміній сульфат є продуктом реакції між алюмінієм і розведеною сульфатною кислотою:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад кислот.
Кислотами називають електроліти, які у водному розчині дисоціюють з утворенням катіонів Гідрогену й аніонів кислотного залишку.
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Сульфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості сульфатної кислоти для прогнозування можливості перебігу хімічних реакцій за її участю.
1. У сульфатній кислоті атом Сульфуру перебуває в найвищому ступені окиснення +6 і тому не може бути окиснений. Тож сульфатна кислота не реагує з киснем.
2. Амоніак реагує із сульфатною кислотою з утворенням кислої або середньої солі:
3. Магній оксид осно́вний, тому реагує із сульфатною кислотою:
4. Карбон(IV) оксид є кислотним (не реагує з кислотами) і не може бути відновником (бо атом Карбону у найвищому ступені окиснення не може віддавати електрони й окиснюватися).
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати представників різних класів неорганічних сполук.
| 1 | барій сульфіт |
A |
| 2 | боратна кислота |
Г |
| 3 | амоній гідрогенкарбонат |
Д |
| 4 | кальцій оксид |
Б |
Відповідь: 1А, 2Г, 3Д, 4Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Класифікація кислот.
Критерій класифікації кислот за основністю – кількість атомів Гідрогену, здатних заміститися на атоми металічного елемента. У молекулах одноосновних кислот один атом Гідрогену здатен заміститися атомом металічного елемента, у молекулах двоосновних кислот два атоми Гідрогену здатні заміститися атомами металічного елемента (рис. 1).
Двоосновними є сульфітна
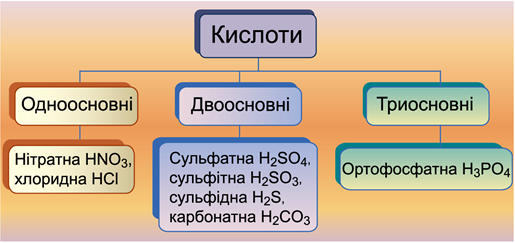
Рис. 1. Класифікація кислот за основністю
Відповідь: В.
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знання хімічних властивостей сульфатної кислоти.
1 чиста сульфатна кислота є важкою безбарвною оліїстою рідиною
2 сульфатна кислота реагує із цинк гідроксидом:
3 сульфатна кислота двохосновна, тому утворює середні (сульфати) і кислі (гідрогенсульфати) солі
4 сульфатна кислота є сильною кислотою
Відповідь: B.
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
ТЕМА: Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку знання властивостей хлоридної кислоти.
Хлоридна кислота реагує з калій гідроксидом (1), цинком (4), аргентум(І) нітратом (5):
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди. Способи добування кислот.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій кислотних оксидів з водою.
З-поміж кислот, формули яких наведено в завданні, лише силікатну не можна добути реакцією відповідного кислотного оксиду з водою, адже силіцій(IV) оксид – це кварц, який у воді не розчиняється і не реагує з нею.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів. Кислотні опади руйнують, зокрема, мармур, головний складник якого –кальцій карбонат.
Серед наведених варіантів відповіді умову завдання задовольняє сульфур(ІV) оксид:
Відповідь: B.
ТЕМА: Неорганічна хімія. Сульфатна кислота. Якісна реакція на сульфат-аніон.
Завдання скеровано на перевірку вміння визначати склад неорганічних речовин за допомогою якісних реакцій.
Формула сульфатної кислоти
Реакція із цинком доводить, що в молекулі сульфатної кислоти є атоми Гідрогени:
Реакція з із барій нітратом у розчині доводить, що в молекулі сульфатної кислоти є залишок сульфат:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції між неорганічними сполуками.
Хімічна реакція між калій гідроксидом і нітратною кислотою – це реакція між двома складними речовинами – лугом і кислотою – з утворенням двох складних речовин – солі й води:
Відповідь: A.
ТЕМА: Неорганічна хімія. Сульфур. Сполуки Сульфуру.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей сполук Сульфуру.
Умову завдання задовольняє гідроген сульфід
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Д | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | одноосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | B |
Відповідь: 1Д, 2А, 3Б, 4В.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів.
Серед наведених варіантів відповіді умову завдання задовольняють сульфур(ІV) оксид і нітроген(ІV) оксид:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди, кислоти, генетичні зв’язки між ними.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між кислотними оксидами й кислотами.
Нітратній кислоті
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Луги. Індикатори. Реакція нейтралізації.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації та знання кольорів індикаторів у різних середовищах – лужному, кислому, нейтральному.
У водному розчині калій гідроксиду є гідроксид-аніони, під дією яких фенолфталеїн набуває малинового кольору. Унаслідок поступового додавання хлоридної кислоти відбувається реакція нейтралізації, гідроксид-аніони реагують із катіонами Гідрогену:
Тому учень, який до розбавленого водного розчину калій гідроксиду, підфарбованого фенолфталеїном, поступово добавлятиме хлоридну кислоту, спостерігатиме знебарвлення розчину.
Відповідь: Г.
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза. Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється стійка оксидна плівка.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку знання властивостей неорганічних сполук, уміння порівнювати їхні властивості.
Класифікацію кислот схематично зображено на рисунку 1.
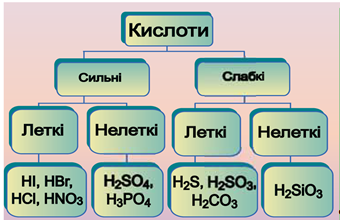
Рис. 1. Класифікація кислот
Продуктом розчинення сульфур(IV) оксиду у воді є слабка сульфітна кислота:
Унаслідок розчинення гідроген сульфіду у воді утворюється слабка сульфідна кислота
Унаслідок розчинення гідроген хлориду
Унаслідок розчинення амоніаку у воді утворюється лужний розчин:
Відповідь: B.




