Розділ: Метали й неметали
Тема: Загальні відомості про металічні елементи та метали
Кількість завдань: 104
ТЕМА: Реакції металів із кислотами й солей із лугами. Осадження гідроксидів.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів із кислотами, солей із лугами у водних розчинах.
1.
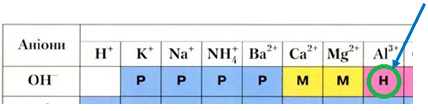
Залишок на фільтрі – магній гідроксид – гідроксид металічного елемента (А).
2.
Залишок на фільтрі – мідь – метал (Б).
3.
Залишок на фільтрі – мідь і магній гідроксид – метал і гідроксид металічного елемента (В).
Відповідь: 1А; 2Б; 3В.
ТЕМА: Властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участю неорганічних сполук різних класів.
| Варіант відповіді | Схема реакції | Оцінка можливості перебігу реакції |
| А | Мідь не реагує з водою | |
| Б | Нерозчинні основи термічно нестійкі й із часом і/або внаслідок нагрівання розкладаються на оксид металічного елемента й воду | |
| B | Основні й амфотерні гідроксиди реагують із кислотами. Продукти реакції – сіль і вода | |
| Г | Активніший метал цинк витісняє мідь із розчиненої у воді солі Купруму |
Відповідь: A.
ТЕМА: Взаємодія металів із кислотами. Виділення водню. Кількісний аналіз реакцій.
Завдання скеровано на перевірку розуміння хімізму реакції металу з кислотою з утворенням водню, уміння співвідносити масу металу з кількістю речовини й об’ємом водню, що виділиться, застосовувати поняття молярної маси й молярного об’єму для порівняння кількості водню, що утворюється.
Загальний вигляд рівняння реакцій зазначених металів із розведеною хлоридною кислотою такий:
Розв’язання завдання ґрунтується на розумінні закономірностей:
1) що більша молярна масу металу, то менша його кількість речовини за однакових мас металів;
2) що більша кількість речовини металу, то більші кількість речовини й, відповідно, об’єм водню, що виділяється, якщо ступені окиснення металічних елементів у солях, однакові.
Тобто що більша молярна маса металу, то менша його кількість речовини і, відповідно, менший об’єм водню, який виділяється (за однакової маси металів і заряду катіона в солі, що утворюється в реакції металу з кислотою).
Найменшу молярну масу з-поміж зазначених в умові металів має магній. Тож водень найбільшого об’єму виділиться в пробірці
Відповідь: Г.
ТЕМА: Загальна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння користуватися рядом активності металів для порівняння їхніх відновних властивостей.
Ряд активності (металів) — послідовність хімічних елементів у порядку зменшення легкості втрачання електронів у хімічних реакціях, тобто за зменшенням їхніх відновних властивостей.

Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Метали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів, основних оксидів металічних елементів, солей із кислотами.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Метали й неметали. Загальні відомості про металічні елементи та метали.
Завдання скеровано на перевірку знання відмінностей у взаємодії сульфатної кислоти різної концентрації з металами й уміння прогнозувати продукти реакцій залежно від активності металу й концентрації кислоти.
У завданні йдеться про дуже розведений водний розчин сульфатної кислоти й метал середньої активності – залізо. Продуктами цієї реакції є сіль – ферум(ІІ) сульфат і водень:
Відповідь: A.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що у водному розчині цинк як активніший метал витіснить залізо з ферум(ІІ) хлориду, залізо – свинець, кадмій – мідь, а нікель як менш активний метал не витіснить цинк.
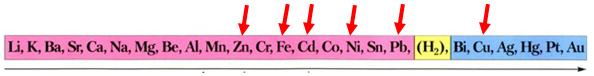
Активність металів зменшується
Рис. 1. Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Зрозуміло, що лише маса залізної пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) етаноату, бо атомна маса Плюмбуму більша за атомну масу Феруму.
Відповідь: Б.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Як натрій, так і кальцій є активними металами, реагують iз водою з утворенням відповідного гідроксиду й виділенням газуватого водню. Обидві реакції є екзотермічними, унаслідок їхнього перебігу змінюються ступені окиснення хімічних елементів:
Однак кальцій гідроксид на відміну від натрій гідроксиду є малорозчинним (рис. 1).
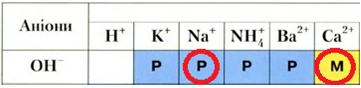
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю, уміння кількісно оцінювати результати перебігу таких реакцій.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що кадмій і залізо витіснятимуть із солей свинець і мідь, оскільки в ряду активності вони розташовані лівіше від них:
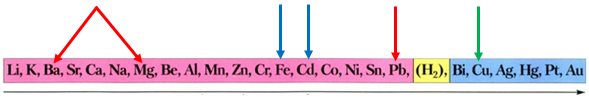
Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса залізної пластинки збільшиться, а кадмієвої – зменшиться, якщо її занурити у водний розчин купрум(ІІ) нітрату. Унаслідок занурення в розчин плюмбум(ІІ) нітрату маса обох пластинок збільшиться.
Відповідь: Б.
ТЕМА: Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин.
Розбавлена хлоридна кислота не реагує з міддю, а концентрована нітратна – реагує.
Натрій сульфат на відміну від натрій нітрату реагує з барій хлоридом.
Унаслідок реакції з лугом алюміній хлориду і магній хлориду у водному розчині утворюються осади відповідних гідроксидів. Однак осад алюміній гідроксиду, на відміну від осаду магній гідроксиду, розчиняється в надлишку лугу.
Відповідь: 1А, 2Б, 3Д.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Алюміній і залізо.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу хімічних реакцій між неорганічними речовинами.
Продуктом реакції заліза з хлором є ферум(ІІІ) хлорид:
Продуктом взаємодії заліза із хлоридною кислотою є ферум(ІІ) хлорид і водень:
Залізо відновлює сполуку ферум(ІІІ) хлорид до ферум(ІІ) хлориду:
Унаслідок реакції між ферум(ІІІ) оксидом і хлоридною кислотою утворюються ферум(ІІІ) хлорид і вода:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу хімічних реакцій між неорганічними речовинами.
Продуктом реакції заліза з речовиною X є ферум(ІІІ) хлорид. Це дає підстави стверджувати, що речовина X – хлор, бо продуктом реакції заліза із хлоридною кислотою є ферум(ІІ) хлорид:
Речовина Y – залізо, бо карбон(IV) оксид із ферум(ІІІ) хлоридом не реагує. Натомість залізо відновлює сполуку феруму(ІІІ) до феруму(ІІ):
Відповідь: Г.
ТЕМА: Загальні відомості про металічні елементи й метали. Солі.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Метал реагує із сіллю, якщо він активніший за той метал, який входить до складу солі. Для порівняння активності металів користуємося рядом активності металів (таблиця 4 тестового зошита). За умовою завдання одна з пластинок виготовлена з кадмію, а інша – з міді. Пластинки занурили у водний розчин плюмбум(ІІ) етаноату. Порівняємо активність металів. Кадмій активніший за свинець, тому реагуватиме із сіллю, мідь – менш активний метал порівняно зі свинцем, тому із сіллю не реагує. Унаслідок взаємодії металу з розчином солі маса металу (пластинки) змінюється, тому що відносні атомні маси різних металів різні. В умові зазначено, що змінилася маса лише пластинки, виготовленої з металу Х, тому Х – кадмій, тоді Y – мідь. Отже, твердження ІІ правильне. Проаналізуємо, як зміниться маса пластинки, виготовленої з кадмію. Напишемо рівняння реакції кадмію з плюмбум(ІІ) етаноатом:
Порівняємо відносні атомні маси кадмію і свинцю:
Відповідь: Б.
ТЕМА: Обчислення в хімії. Хімічні властивості заліза. Закон збереження маси під час хімічних реакцій.
Завдання скеровано на перевірку знання хімічних властивостей заліза й уміння застосовувати закон збереження маси речовин для перетворення схеми хімічної реакції на хімічне рівняння.
Залізо реагує з перегрітою водяною парою:
Сума коефіцієнтів у рівнянні реакції становить
Відповідь: 12.
ТЕМА: Загальна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між міддю і сполуками Купруму різних класів.
Послідовність реагентів та умов, за яких відбувається перебіг хімічних реакцій в генетичному ланцюжку перетворень, така:
Відповідь: Г Б А В
ТЕМА: Загальна хімія. Ферум. Залізо. Виробництво чавуну.
Завдання скеровано на перевірку знання хімізму виробництва чавуну.
Послідовність хімічних процесів, що відбуваються під час доменного виробництва чавуну, така:
1) екзотермічна реакція згоряння коксу
2) відновлення карбон(IV) оксиду вуглецем
3) відновлення оксидів Феруму
4) губчасте залізо частково реагує з розжареним вуглецем з утворенням цементиту
Відповідь: А В Б Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками.
Умову завдання задовольняє кальцій:
Відповідь: Г.
ТЕМА: Застосування органічних й неорганічних речовин.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Речовина | |||
| Назва | Галузь застосування | ||
| 1 | амофос | добриво | Б |
| 2 | алюміній, сплави алюмінію | пакувальний матеріал (фольга, бокси) | Г |
| 3 | натрій стеарат | мило | Д |
| 4 | фенол | дезінфікувальний засіб | A |
Відповідь: 1Б, 2Г, 3Д, 4A.
ТЕМА: Неорганічна хімія. Металічні й неметалічні елементи. Металургія.
Завдання скеровано на перевірку знання способів боротьби із забрудненням довкілля під час виробництва металів і сплавів.
У металургії важливими способами боротьби із забрудненням довкілля є комплексне використання сировини (1) і заміна коксу воднем (2).
Відповідь: B.
ТЕМА: Загальна хімія. Ферум. Залізо. Виробництво чавуну.
Завдання скеровано на перевірку знання хімізму виробництва чавуну.
Складниками шихти доменного виробництва чавуну (рис. 1) є залізна руда (1), флюси (2), кокс (3).
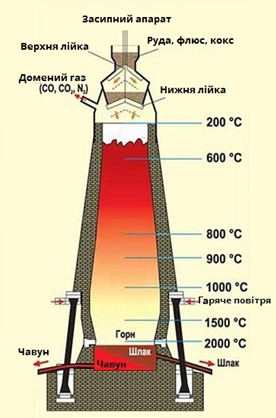
Рис. 1. Доменне виробництво чавуну
Відповідь: B.
ТЕМА: Неорганічна хімія. Алюміній. Нітратна кислота.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і нітратної кислоти.
Концентровану нітратну кислоту можна зберігати та транспортувати в цистернах, виготовлених з алюмінію, тому що цей метал під дією сильного окисника, яким є концентрована нітратна кислота, укривається щільним шаром алюміній оксиду.
Відповідь: A.
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Відповідь: Г Б А В.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння порівнювати активність металів за їхнім положенням у ряду активності.
Здатність середніх солей взаємодіяти в розчині з металами можна спрогнозувати за довідковою таблицею «Ряд активності металів» (рис. 1).

Рис. 1. Ряд активності металів
Що лівіше розташований метал у цьому ряду, то він активніший. Тобто витіснятиме з розчинів солей метали, розміщені правіше від нього.
Із-поміж металів, про які йдеться в умові завдання, найактивнішим є магній.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза, способів добування і властивостей сполук Феруму(ІІІ).
1
2
3
4
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, способів добування амфотерних гідроксидів.
Алюміній в ряду активності металів розташований лівіше від водню і тому витісняє його з хлоридної кислоти:
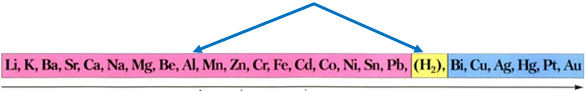
Ряд активності металів
Алюміній гідроксид – нерозчинна у воді сполука, тому його можна добути реакцією обміну між розчинною сіллю Алюмінію і лугом у водному розчині:
Тобто обидва твердження правильні.
Відповідь: B.
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною і реагентом.
Пірохімічний аналіз (від грец. πυρо́ς – вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (див. рисунок).
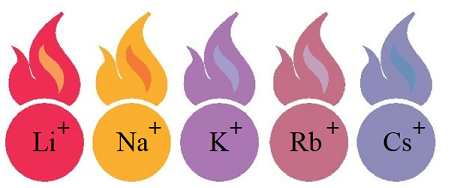
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Калію.
Відповідь: A.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.

Ряд активності металів
Порівнявши положення металів у ряду активності, можна дійти висновку, що мідь витіснятиме із солей ртуть (Б), оскільки в ряду активності мідь розташована лівіше:
Активніші метали (барій, магній, нікель), які в ряду активності розташовані лівіше за мідь, вона з розчинів солей витіснити не зможе.
Атомна маса ртуті більша за атомну масу міді, тому маса пластинки збільшилася.

Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання властивостей і добування металічних елементів, а саме Феруму.
Для розв’язання завдання необхідно знати способи добування і хімічні властивості заліза. Перша реакція – добування заліза із оксиду. Добути метал з оксиду можна реакцією відновлення. Із запропонованих відновником може бути лише карбон(ІІ) оксид (
Отже, правильна відповідь – Б.
Відповідь: Б.
Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання хімічних властивостей металів, а саме алюмінію, і добування металів алюмотермією.
Для виконання завдання достатньо знати, що алюмотермія – це відновлення металу з оксиду алюмінієм. Із чотирьох запропонованих варіантів лише в одному (Б) алюміній відновлює метал з оксиду.
Відповідь: Б.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Загальні відомості про металічні елементи та метали. Основи.
Завдання перевіряє здатність з опису хімічного досліду зрозуміти тип хімічної реакції, фізичних і хімічних властивостей лужноземельних елементів.
Лужноземельні елементи активно реагують з водою, тому реакція є екзотермічною. Унаслідок взаємодії лужноземельних елементів з водою утворюється основа (кальцій гідроксид – малорозчинна у воді основа) і водень. Тому з наведених тверджень правильними є лише І і ІV.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи та їхні сполуки. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання хімічних властивостей металів, а саме їхню взаємодію із солями.
Для виконання завдання необхідно знати хімічні властивості металів. Метал може реагувати із сіллю, якщо він активніший за той метал, який входить до складу солі. Тобто в завданні за допомогою ряду активності металів, який є в тестовому зошиті (с. 16), необхідно порівняти метал Y і метал, який входить до складу солі X. Метал Y буде відновлювати метал із солі X, якщо метал Y активніший за метал, який входить до складу солі X.
Порівнюємо:
Відповідь: Г.
ТЕМА: Металічні елементи та хні сполуки. Метали. Лужні та лужноземельні елементи.
Завдання перевіряє визначення лужних елементів та їхнє положення в періодичній системі.
Для виконання завдання необхідно знати, які елементи називають лужними і де вони знаходяться в періодичній системі. Лужні елементи – це елементи Іа групи (перша група головна підгрупа). Із запропонованих правильною відповіддю є лише Г.
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічні речовини. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку вміння застосовувати знання про неорганічні речовини для прогнозування продуктів їхньої взаємодії.
1
2
3
4
Відповідь: 1Б, 2А, 3В, 4Д.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ). Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а зі слабкими (катіони Гідрогену в хлоридній кислоті) – сполуки Феруму(ІІ). У реакціях із сильними відновниками (залізом) сполуки Феруму(ІІІ) відновлюються до сполук Феруму(ІІ). У реакціях обміну з ферум(ІІІ) оксиду утворюється ферум(ІІІ) хлорид.
1
2
3
4
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання властивостей будови атома Алюмінію, властивостей алюмінію і сполук Алюмінію, способів їхнього добування.
A |
У хімічних реакціях атоми Алюмінію віддають електрони й окиснюються |
Б |
У йона Алюмінію така сама (10 електронів) електронна конфігурація, як в атома Неону |
B |
алюміній гідроксид не добувають реакцією алюміній оксиду з водою. Його добувають реакцією обміну між сіллю алюмінію і лугом у водному розчині |
Г |
оксид і гідроксид Алюмінію амфотерні, тому можуть реагувати як із кислотами, так і з лугами, зокрема з натрій гідроксидом |
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку розуміння закономірностей розташування металів у ряду активності для прогнозування можливості перебігу реакції металу із сіллю в її водному розчині.

Ряд активності металів
Що лівіше розташований метал в ряду активності, то більша його активність і відновні властивості. Згідно експериментальних даних метал
Відповідно найсильніші окисні властивості з-поміж наведених катіонів виявляють катіони
Як менш активний метал
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі. Хімічні властивості та добування солей.
Завдання перевіряє знання хімічних властивостей і способів добування солей.
Для виконання завдання необхідно скористатися рядом активності металів. За рядом активності металів визначаємо, що
Відповідь: A.
ТЕМА: Алюміній
Завдання перевіряє знання фізичних і хімічних властивостей алюмінію.
Відповідь: Г.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основи. Лужні та лужноземельні метали.
Завдання перевіряє розуміння з опису досліду типів хімічних реакцій, дії лугів на індикатор, фізичних і хімічних властивостей лужних металів.
Речення «Він плавиться, перетворюючись на кульку, яка швидко рухається поверхнею води» говорить про те, що реакція є екзотермічною. Натрій – лужний метал, а лужні метали з водою утворюють луг і при цьому виділяється водень. Про утворення лугу свідчить те, що розчин поступово набуває малинового кольору. Отже, із наведених тверджень правильними є І і ІV.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Способи добування металів.
Завдання скеровано на перевірку розуміння хімізму пірометалургійних процесів.
Пірометалургія об’єднує хімічні способи відновлення металів із руд за високої температури.
Як відновники в пірометалургії використовують вугілля (кокс), карбон(ІІ) оксид, водень, активні метали, силіцій.
Наприклад, для добування металів пірометалургійним способом із сульфідних руд їх спочатку випалюють:
Відповідь: A.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Сульфатна кислота. Властивості концентрованої сульфатної кислоти.
Завдання скеровано на перевірку вміння прогнозувати можливість реакції між металом і концентрованою сульфатною кислотою.
Концентрована сульфатна кислота реагує з багатьма металами, продукти реакцій наведено на схемі (рис. 1).
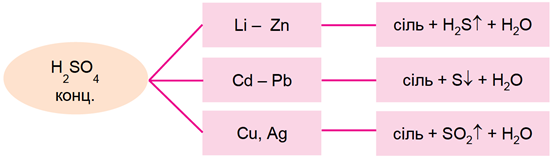
Рис. 1. Продукти реакцій металів із концентрованою сульфатною кислотою
Із-поміж металів, хімічні формули яких наведено у варіантах відповіді, лише золото стійке до дії концентрованої сульфатної кислоти.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали.
Завдання скеровано на перевірку вміння використовувати ряд активності металів для порівняння їхніх властивостей.
Магній у ряду активності розташований лівіше від заліза, тому активніше і, відповідно, швидше реагує з хлоридною кислотою (рис. 1).

Рис. 1. Ряд активності металів
Відповідь: Г.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали.
Завдання скеровано на перевірку вміння розпізнавати назви металічних елементів.
Лужні елементи належать до першої групи головної підгрупи періодичної системи (рис. 1).
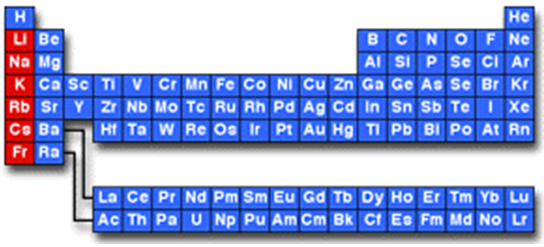
Рис. 1. Місце лужних елементів у періодичній системі
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Твердість води переважно зумовлена катіонами
Відповідь: Б.
ТЕМА: Неорганічні речовини та їхні властивості. Алюміній у природі. Сполуки Алюмінію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук Алюмінію.
Головним складником корунду є алюміній оксид
Відповідь: Г.
ТЕМА: Неорганічні речовини та їхні властивості. Кальцій у природі. Сполуки Кальцію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук Кальцію.
Вапняк і мармур – найважливіші сполуки Кальцію. Їхній головний складник – кальцій карбонат
Відповідь: B.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. металургія.
Завдання скеровано на перевірку розуміння хімізму добування заліза з руди.
Послідовність відновлення заліза із червоного залізняку така:
Відповідь: Б, В, А, Г.
ТЕМА: Загальна хімія. Неорганічні й органічні речовини. застосування неорганічних й органічних сполук.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Речовина | |||
| Назва | Застосування | ||
| 1 | барій сульфат | у медицині для рентгеноскопії шлунка | Б |
| 2 | фенол | для виробництва фенолформальдегідних пластмас | Д |
| 3 | глауберова сіль | у медицині як проносний засіб | Г |
| 4 | білки | будівельний матеріал організмів | B |
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Генетичні зв’язки між неорганічними сполуками різних класів. Лужні метали.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій лужних металів із водою.
Калій – лужний елемент. Калій реагує з водою з утворенням калій гідроксиду – лугу – і виділенням водню:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Генетичні зв’язки між неорганічними сполуками різних класів. Лужні метали.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій лужних металів із водою.
Натрій – лужний елемент. Натрій реагує з водою з утворенням натрій гідроксиду – лугу – і виділенням водню:
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Електронні формули.
Завдання скеровано на перевірку вміння аналізувати електронні формули, розпізнавати електронні формули неметалічних елементів.
Особливістю атомів неметалічних елементів є те, що їхній зовнішній енергетичний рівень близький до завершення.
Умову завдання задовольняє Фосфор (протонне число
Відповідь: B.
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Б Г А В.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Сполуки Феруму. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза й уміння прогнозувати перебіг реакцій за його участі.
Залізо в ряду активності металів розташоване лівіше від водню, міді й срібла та правіше від натрію, барію, магнію (рис. 1).

Рис. 1. Ряд активності металів
Тобто з-поміж запропонованих можливі такі реакції:
Відповідь: Г.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
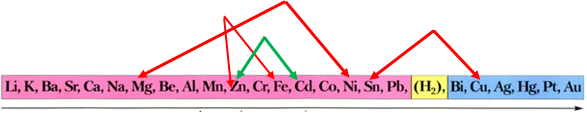
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що цинк витісняє із солі кадмій, оскільки в ряду активності він розташований лівіше від нього:
Відповідь: A.
ТЕМА: Основні хімічні поняття. Окисно-відновні реакції. Металотермія.
Завдання скеровано на перевірку знання застосування металів, уміння аналізувати хімічні рівняння з погляду окиснення-відновлення.
Металотермія – металургійні процеси добування металів із їхніх оксидів, засновані на відновленні активнішими металами (
Цій умові відповідає перетворення
Відповідь: B.
ТЕМА: Загальна хімія. Твердість води і способи її усунення.
Завдання скеровано на перевірку розуміння причин твердості води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Найважливіші йони, які зумовлюють твердість води
| Катіони | Аніони |
|
|
|
Унаслідок кип’ятіння твердої води розчинні гідрогенкарбонати Кальцію і Магнію перетворюються на нерозчинні карбонати, які осідають на стінках чайника.
Відповідь: A.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
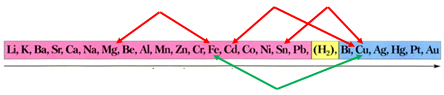
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що залізо витісняє із солі мідь, оскільки розташоване лівіше від нього:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ).
Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а зі слабкими (катіони Гідрогену в хлоридній кислоті) – сполуки Феруму(ІІ). Тому варіанти відповіді В і Г не задовольняють умову завдання. У реакціях із сильними відновниками (калій йодид) сполуки Феруму(ІІІ) відновлюються до сполук Феруму(ІІ), карбон(IV) оксид містить атом Карбону у найвищому ступені окиснення і не виявляє відновних властивостей:
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і їхнього практичного застосування, розуміння суті алюмотермії як окисно-відновного процесу.
Алюмотермíя (від алюміній і грец. ϑέρμη – тепло, жар) – металургійні процеси, за допомогою яких добувають розплавлені метали без підведення зовнішньої енергії з використанням порошкуватого алюмінію як відновника.
З-поміж наведених схем реакцій умову завдання задовольняє лише варіант відповіді Б.
Відповідь: Б.
ТЕМА: Загальні відомості про металічні елементи й метали. Калій, кальцій, сполуки Калію і Кальцію.
Завдання скеровано на перевірку знання хімічних властивостей калію, кальцію, сполук Калію і Кальцію.
А у реакції з водою атоми Калію і Кальцію віддають електрони з утворенням катіонів, що мають однакову електронну конфігурацію:
Б взаємодія калію і кальцію з водою відбувається бурхливо з виділенням водню
В В у промисловості кальцій оксид добувають випалюванням вапняку
Г оксид і гідроксид Кальцію виявляють основні властивості
Відповідь: B.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
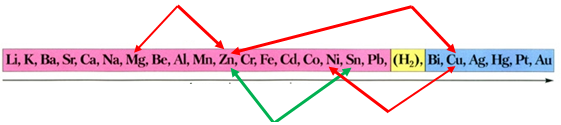
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що цинк витісняє із солі олово, оскільки розташований лівіше від нього:
Відповідь: A.
ТЕМА: Метали.
Завдання скеровано на перевірку вміння порівнювати активність металів.
Для порівняння активності металів потрібно використати їхній ряд активності (рис. 1).

Рис. 1. Ряд активності металів
Мідь у цьому ряду розташована правіше за інші метали, про які йдеться в завданні.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна (некарбонатна) твердість води зумовлена катіонами
Відповідь: A.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Хімічні властивості натрію.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей натрію, продуктів реакцій за його участі.
Реакцію натрію з водою можна описати хімічним рівнянням
Густина натрію (
Густина водню (
У розчині натрій гідроксиду, який утворився внаслідок реакції натрію з водою, фенолфталеїн набуває малинового кольору.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених пар «метал – сіль» лише залізо реагуватиме з купрум(ІІ) сульфатом у водному розчині, оскільки в ряду активності воно розташоване лівіше від міді:
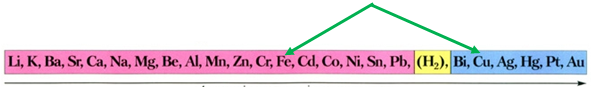
Рис. 1. Ряд активності металів
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
З-поміж речовин, формули яких наведено в завданні, для пом’якшення води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і гідрогенкарбонат-аніонів:
Відповідь: A.
ТЕМА: Загальна хімія. Неорганічні речовини. Зовнішні ефекти реакцій за участі неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин, зовнішніх ефектів реакцій за їхньої участі.
1 Одним із продуктів реакції міді з концентрованою нітратною кислотою є бурий газ (В) – нітроген(IV) оксид.
2 Одним із продуктів реакції купрум(ІІ) сульфату з натрій гідроксидом є блакитний осад (А) – купрум(IІ) гідроксид.
3 Одним із продуктів реакції ферум(ІІ) карбонату з хлоридною кислотою є безбарвний газ (Г) – карбон(IV) оксид.
4 Бурий осад ферум(ІІІ) гідроксиду під дією сульфатної кислоти розчиняється (Д).
Відповідь: 1В, 2А, 3Г, 4Д.
ТЕМА: Періодична система хімічних елементів. Хімічні властивості заліза.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі заліза.
Продуктами реакції заліза з розведеною сульфатною кислотою є ферум(ІІ) сульфат і водень:
Відповідь: Г.
ТЕМА: Періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
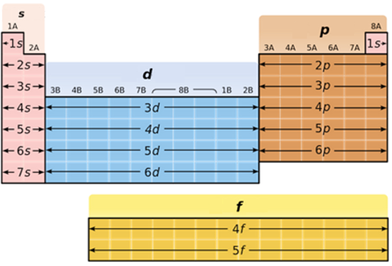
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Алюміній належить до p-елементів, будова зовнішнього енергетичного рівня його атома така:
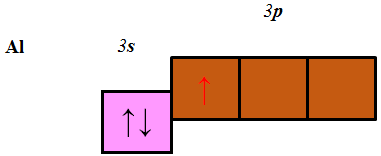
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння використовувати ряд активності металів для прогнозування можливості перебігу реакції між металом і сіллю в її розчині.

Рис. 1. Ряд активності металів
Що лівіше розташований метал в ряду активності, то більша його активність і відновні властивості.
Із-поміж металів, про які йдеться в завданні, активнішим за свинець є залізо, саме воно витіснятиме свинець із плюмбум(ІІ) нітрату в його водному розчині:
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що алюміній як активніший метал витіснятиме із солі мідь (рис. 1).

Рис. 1. Ряд активності металів
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна твердість води зумовлена катіонами
Відповідь: A.
ТЕМА: Неорганічна хімія. Ферум. Сполуки Феруму.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі заліза й сполук Феруму.
| 1 | Г | |
| 2 | Б | |
| 3 | B | |
| 4 | Д |
Відповідь: 1Г, 2Б, 3В, 4Д.
ТЕМА: Неорганічна хімія. Алюміній. Сполуки Алюмінію.
Завдання скеровано на перевірку знання властивостей алюмінію, сполук Алюмінію і способів їхнього добування.
Алюміній оксид є хімічно стійкою речовиною, із водою не реагує.
Алюміній реагує як із хлоридною кислотою, так і з лугами:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що залізо не витіснятиме із солей барій, кальцій і цинк, оскільки в ряду активності воно розташоване лівіше від них:
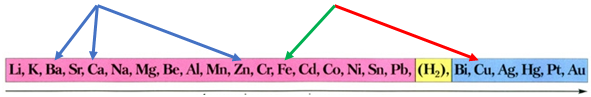
Залізо як активніший метал витісняє мідь із солі Купруму(ІІ):
Затим потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):

Вочевидь маса залізної пластинки збільшиться, якщо її занурити у водний розчин купрум(ІІ) нітрату.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі заліза.
Ферум(ІІІ) хлорид є продуктом реакції заліза з хлором:
Для перетворення ферум(ІІІ) хлориду на ферум(ІІІ) гідроксид потрібно на сіль подіяти лугом у водному розчині:
Відповідь: Б.
ТЕМА: Неорганічні речовини. Хімічні властивості алюмінію.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі алюмінію.
Алюміній сульфат є продуктом реакції між алюмінієм і розведеною сульфатною кислотою:
Відповідь: B.
ТЕМА: Періодична система хімічних елементів. Металічні елементи.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
В атомах металічних елементів на зовнішньому енергетичному рівні перебуває від одного до чотирьох електронів. Кількість електронів в атомах елементів головних підгруп періодичної системи дорівнює номеру групи. Тому варіанти відповіді В й Г не задовольняють умову завдання.
У IV групі містяться неметалічні елементи Карбон і Силіцій.
Із-поміж груп хімічних елементів, про які йдеться в завданні, лише металічні елементи містяться в ІІ групі.
Відповідь: A.
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза.
Продуктом реакції заліза з хлором є ферум(ІІІ) хлорид (А).
Продуктом реакції заліза з хлоридною кислотою є ферум(ІІ) хлорид (Б).
Залізо як менш активний метал не може витіснити активніші метали натрій і кальцій із їхніх солей у водних розчинах.
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ).
Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а з натрій хлориду у водному розчині залізо не може витіснити натрій (рис. 1). Тому варіанти відповіді Б і Г не задовольняють умову завдання.
Як активніший метал залізо витісняє мідь із купрум(ІІ) хлориду у водному розчині й водень з хлоридної кислоти:
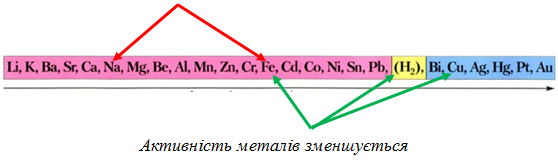
Рис. 1. Залізо не витісняє натрій з натрій хлориду у водному розчині. Натомість витісняє мідь з купрум(ІІ) хлориду й водень із хлоридної кислоти
Сполуки Феруму(ІІІ) утворюються внаслідок дії на сполуки Феруму(ІІ) окисників. Тобто умову завдання задовольняє варіант відповіді A:
Відповідь: A.
ТЕМА: Загальна хімія. Застосування оксидів. Окисники й відновники.
Завдання скеровано на перевірку знання властивостей і застосування неорганічних речовин.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Карбон(IV) оксид, силіцій(IV) оксид, сульфур(VI) оксид є вищими оксидами, атоми
У карбон(ІІ) оксиді атом Карбону
Відповідь: Б.
ТЕМА: Загальна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, уміння прогнозувати продукти реакцій за його участі.
Залізо реагує з перегрітою водяною парою:
Газуватим продуктом реакції є малорозчинний у воді газ водень, який зібрають витісненням її.
Сума коефіцієнтів:
Відповідь: А.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
Відповідь: А.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Порівнявши положення металів у ряду активності (рис. 1), можна дійти висновку, що цинк витіснятиме із солей свинець (В) і нікель (Г), оскільки в ряду активності він розташований лівіше:
Активніші метали – барій (А) і кальцій (Б), які в ряду активності розташовані лівіше за цинк, він із розчинів солей витіснити не зможе.

Рис. 1 Ряд активності металів
Атомна маса Плюмбуму більша за атомну масу Цинку, тому маса пластинки збільшилася.

Тобто умову завдання задовольняє лише плюмбум(ІІ) нітрат.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Алюміній гідроксид.
Завдання скеровано на перевірку знання властивостей алюміній гідроксиду.
Алюміній хлорид реагує з натрій гідроксидом із утворенням осаду амфотерного алюміній гідроксиду, який здатен розчинятися під дією лугу:
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють тимчасову твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасова (карбонатна) твердість води зумовлена катіонами
Відповідь: A.
Тема: Класифікація хімічних елементів.
Завдання скеровано на перевірку розуміння ознак класифікації хімічних елементів на металічні й неметалічні, знання місцеположення металічних і неметалічних елементів у періодичній системі.
Місцеположення металічних елементів у періодичній системі відображено на рисунку 1.
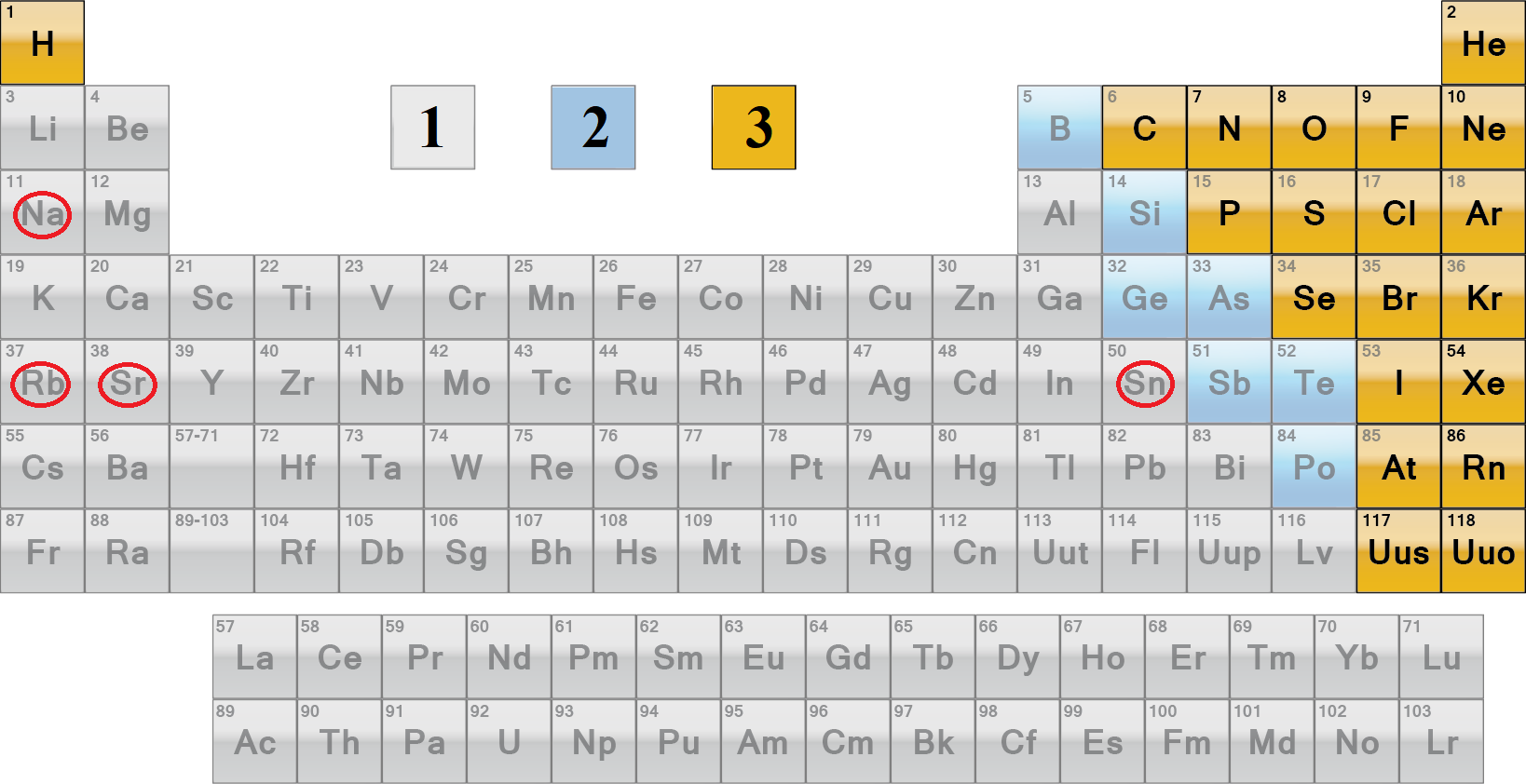
Рис. 1. Місцеположення в періодичній системі хімічних елементів – металічних (1), перехідних між металічними й неметалічними (2), неметалічних (3)
A Na, Ne, N
Б Cl, Sr, Sn
B P, As, Si
Г C, Br, Rb
Відповідь: Б.
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
Схемі перетворень, наведеній у завданні, відповідають такі хімічні рівняння:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Алюміній. Алюміній гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і способів добування алюміній гідроксиду.
Алюміній реагує з натрій гідроксидом у водному розчині з виділенням водню:
Алюміній гідроксид можна добути реакцією між алюміній хлоридом і натрій гідроксидом у водному розчині:
Відповідь: B.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати хімічні рівняння і класифікувати хімічні реакції за різними ознаками.
Реакцію кальцію з водою описують таким хімічним рівнянням:
І реагентами, і продуктами реакції є проста і складна речовини. Це реакція заміщення. Унаслідок реакції виділяється теплова енергія, реакція екзотермічна.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що свинець не витіснятиме із солі залізо, залізо – алюміній, мідь – цинк (рис. 1).

Рис. 1. Ряд активності металів
Цинк як активніший метал витісняє cвинець із солі Плюмбуму(ІІ):
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну твердість води зумовлено катіонами
Відповідь: B.
ТЕМА: Загальна хімія. Неорганічна хімія. Метали. Неметали.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння реакцій між металами й неметалами.
| Хімічне рівняння | Сума коефіцієнтів | |
| 3 | Г | |
| 5 | A | |
| 7 | Б | |
| 9 | B |
Відповідь: Г А Б В.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння порівнювати активність металів за їхнім положенням у ряду активності.
Здатність середніх солей взаємодіяти в розчині з металами можна спрогнозувати за довідковою таблицею «Ряд активності металів» (рис. 1).

Рис. 1. Ряд активності металів
Що лівіше розташований метал у цьому ряду, то він активніший. Тобто витіснятиме з розчинів солей метали, розміщені правіше від нього, легше руйнуватиметься під дією різних чинників – кородуватиме.
В умові завдання наведено фрагменти електронних формул, за якими можна визначити металічний елемент і, відповідно, метал:
| Символ хімічного елемента | Фрагмент електронної формули | Електронна формула |
Із-поміж металів, про які йдеться в умові завдання, найактивнішим є алюміній. Однак щільна оксидна плівка захищає його від корозії. Тому правильною відповіддю є залізо.
Відповідь: A.
ТЕМА: Загальна хімія. Металічні елементи. Корозія металів і способи захисту від неї.
Завдання скеровано на перевірку знання способів захисту металів від корозії.
Лудіння – покриття металевих предметів (переважно, сталевих і мідних) шаром олова методом напилювання, електролізу або зануренням у розплавлене олово; захищає від корозії.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння порівнювати активність металів за їхнім положенням у ряду активності.
Здатність середніх солей взаємодіяти в розчині з металами можна спрогнозувати за довідковою таблицею «Ряд активності металів» (рис. 1).

Рис. 1. Ряд активності металів
Що лівіше розташований метал у цьому ряду, то він активніший. Тобто витіснятиме з розчинів солей метали, розміщені правіше від нього.
Із-поміж металів, про які йдеться в умові завдання, найпасивнішою є мідь.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання поширеності хімічних елементів в природі.
Складником гемоглобіну є Ферум (рис. 1).
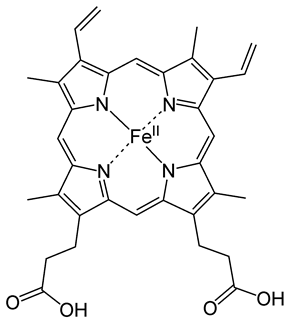
Рис. 1. Структурна формула гема
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Твердість води.
Завдання скеровано на перевірку знання причин твердості води й способів її пом’якшення.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів, що містяться в ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють з певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами
Тимчасову (карбонатну) твердість води зумовлено катіонами
Також для усунення тимчасової твердості води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і Магнію:
Відповідь: Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза. Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється стійка оксидна плівка.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених металів лише цинк реагуватиме з ферум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від заліза:
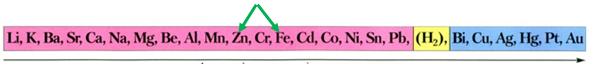
Рис. 1. Ряд активності металів
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
Для пом’якшення води використовують кип’ятіння, що забезпечує перетворення розчинних гідрогенкарбонатів Кальцію і Магнію на нерозчинні карбонати цих елементів:
Відповідь: Г.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
А
Б
В
Г
Натрій – лужний елемент, Берилій – металічний елемент, Ферум – металічний елемент (рис. 1).
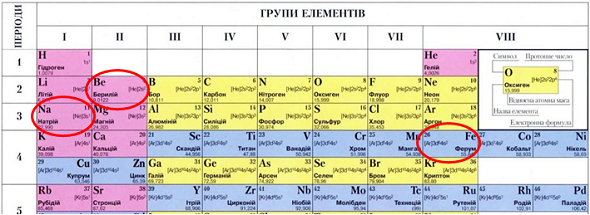
Відповідь: Б.




