Розділ: Розв’язування задач за формулами речовин
Тема: Обчислення відносної молекулярної/молярної маси речовини за її формулою
Кількість завдань: 30
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини. Обчислення маси речовини за кількістю. Фенол.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу, обчислювати молярну масу речовини й кількість речовини за кількістю речовини хімічного елемента – її складника.
Формула фенолу \(\mathrm{C_6H_5OH}.\) У молекулі фенолу шість атомів Карбону, тобто кількість речовини фенолу вшестеро менша за кількість речовини атомів Карбону:
Молярна маса фенолу
Маса фенолу є добутком кількості речовини фенолу на його молярну масу:
Відповідь: 47.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини.
Завдання скеровано на перевірку вміння аналізувати структурну формулу речовини, визначати за нею молекулярну формулу, обчислювати молярну масу речовини.
Аналізування структурної формули дає змогу визначити кількість атомів Карбону, Гідрогену, Оксигену в молекулі речовини й написати молекулярну формулу:
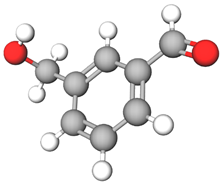
$$ \mathrm{HO-C_6H_4-CH_2OH}\ \text{або}\ \mathrm{C_7H_8O_2.} $$
Відповідь: 124.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(\mathrm{CH_3NH_2}\)
\(A_r(\mathrm{N})=14\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{C})=12\)
Знайти:
\(M_r(\mathrm{CH_3NH_2})\ -\ ?\)
\begin{gather*} M_r(\mathrm{CH_3NH_2})=12+3\cdot 1+14+2\cdot 1\\[7pt] M_r(\mathrm{CH_3NH_2})=31. \end{gather*}
Відповідь: 31.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
\(\mathrm{NH_4NO_3}\)
\(A_r(\mathrm{N})=14\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{NH_4NO_3})\ -\ ?\)
\begin{gather*} M_r(\mathrm{NH_4NO_3})=14+4\cdot 1+14+3\cdot 16\\[7pt] M_r(\mathrm{NH_4NO_3})=80\\[7pt] M(\mathrm{NH_4NO_3})=80\ \text{г/моль}. \end{gather*}
Відповідь: 80.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{Na})=23\)
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Na_2CO_3})\ -\ ?\)
Відповідь: 106.
ТЕМА: Обчислення в хімії. Обчислення за хімічною формулою молярної маси речовини.
Завдання скеровано на перевірку знання формул кристалогідратів і вміння обчислювати за хімічною формулою кристалогідрату його молярну масу.
Дано:
\(\mathrm{CuSO_4\cdot 5H_2O}\)
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{S})=32\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M(\mathrm{CuSO_4\cdot 5H_2O})\ -\ ?\)
Відповідь: 250.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. оскільки молярні об’єми різних газів за однакових умов рівні, відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метан | $$ \mathrm{CH_4} $$ | 16 | B |
| Амоніак | $$ \mathrm{NH_2} $$ | 17 | Б |
| Карбон(II) оксид | $$ \mathrm{CO} $$ | 28 | A |
| Карбон(IV) оксид | $$ \mathrm{CO_2} $$ | 44 | Г |
Відповідь: В Б А Г.
ТЕМА: Обчислення в хімії. Обчислення відносної молекулярної маси за формулою речовини.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу за формулою речовини.
Дано:
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M_r(\mathrm{(CuOH)_2CO_3})\ -\ ?\)
Відповідь: 222.
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за хімічною формулою.
Завдання скеровано на перевірку вміння розпізнавати аніони за допомогою якісних реакцій та обчислювати молярну масу речовини за хімічною формулою.
Умову завдання задовольняє силікат-аніон. Під дією хлоридної кислоти на розчинний силікат випадає склоподібний осад силікатної кислоти. Осад розчиняється внаслідок нейтралізації кислоти лугом.
\begin{gather*} M(\mathrm{SiO^{2-}_3})=(28+3\cdot 16)\ \text{г/моль}\\[7pt] M(\mathrm{SiO^{2-}_3})=76\ \text{г/моль} \end{gather*}Відповідь: 76.
ТЕМА: Неорганічна хімія. Сполуки Силіцію. Силіцій(IV) оксид.
Завдання скеровано на перевірку знання поширеності в природі, будови й застосування силіцій(IV) оксиду.
Умову завдання задовольняє силіцій(IV) оксид, молярна маса якого становить \(60\ \text{г/моль}\):
\begin{gather*} M_r(\mathrm{SiO_2})=A_r(\mathrm{Si})+2A_r(\mathrm{O});\\[7pt] M_r(\mathrm{SiO_2})=28+2\cdot 16;\\[7pt] M_r(\mathrm{SiO_2})=60;\\[7pt] M(\mathrm{SiO_2})=60\ \text{г/моль}. \end{gather*}Відповідь: Г.
ТЕМА: Загальна хімія. Молярна маса.
Завдання скеровано на перевірку знання хімічної формули сульфатної кислоти й уміння обчислювати молярну масу речовини.
Молярна маса речовини чисельно дорівнює її відносній молекулярній масі:
\begin{gather*} M_r(\mathrm{H_2SO_4})=2\cdot 1+16+4\cdot 16=98\\[7pt] M(\mathrm{H_2SO_4})=98\ \text{г/моль} \end{gather*}Відповідь: Г.
ТЕМА: Обчислення в хімії. Обчислення за хімічною формулою молярної маси речовини.
Завдання скеровано на перевірку вміння обчислювати за хімічною формулою кристалогідрату його молярної маси.
Дано:
\(\mathrm{FeSO_4\cdot 7H_2O}\)
\(A_r(\mathrm{Fe})=56\)
\(A_r(\mathrm{S})=32\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M(\mathrm{FeSO_4\cdot 7H_2O})\ -\ ?\)
Відповідь: 278.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. Оскільки молярні об’єми різних газів за однакових умов рівні, відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Карбон(II) оксид | $$ \mathrm{CO} $$ | 28 | A |
| Нітроген(II) оксид | $$ \mathrm{NO} $$ | 30 | B |
| Карбон(IV) оксид | $$ \mathrm{CO_2} $$ | 44 | Б |
| Нітроген(IV) оксид | $$ \mathrm{NO_2} $$ | 46 | Г |
Відповідь: А В Б Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{CO_2})=44\)
\(M_r(\mathrm{He})=4\)
Знайти:
\(D_{\mathrm{He}}(\mathrm{CO_2})\ -\ ?\)
Відповідь: 11.
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина D газуватої речовини X за газуватою речовиною Y дорівнює відношенню густин ρ цих газів, виміряних за однакових умов. Оскільки молярні об’єми газів за однакових умов рівні, для порівняння відносних густин газів достатньо порівняти їхні молярні маси, які чисельно дорівнюють відносним молекулярним масам: \begin{gather*} M_r(\mathrm{C_2H_2})=26;\ \ M_r(\mathrm{Cl_2})=71;\\[7pt] M_r(\mathrm{CO_2})=44;\ \ M_r(\mathrm{SO_2})=64. \end{gather*}
Відповідь: А, В, Г, Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини.
Дано:
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{C})=12\)
Знайти:
\(M_r(\mathrm{(CuOH)_2CO_3})\ -\ ?\)
Відповідь: 222.
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій гідрогенкарбонату
Відповідь: Б.
ТЕМА: Обчислення в хімії. Молярна маса. Обчислення кількості речовини за її масою.
Завдання скеровано на перевірку вміння обчислювати молярну масу за формулою речовини.
Молярна маса речовини чисельно дорівнює її відносній молекулярній масі.
Відповідь: B.
ТЕМА: Кількість речовини.
Завдання скеровано на перевірку розуміння змісту поняття кількість речовини.
Маса \(m\) і кількість речовини \(n\) зв’язані формулою $$ n(X)=\frac{m(X)}{M(X)}, $$ де \(M\) – молярна маса речовини, яка чисельно дорівнює його відносній молекулярній масі.
Тобто чим більша відносна молекулярна маса речовини, тим менша її кількість в порції певної маси.
| А | \(M_r(\mathrm{Cu_2S})=2\cdot 64+32\) | 1 |
| Б | \(M_r(\mathrm{CuO})=64+16\) | 2 |
| В | \(M_r(\mathrm{SO_3})=32+2\cdot 16\) | 3 |
| 4 | \(M_r(\mathrm{CH_4})=12+1\cdot 4\) | 4 |
Відповідь: 1А, 2Б, 3В, 4Г.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{N})=14\)
Знайти:
\(M_r(\mathrm{H_2N-CH_2COOH})\ -\ ?\)
Відповідь: 75.
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина \(D\) газуватої речовини \(D\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. Оскільки молярні об’єми газів за однакових умов рівні, для порівняння відносних густин газів достатньо порівняти їхні молярні маси, які чисельно дорівнюють відносним молекулярним масам:
\begin{gather*} M_r(\mathrm{H_2S})=34;\ \ M_r(\mathrm{SO_2})=64\\[7pt] M_r(\mathrm{N_2O})=44;\ \ M_r(\mathrm{NO})=30. \end{gather*}Відповідь: 1Г, 2А, 3В, 4Б.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{N})=14\)
Знайти:
\(M_r(\mathrm{CH_3NHC_2H_5})\ -\ ?\)
Відповідь: 59.
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й наслідків із нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Оскільки молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями: \begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV;\\[6pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac{M}{V_m}. \end{gather*}
Тобто однакові густини в газів із однаковою молярною масою.
Молярна маса кисню 32 г/моль. Така сама молярна маса в силану \(\mathrm{SiH_4}\).
Відповідь: Б.
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й уміння застосовувати наслідки з нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями:
\begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV ;\\[6pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac{M}{V_m}. \end{gather*}Тобто для розв’язання завдання потрібно порівняти відносні молекулярні маси газів, якими заповнювали колби:
Гази, густина яких більша за густину повітря, збирають у посудину, розташовану отвором угору, а гази, густина яких менша за густину повітря, – у посудину, розташовану отвором униз. З огляду на це умову завдання задовольняє лише варіант відповіді Г, бо:
1) метан (варіанти відповіді А й Б) не збирають у посудину, розташовану отвором угору, а кисень (А) і пропан (В) – у посудину, розташовану отвором униз;
2) густина кисню більша, а метану – менша за густину повітря.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Завдання скеровано на перевірку вміння визначати формулу речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Дано:
\(M_r(\mathrm{E_2O_5})=142\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(Z(\mathrm{E})\ -\ ?\)
Відповідь: 15.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за хімічною формулою речовини.
Завдання скеровано на перевірку вміння обчислювати молярну масу за хімічною формулою речовини.
Дано:
\(\mathrm{Ca(H_2PO_4)_2}\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{P})=31\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Ca(H_2PO_4)_2})\ -\ ?\)
Відповідь: 234.
ТЕМА: Загальна хімія. Обчислення в хімії. Молярна маса.
Завдання скеровано на перевірку розуміння поняття молярної маси й уміння обчислювати її за формулою речовини.
Молярна маса – маса речовини кількістю \(1\) моль. Молярна маса чисельно дорівнює відносній молекулярній масі.
| Речовина | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метаналь | $$ \mathrm{HCHO} $$ | 30 | Г |
| Метанова кислота | $$ \mathrm{HCOOH} $$ | 46 | Б |
| Етанова кислота | $$ \mathrm{CH_3COOH} $$ | 60 | B |
| Гліцин | $$ \mathrm{NH_2CH_2COOH} $$ | 75 | A |
Відповідь: Г Б В А.
ТЕМА: Загальна хімія. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу й порівнювати склад вуглеводнів різних гомологічних рядів.
Послідовність розташування за збільшенням молекулярної маси очевидна з хімічних формул вуглеводнів.
| Вуглеводень | |||
| Назва | Молекулярна формула | Відносна молекулярна маса | |
| пропан | $$ \mathrm{C_3H_8} $$ | 44 | A |
| бутен | $$ \mathrm{C_4H_8} $$ | 56 | B |
| пентин | $$ \mathrm{C_5H_8} $$ | 68 | Г |
| гексин | $$ \mathrm{C_6H_{10}} $$ | 82 | Б |
Відповідь: А В Г Б.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати молярну масу за формулою речовини.
Дано:
\(A_r(\mathrm{Ca})=40\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{P})=31\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Ca(H_2PO_4)_2})\ -\ ?\)
Відповідь: 234.
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій ортофосфатної кислоти
\begin{gather*} M_r(\mathrm{H_3PO_4})=3A_r(\mathrm{H})+A_r(\mathrm{P})+4A_r(\mathrm{O});\\[7pt] M_r(\mathrm{H_3PO_4})=3\cdot 1+31+4\cdot 16;\\[7pt] M_r(\mathrm{H_3PO_4})=98;\\[7pt] M_r(\mathrm{H_3PO_4})=98\ \text{г/моль}. \end{gather*}Відповідь: A.
