Розділ: Основні класи неорганічних сполук
Тема: Оксиди
Кількість завдань: 107
ТЕМА: Хімічні властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння за хімічною формулою визначати тип кристалічних ґраток речовини й прогнозувати її хімічні властивості.
| Варіант відповіді | 1 | 2 | 3 |
| А | |||
| Б | |||
| B | |||
| Г |
Натрій гідроксид
Відповідь: Г.
ТЕМА: Кислоти й основи. Значення
Завдання скеровано на перевірку вміння прогнозувати
| Варіант | Речовини | Продукт розчинення у воді речовини або продукту реакції речовини з водою | |
| А | |||
| Б | |||
| B | |||
| Г | |||
Відповідь: Г.
ТЕМА: Властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участю неорганічних сполук різних класів.
| Варіант відповіді | Схема реакції | Оцінка можливості перебігу реакції |
| А | Мідь не реагує з водою | |
| Б | Нерозчинні основи термічно нестійкі й із часом і/або внаслідок нагрівання розкладаються на оксид металічного елемента й воду | |
| B | Основні й амфотерні гідроксиди реагують із кислотами. Продукти реакції – сіль і вода | |
| Г | Активніший метал цинк витісняє мідь із розчиненої у воді солі Купруму |
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій між неорганічними речовинами.
Речовина 1 не взаємодіє з водою і хлоридною кислотою, але реагує з натрій гідроксидом. Це кислотний силіцій(IV) оксид:
Речовина 2 реагує з водою і натрій гідроксидом, але не взаємодіє з хлоридною кислотою. Це кислотний фосфор(V) оксид:
Речовина 3 не взаємодіє з водою, , але реагує з натрій гідроксидом і хлоридною кислотою. Це амфотерний алюміній оксид:
Відповідь: 1Г; 2Д; 3В.
ТЕМА: Неорганічна хімія. Луги. Оксиди. Хімічні властивості натрій гідроксиду й фосфор(V) оксиду.
Завдання скеровано на перевірку знання властивостей лугів і кислотних оксидів, уміння прогнозувати й пояснювати спостереження.
Натрій гідроксид і фосфор(V) оксид – гігроскопічні речовини, тобто легко вбирають водяну пару з повітря. Фосфор(V) оксид реагує з водою з утворенням ортофосфатної кислоти. Тому маси посудин із обома речовинами збільшаться.
Відповідь: B.
ТЕМА: Неорганічна хімія. Оксиди і леткі сполуки з Гідрогеном неметалічних елементів. Індикатори.
Завдання скеровано на перевірку знання властивостей оксидів і летких сполук із Гідрогеном неметалічних елементів, уміння прогнозувати кольори індикаторів у водних розчинах лугів і кислот.
Водні розчини карбон(ІІ) оксиду й метану не містять катіонів Гідрогену чи гідроксид-аніонів, тому не діють ні на фенолфталеїн, ні на метиловий оранжевий.
Водний розчин амоніаку містить гідроксид-аніони, тому фенолфталеїн набуде під їхньою дією малинового забарвлення. Отже, цей варіант не задовольняє умову завдання:
Водний розчин гідроген хлориду містить катіони Гідрогену, під дією яких метиловий оранжевий змінює оранжеве забарвлення на рожеве:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку знання хімічних властивостей оксидів лужноземельних хімічних елементів і вміння вирізняти їх поміж інших оксидів.
Умову завдання задовольняє кальцій оксид, формула якого
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Оксиди. Луги.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів лужних елементів.
Продуктом реакції калій оксиду з водою є калій гідроксид – луг.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати формули осно́вних оксидів і застосовувати знання про їхні хімічні властивості.
Умову завдання задовольняє осно́вний магній оксид:
Карбон(ІІ) оксид – несолетворний, силіцій(ІV) оксид – кислотний, тож із хлоридною кислотою не реагують.
Цинк оксид амфотерний, реагує і з хлоридною кислотою, і з натрій гідроксидом:
Відповідь: Г.
ТЕМА: Оксиди. Основи. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей оксидів і способів добування лугів.
Луги добувають дією води на оксиди лужних елементів, Кальцію, Барію тощо. Кальцій оксид реагує з водою з утворенням кальцій гідроксиду. Решта оксидів, про які йдеться в завданні, з водою не реагують.
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку знання визначення оксидів як класу неорганічних сполук, уміння визначати ступені окиснення хімічних елементів у сполуці за її хімічною формулою, розпізнавати оксиди за їхніми хімічними формулами.
Оксиди – бінарні сполуки Оксигену з іншими елементами, у яких ступінь окиснення атома чи атомів Оксигену становить –2. Цю умову не задовольняє натрій пероксид
А
Б
В
Г
Відповідь: Г.
ТЕМА: Неорганічна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1. Продуктом гідратації кальцій оксиду є одна складна речовина – кальцій гідроксид.
2. Унаслідок розкладання кальцій карбонату утворюються дві складні речовини – оксиди Кальцію і Карбону(IV).
3. Унаслідок розкладання гідроген пероксиду утворюються вода (складна речовина) і кисень (проста речовина).
Відповідь: 1В, 2Б, 3А.
ТЕМА: Неорганічні речовини. Карбон(IV) оксид.
Завдання скеровано на перевірку знання тривіальної назви карбон(IV) оксиду і його хімічної формули.
Вуглекислий газ – продукт газообміну в легенях людини й сировина для фотосинтезу глюкози й крохмалю рослинами, його систематична назва карбон(IV) оксид, хімічна формула –
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук і способи їхнього добування.
Вапно – тривіальна назва кальцій оксиду
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук і способи їхнього добування.
Дією етанової (оцтової) кислоти на кальцій карбонат добувають карбон(IV) оксид (вуглекислий газ):
Густина карбон(IV) оксиду більша за густину повітря, тому його збирають у посудину, розташовану отвором догори.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук.
А амфотерний цинк оксид реагує з лугом
Б амфотерний купрум(ІІ) оксид реагує з нітратною кислотою
В кислотний сульфур(IV) оксид реагує з основним кальцій оксидом
Г два вищі кислотні оксиди – сіліцій(IV) оксид і карбон(IV) оксид – не реагують між собою
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння визначати хімічний характер оксидів хімічних елементів і прогнозувати можливість перебігу реакцій між ними.
Під час розв’язання завдання потрібно взяти до уваги, що реакції можливі між основним і кислотним оксидами – натрій оксидом, який є основним, і фосфор(V) оксидом, що належить до кислотних:
Відповідь: A.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за якісним і кількісним складом реагентів і продуктів реакції та тепловим ефектом.
Під час реакції кальцій оксиду з водою частина її перетворилася на пару. Це свідчить про виділення теплоти. Отже, реакція є екзотермічною:
Реагентами в цій реакції є дві складні речовини, продуктом – одна складна речовина. Це реакція сполучення.
Відповідь: A.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку як розуміння суті процесів окиснення і відновлення, так і вміння встановлювати причиново-наслідкові зв’язки між властивостями й застосуванням речовин.
У карбон(ІІ) оксиді атом Карбону має ступінь окиснення +2 і здатен підвищити його до +4 внаслідок утрати електронів:
Те, що карбон(ІІ) оксид є сильним відновником, використовують для відновлення металів з оксидів металічних елементів, наприклад:
Відповідь: B.
ТЕМА: Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку вміння порівнювати фізичні й хімічні властивості неметалів, оксидів неметалічних елементів.
Для виконання завдання необхідно знати якісну реакцію на карбон(ІV) оксид.
Реактивом на карбон(ІV) оксид, який належить до кислотних, є вапняна вода (насичений розчин кальцій гідроксиду). Карбон(ІV) оксид із вапняною водою утворює осад білого кольору (
Відповідь: B.
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. Загальні відомості про неметалічні елементи й неметали. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання властивостей основних класів неорганічних сполук, розуміння процесу гідролізу солей і вміння визначати середовища водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз; розуміти, як визначити середовище водного розчину солі.
Проаналізуємо склад розчину кожної речовини й визначимо реакцію середовища.
1 – сульфур(IV) оксид (
Відповідь: Г.
ТЕМА: Загальна хімія. Класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати формули неорганічних речовин різних класів.
| Оксигеновмісна органічна речовина | ||||
| Клас неорганічних сполук | Формула | |||
| 1 | сіль | складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Б | |
| 2 | оксид | бінарна сполука з Оксигеном, ступінь окиснення якого –2 | Д | |
| 3 | основа | складна речовина, утворена катіонами металічного елемента й гідроксид-аніонами | B | |
| 4 | кислота | складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами кислотного залишку | Г | |
Відповідь: 1Б, 2Д, 3В, 4Г.
ТЕМА: Неорганічні речовини та їхні властивості. Оксиди. Несолетворні оксиди.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
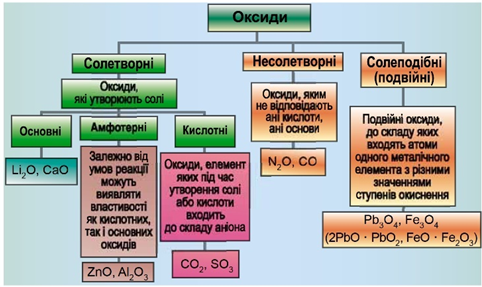
Рис. 1. Класифікація оксидів
Умову завдання задовольняє нітроген(IІ) оксид, який не утворює солей.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Хімічні властивості ферум(ІІІ) оксиду.
Завдання скеровано на перевірку знання хімічних властивостей ферум(ІІІ) оксиду.
Ферум(ІІІ) оксид є амфотерним, оскільки реагує як із кислотами, так і з лугами:
Відповідь: B.
ТЕМА: Неорганічна хімія. Ферум(ІІ) оксид. Сульфатна кислота.
Завдання скеровано на перевірку знання властивостей ферум(ІІ) оксиду й сульфатної кислоти.
Ферум(ІІ) оксид реагує з розведеною сульфатною кислотою з утворенням ферум(ІІ) сульфату й води:
Відповідь: Б.
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Речовиною
є кислотний карбон(IV) оксид:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Сполуки Кальцію. Кальцій оксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду.
Кальцій оксид – типовий основний оксид. Він реагує із карбон(IV) оксидом і (1) сульфатною кислотою (2). Як оксид активного металічного елемента реагує з водою (5):
Відповідь: B.
ТЕМА: Органічна й неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні й органічні речовини за будовою їхніх молекул.
| Речовина | ||||
| Назва | Формула | Модель молекули | ||
| 1 | Метан | 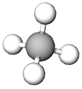 |
B | |
| 2 | Амоніак | 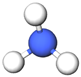 |
Г | |
| 3 | Вода | 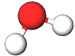 |
Б | |
| 4 | Оцтова кислота | 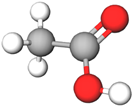 |
Д | |
Відповідь: 1В, 2Г, 3Б, 4Д.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | B | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | двохосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | Д |
Відповідь: 1В, 2А, 3Б, 4Д.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів. Кислотні опади руйнують, зокрема, мармур, головний складник якого –кальцій карбонат.
Серед наведених варіантів відповіді умову завдання задовольняють сульфур(ІV) оксид і нітроген(ІV) оксид:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості оксидів і лугів для прогнозування можливості перебігу реакцій між ними.
В умові завдання наведено хімічні формули вищих кислотних
Кислотні оксиди не реагують між собою. Вони реагують з осно́вними оксидами й лугами. Основні оксиди з лугами не взаємодіють.
Тобто з-поміж наведених у завданні пар речовин реакція відбудеться лише між силіцій(IV)оксидом і натрій гідроксидом:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали
Завдання перевіряє знання властивостей лужноземельних металів, а саме кальцію і його сполук.
Проаналізуємо твердження:
І твердження правильне, у промисловості кальцій оксид добувають випалюванням вапняку.
ІІ твердження неправильне, тому що Кальцій – лужноземельний металічний елемент, він утворює оксид і гідроксид, які виявляють оснόвні властивості.
Відповідь: A
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості солетворних оксидів.
Завдання перевіряє знання визначення кислотних і основних оксидів, хімічних властивостей солетворних оксидів.
Для розв’язання завдання необхідно вміти розрізняти кислотні й основні оксиди (основні оксиди – оксиди металічних елементів, кислотні – неметалічних елементів) і знати, що вони реагують між собою, не реагують між собою або два основних оксиди, або два кислотних. У варіантах А, В і Г наведено пари формул основного і кислотного оксидів, а у варіанті Б – два основних оксиди, тому правильна відповідь Б.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє знання понять і хімічних властивостей основних класів неорганічних сполук.
Для виконання завдання необхідно знати, що карбон(IV) оксид як кислотний, із запропонованих варіантів реагує лише з літій оксидом:
Відповідь: B.
ТЕМА: Неорганічна хімія. Металічні елементи та їхні сполуки. Лужні та лужноземельні елементи.
Завдання перевіряє знання найпоширеніших назв і склад деяких неорганічних речовин, які передбачено програмою зовнішнього незалежного оцінювання.
Для виконання завдання необхідно знати формулу негашеного вапна –
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Силіцій(ІV) оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості оксидів для прогнозування можливості хімічних реакцій за їхньої участі.
Силіцій(ІV) оксид – вищий оксид Силіцію, кислотний. Тому з киснем силіцій(ІV) оксид не реагує.
Так само кислотний силіцій(ІV) оксид не реагує з кислотним фосфор(V) оксидом і сульфатною кислотою.
Силіцій(ІV) оксид реагує з осно́вним натрій оксидом:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння застосовувати знання про властивості осно́вних і кислотних оксидів, зокрема їхньої здатності реагувати між собою (рис. 1).
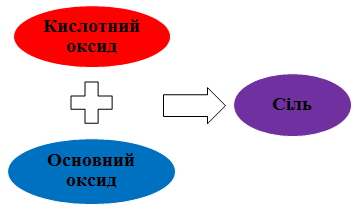
Рис. 1. Взаємодія основних і кислотних оксидів
Натрій оксид і кальцій оксид основні, карбон (IV) оксид, силіцій(IV) оксид, фосфор(V) оксид – кислотні. Тож реагуватимуть між собою натрій оксид і фосфор(V) оксид .
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості оксидів. Алкани. Хімічні властивості алканів.
Завдання перевіряє знання хімічних властивостей кислотних оксидів і алканів.
Для виконання завдання необхідно вміти порівнювати дію наведених реагентів на пропан і вуглекислий газ. Пропан не буде взаємодіяти з жодним з наведених реагентів, а карбон(IV) оксид у водному розчині буде реагувати лише з вапняною водою з утворенням осаду:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості солетворних оксидів.
Завдання перевіряє знання визначення кислотних і основних оксидів, хімічних властивостей солетворних оксидів.
Для виконання завдання необхідно вміти розрізняти кислотні й основні оксиди і знати, що вони реагують між собою. Кислотні і основні оксиди наведено в парах під номерами 1 і 3.
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій між неорганічними сполуками – представниками різних класів.
Сульфур(VI) оксид – кислотний, йому відповідає двоосновна сульфатна кислота. Тож сульфур(VI) оксид реагує з калій гідроксидом у водному розчині з утворенням калій сульфату й води:
Утворення калій гідрогенсульфату – кислої солі – неможливе, бо в калій гідроксид узято в надлишку.
Відповідь: B.
ТЕМА: Неорганічні речовини та їхні властивості. Оксиди. Несолетворні оксиди.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
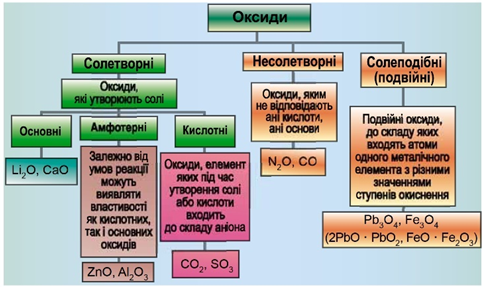
Рис. 1. Класифікація оксидів
Умову завдання задовольняє нітроген(IІ) оксид, який не утворює солей.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Назви неорганічних сполук.
Завдання скеровано на перевірку вміння називати неорганічні речовини за систематичною номенклатурою.
| Речовина | |||
| Формула | Назва | ||
| 1 | хлоридна кислота | Б | |
| 2 | ортофосфатна кислота | Г | |
| 3 | кальцій оксид | A | |
| 4 | фосфор(V) оксид | B | |
Відповідь: 1Б, 2Г, 3А, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Кислоти.
Завдання скеровано на перевірку вміння прогнозувати можливість реакцій між речовинами, що належать до різних класів.
Кальцій оксид основний, тому реагує з хлоридною кислотою з утворенням солі й води:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Кислотні оксиди.
Завдання скеровано на перевірку вміння розпізнавати формули кислотних оксидів.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
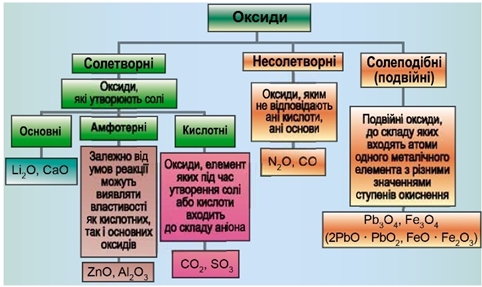
Рис. 1. Класифікація оксидів
Сульфур(IV) оксид, формула якого
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Основні оксиди.
Завдання скеровано на перевірку вміння розпізнавати формули основних оксидів.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
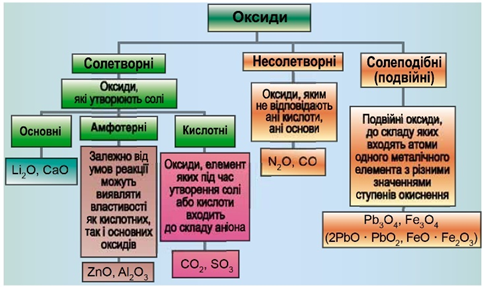
Рис. 1. Класифікація оксидів
Кальцій оксид, формула якого
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди, основи, кислоти, солі.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів, основ, кислот, солей.
| Клас неорганічних сполук | Визначення | Речовина | |||
| Формула | Назва | ||||
| 1 | кислоти | Складні речовини, утворені атомами Гідрогену, сполученими з кислотними залишками. Валентність кислотного залишку дорівнює кількості атомів Гідрогену в молекулі кислоти | сульфатна кислота | B | |
| 2 | оксиди | Складні речовини, утворені двома елементами, одним із яких є Оксиген у ступені окиснення –2 | сульфур(VI) оксид | Д | |
| 3 | основи | Складні речовини, утворені катіонами металічних елементів й аніонами гідроксильних груп. Кількість гідроксильних груп у формулі основи дорівнює ступеню окиснення металічного елемента в ній | кальцій гідроксид | A | |
| 4 | солі | Складні речовини, йонні сполуки. Середні солі утворені катіонами металічних елементів або/та амонію й аніонами кислотних залишків | кальцій сульфат | Б | |
Відповідь: 1В; 2Д; 3А; 4Б.
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками.
Умову завдання задовольняє карбон(IV) оксид:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Несолетворні оксиди.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
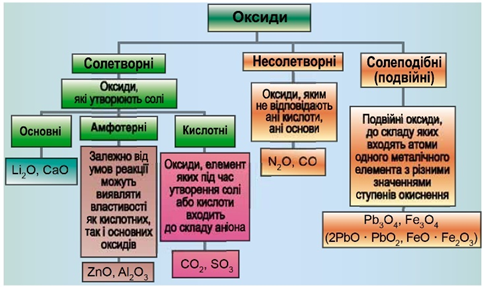
Рис. 1. Класифікація оксидів
Умову завдання задовольняє карбон(ІІ) оксид.
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Карбон(IV) оксид.
Завдання скеровано на перевірку знання властивостей кислотних оксидів.
Карбон(IV) оксид – вищий оксид Карбону, тому з киснем не реагує. Це – кислотний оксид, тому з нітратною кислотою і кислотним фосфор(V) оксидом не взаємодіє.
Карбон(IV) оксид реагує з основним натрій оксидом з утворенням натрій карбонату:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння розпізнавати амфотерні оксиди.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк оксид
Відповідь: A.
ТЕМА: Неорганічна хімія. Фосфор(V) оксид.
Завдання скеровано на перевірку знання властивостей фосфор(V) оксиду.
Кислотний фосфор(V) оксид реагує не лише з водою (на цій реакції ґрунтується застосування фосфор(V) оксиду як осушувача), а й з амоніаком, тому його не можна використовувати для видалення домішок водяної пари із цього газу. З рештою газів – азотом, киснем, карбон(ІV) оксидом – він не реагує.
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
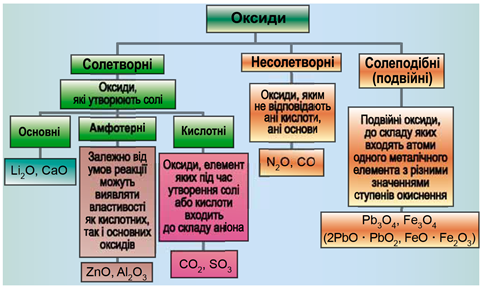
Рис. 1. Класифікація оксидів
Несолетворні оксиди не реагують із водою, кислотами, лугами. Представниками несолетворних оксидів є карбон(ІІ) оксид, нітроген(ІІ) оксид, нітроген(І) оксид.
Відповідь: A.
ТЕМА: Неорганічна хімія. Властивості кисню і карбон(IV) оксиду.
Завдання скеровано на перевірку знання властивостей кисню і карбон(IV) оксиду.
Газуваті кисень і карбон(IV) оксид безбарвні, не реагують із сульфатною кислотою і не діють на фенолфталеїн у розчині.
Кисень підтримує горіння, а карбон(IV) оксид – ні, тому в кисні тліюча скіпка спалахує, а в карбон(IV) оксиді – згасає.
Відповідь: Б.
ТЕМА: Загальні відомості про металічні елементи й метали. Калій, кальцій, сполуки Калію і Кальцію.
Завдання скеровано на перевірку знання хімічних властивостей калію, кальцію, сполук Калію і Кальцію.
А у реакції з водою атоми Калію і Кальцію віддають електрони з утворенням катіонів, що мають однакову електронну конфігурацію:
Б взаємодія калію і кальцію з водою відбувається бурхливо з виділенням водню
В В у промисловості кальцій оксид добувають випалюванням вапняку
Г оксид і гідроксид Кальцію виявляють основні властивості
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
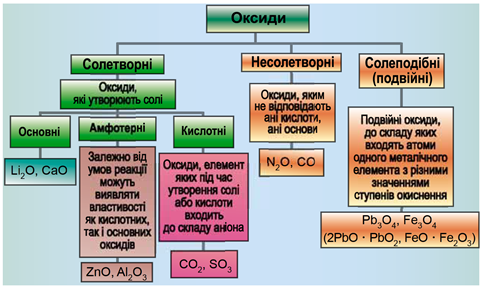
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Силіцій оксид є кислотним, алюміній оксид – амфотерним, барій оксид – осно́вним.
Відповідь: Б.
ТЕМА: Органічні й неорганічні речовини.
Завдання скеровано на перевірку вміння розпізнавати формули органічних і неорганічних речовин.
| Зображення моделі молекули речовини | Назва речовини | ||
| 1 | 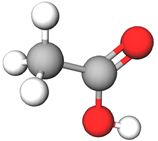 |
етанова кислота | Г |
| 2 | 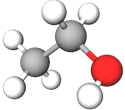 |
етанол | B |
| 3 | 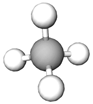 |
метан | Д |
| 4 | 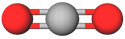 |
карбон(IV) оксид | A |
Відповідь: Г, В, Д, А.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини.
1
2
3
4
Відповідь: Б, А, Д, Б.
ТЕМА: Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння класифікувати оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
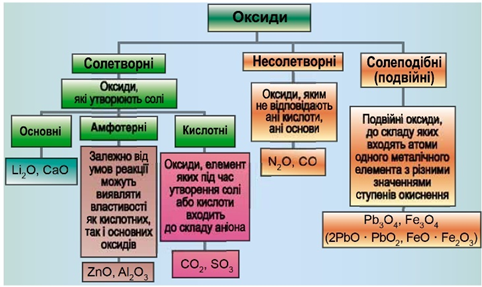
Рис. 1. Класифікація оксидів
Ферум(ІІ) оксид – основний. Карбон(IV) оксид і нітроген(V) оксид – кислотні. Цинк оксид – амфотерний.
Відповідь: A.
ТЕМА: Кислотні оксиди. Кислоти.
Завдання скеровано на перевірку розуміння поняття «кислотні дощі» й хімізму їхнього утворення.
Кислотні опади утворюються внаслідок гідратації кислотних оксидів, які містяться в повітрі:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
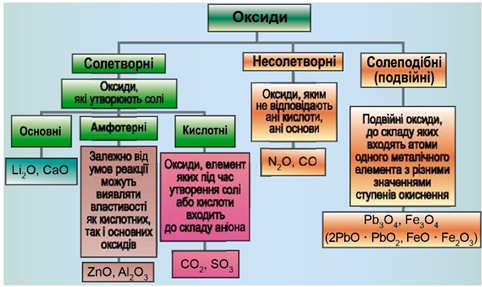
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg – Ra}\) ); - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Ферум(ІІ) оксид є осно́вним, нітроген(І) оксид – несолетворний, нітроген(IV) оксид – кислотний, ферум(ІІІ) оксид – амфотерний.
Відповідь: B.
ТЕМА: Кислотні оксиди. Кислоти. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між неорганічними сполуками, установлювати генетичні зв’язки між ними.
Сульфатну кислоти можна добути реакцією сульфур(VІ) оксиду з водою:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
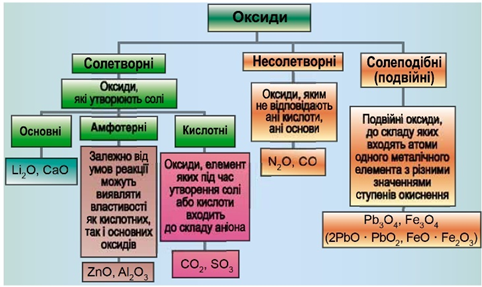
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише сульфур(ІV) оксид є кислотними, реагує з водою з утворенням сульфітної кислоти:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
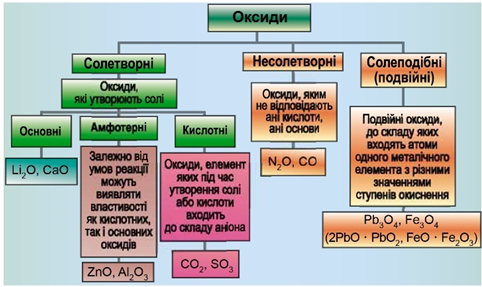
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Кальцій оксид реагує з водою з утворенням лугу – кальцій гідроксиду:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
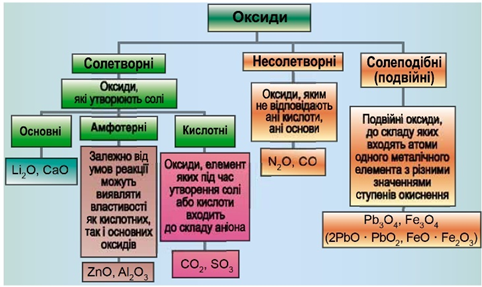
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише літій оксид реагує з водою з утворенням лугу – літій гідроксиду:
Відповідь: A.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння характеризувати хімічний елемент за його місцем у періодичній системі.
Елемент № 25 – Манган – міститься в VII Б групі періодичної системи. Формула його вищого оксиду
Відповідь: 9.
ТЕМА: Неорганічні речовини. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду.
Карбон(ІV) оксид є кислотним, тому реагує з натрій гідроксидом (лугом):
Відповідь: A.
ТЕМА: Неорганічна хімія. Сульфур(ІV) оксид.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі сульфур(ІV) оксиду.
Сульфур(ІV) оксиду відповідає двохосновна сульфітна кислота, яка може утворювати як середні солі (сульфіти), так і кислі – гідрогенсульфіти. За мольного співвідношення сульфур(ІV) оксиду й натрій гідроксиду 1 : 1 хімічна реакція між ними відбувається за рівнянням:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
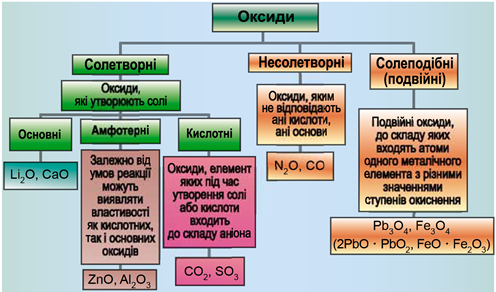
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж наведених пар оксидів умову завдання задовольняють основний кальцій оксид і кислотний силіцій(IV) оксид, які за стоплення утворюють кальцій силікат:
Решта з-поміж наведених оксидів є вищими кислотними, тому не реагують між собою.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку знання складу мінералів і їхніх назв.
1
2
3
4
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
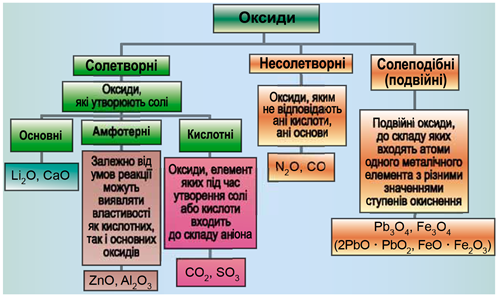
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
З-поміж поданих пар оксидів реакція відбувається між осно́вним кальцій оксидом і кислотним фосфор(V) оксидом:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й класифікувати неорганічні речовини за їхнім складом і властивостями (рис. 1, 2).
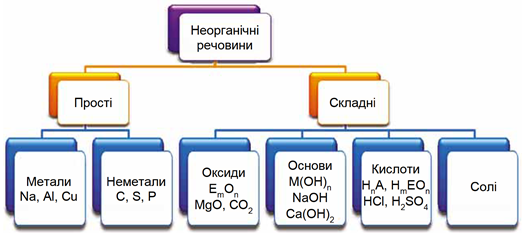
Рис. 1. Класифікація неорганічних речовин за складом. У наведених на схемі загальних формулах Е – елемент, М – металічний елемент, А – неметалічний елемент VI або VII групи періодичної системи хімічних елементів
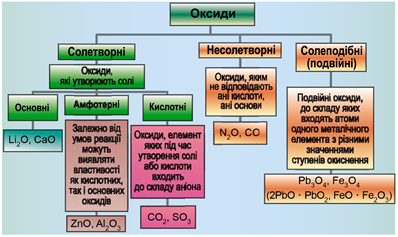
Рис. 2. Рис. 2. Класифікація оксидів
| 1 | несолетворний оксид | B | |
| 2 | кислота | Г | |
| 3 | кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти на атоми металічного елемента | Д | |
| 4 | кислотний оксид | Б |
Відповідь: 1B, 2Г, 3Д, 4Б.
ТЕМА: Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі хлоридної кислоти.
Хлоридна кислота є сильною леткою кислотою, тому реагує з амфотерним купрум(ІІ) оксидом (2), натрій силікатом (3) як сіллю слабкої кислоти, цинком (5) як металом, розташованим у ряду активності металів до водню (рис. 1).

Хлоридна кислота не реагує з міддю як металом, розташованим у ряду активності металів після водню, силіцій(IV) оксидом як кислотним і натрій сульфатом як сіллю сильної нелеткої кислоти.
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні й несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
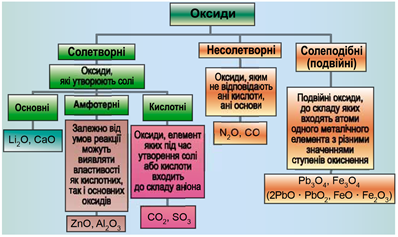
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють iз кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
A силіцій(IV) оксид – кислотний, тому реагує з натрій гідроксидом і не реагує з хлоридною кислотою
Б нітроген(І) оксид несолетворний, тому не реагує ні з натрій гідроксидом , ні з хлоридною кислотою
B магній оксид основний, тому реагує з хлоридною кислотою і не реагує з натрій гідроксидом
Г цинк оксид амфотерний, тому реагує як із натрій гідроксидом , так і з хлоридною кислотою
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні речовини різних класів.
Речовина (1) утворена катіонами Кальцію і карбонат-аніонами – кальцій карбонат, сіль (Г).
Речовина (2) містить атоми Гідрогену й кислотний залишок силікат – силікатна кислота (В).
Речовина (3) утворена катіонами Алюмінію і гідроксид-аніонами – амфотерний алюміній гідроксид (Д).
Речовина (4) – сульфур(IV) оксид, бінарна сполука Сульфуру й Оксигену, у молекулах якої ступінь окиснення атомів Оксигену становить –2 (А).
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
1 натрій гідрогенкарбонат – питна сода (Б)
2 силіцій(IV) оксид – кварцовий пісок (Д)
3 натрій хлорид – кам’яна сіль (А)
4 кальцій гідроксид – гашене вапно (Г)
Відповідь: 1Б, 2Д, 3А, 4Г.
ТЕМА: Неорганічні речовини. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки.
Сірка згоряє в кисні з утворенням сульфур(ІV) оксиду:
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду й кальцій гідроксиду, уміння прогнозувати продукти електролітичної дисоціації кальцій гідроксиду.
Головним складником негашеного вапна є кальцій оксид. Унаслідок його реакції з водою утворюється кальцій гідроксид:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
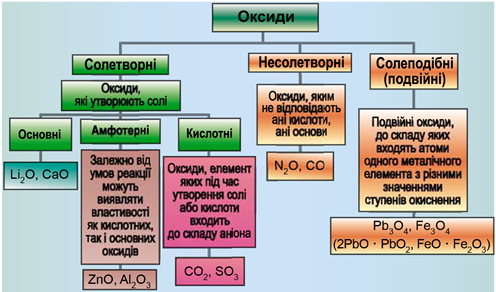
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише алюміній оксид не реагує з водою.
Нітроген(V) оксид і сульфур(ІV) оксид є кислотними, реагують із водою з утворенням нітратної та сульфітної кислот відповідно.
Натрій оксид як оксид лужного елемента реагує з водою. Продуктом реакції є луг – натрій гідроксид.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
Речовина (1) утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, і кислотним залишком сульфітної кислоти – сульфітна кислота (Б).
Речовина (2) утворена катіонами Магнію й ортофосфат-аніонами – сіль магній ортофосфат (Д).
Речовина (3) утворена катіонами Кальцію й гідроксид-аніонами – розчинна основа кальцій гідроксид (Г).
Речовина (4) утворена катіонами Кальцію й аніонами Оксигену – основний кальцій оксид (В).
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку знання тривіальних назв солей.
Гіпс (1) –
Алебастр (2) –
Негашене вапно (3) –
Кальцинована сода (4) –
Відповідь: 1В, 2А, 3Д, 4Г.
ТЕМА: Неорганічні речовини. Карбон(IV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(IV) оксиду.
Карбон(IV) оксид добувають дією кислот на карбонати:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про способи добування лугів.
Із-поміж оксидів, яким відповідають основи, формули яких наведено в умові завдання, до активних належить лише барій оксид. Йому відповідає луг – барій гідроксид. Одним зі способів добування лугів є взаємодія оксидів лужних (І А група) і лужноземельних (ІІ А група, починаючи від кальцію) елементів із водою, зокрема барій оксид реагує з нею з утворенням барій гідроксиду:
Відповідь: A.
ТЕМА: Класифікація неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми хімічними формулами.
| 1 | середня сіль | Г | |
| 2 | кисла сіль | Д | |
| 3 | осно́вний оксид | B | |
| 4 | кислотний оксид | Б |
Відповідь: 1Г, 2Д, 3В, 4Б.
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(ІV) оксиду.
Карбон(ІV) оксид добувають дією кислот, сильніших за карбонатну, на її солі:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати представників різних класів неорганічних сполук.
| 1 | барій сульфіт |
A |
| 2 | боратна кислота |
Г |
| 3 | амоній гідрогенкарбонат |
Д |
| 4 | кальцій оксид |
Б |
Відповідь: 1А, 2Г, 3Д, 4Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
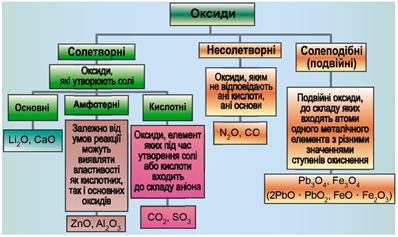
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Літій оксид – основний, цинк оксид – амфотерний, карбон(IV) оксид – кислотний.
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання хімічних властивостей гідрогенкарбонатів.
Питна сода – тривіальна назва натрій гідрогенкарбонату – кислої солі слабкої нестійкої карбонатної кислоти. Оцтова (етанова) кислота витісняє слабшу карбонатну з її солі, нестійка карбонатна кислота розкладається на карбон(IV) оксид і воду:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація оксидів.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Несолетворними називають оксиди, які не взаємодіють ні з кислотами, ні з основами і солей не утворюють. До таких належить нітроген(ІІ) оксид
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
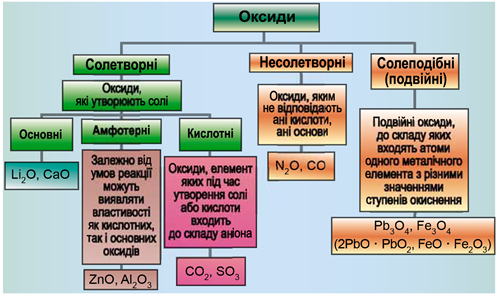
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
З-поміж оксидів, формули яких наведено в завданні, лише основний магній оксид реагує з хлоридною кислотою і не реагує з натрій гідроксидом.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі неорганічних речовин різних класів.
З-поміж речовин, назви яких наведено в завданні, потрібно вибрати ту, яка реагує з карбон(IV) оксидом і не реагує з киснем. Цим умовам відповідає натрій гідроксид:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
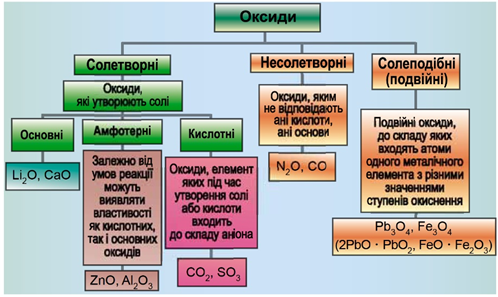
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості. Цинк оксид й алюміній оксид – амфотерні.
Магній оксид – основний, алюміній оксид – амфотерний, хлор(VІІ) оксид – кислотний.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид. Парниковий ефект.
Завдання скеровано на перевірку знання причин виникнення парникового ефекту.
Парниковий ефект – нагрівання внутрішніх шарів атмосфери. Парниковий ефект підвищує середню температуру планети, зм’якшує розходження між денними й нічними температурами. Посилення парникового ефекту може призвести до глобальних змін клімату Землі. Парникові гази поглинають теплове випромінювання поверхні Землі та хмар і відбивають його назад до Землі. Найбільше впливають на зміну клімату вуглекислий газ (карбон(IV) оксид
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи. Магній. Сполуки Магнію.
Завдання скеровано на перевірку вміння класифікувати оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні оксиди.
Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рисунку 1.
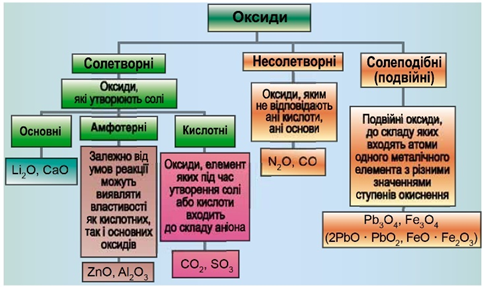
Рис. 1. Класифікація оксидів
Магній – типовий металічний елемент, його оксид
Відповідь: Б.
ТЕМА: Органічна й неорганічна хімія. Властивості, фізіологічна дія, застосування органічних і неорганічних речовин.
Завдання скеровано на перевірку знання властивостей, фізіологічної дії, застосування органічних і неорганічних речовин.
| Речовина | |||
| Характеристика | Назва | ||
| 1 | Речовина – солодка на смак, «виноградний цукор» | Глюкоза | Д |
| 2 | Тугоплавка речовина, під час її взаємодії з водою виділяється велика кількість теплоти | Кальцій оксид | A |
| 3 | Речовина – сильний антисептик, «карболова кислота» | Фенол | Б |
| 4 | Речовина жовтого кольору, яку використовують у виробництві сірників | Сірка | B |
Відповідь: 1Д, 2А, 3Б, 4В.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів. Кислотні опади руйнують, зокрема, мармур, головний складник якого –кальцій карбонат.
Серед наведених варіантів відповіді умову завдання задовольняє сульфур(ІV) оксид:
Відповідь: B.
ТЕМА: Неорганічна хімія. Металічні елементи. Оксиди металічних елементів.
Завдання скеровано на перевірку знання зміни хімічних властивостей оксидів залежно від місця відповідних хімічних елементів у періодичній системі.
Металічні властивості хімічних елементів у групах збільшуються зі збільшенням їхніх протонних чисел. Так само зростає активність їхніх оксидів у реакції з водою.
Відповідь: В А Г Б.
ТЕМА: Органічна й неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні й органічні речовини за будовою їхніх молекул.
| Речовина | ||||
| Назва | Формула | Модель молекули | ||
| 1 | Метиловий спирт | 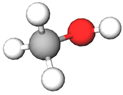 |
Д | |
| 2 | Етилен | 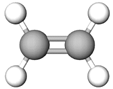 |
B | |
| 3 | Вода | 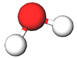 |
Б | |
| 4 | Оцтова кислота | 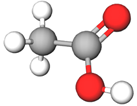 |
Г | |
Відповідь: 1Д, 2В, 3Б, 4Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Д | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | одноосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | B |
Відповідь: 1Д, 2А, 3Б, 4В.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів.
Серед наведених варіантів відповіді умову завдання задовольняють сульфур(ІV) оксид і нітроген(ІV) оксид:
Відповідь: B.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(IV) оксиду.
Карбон(IV) оксид добувають дією хлоридної кислоти на мармур, головним складником якого є кальцій карбонат:
Відповідь: Б.
ТЕМА: Властивості і фізіологічна дія неорганічних й органічних речовин.
Завдання скеровано на перевірку знання фізіологічної дії деяких неорганічних й органічних речовин.
Кальцій оксид – їдка речовина, взаємодіє з вологою шкіри й слизових із утворенням їдкого лугу – кальцій гідроксиду. Тому кальцій оксид спричиняє хімічний опік шкіри.
Відповідь: B.
ТЕМА: Неорганічна хімія. Металічні елементи. Сполуки Кальцію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук металічних елементів.
Негашене вапно – тривіальна назва кальцій оксиду
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди, кислоти, генетичні зв’язки між ними.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між кислотними оксидами й кислотами.
Нітратній кислоті
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Класифікація оксидів.
Завдання скеровано на перевірку вміння розпізнавати кислотні оксиди.
Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рисунку 1.
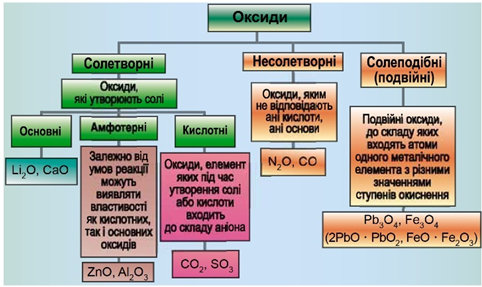
Рис. 1. Класифікація оксидів
Кислотними оксидами є більшість оксидів неметалічних елементів
Відповідь: A.
ТЕМА: Неорганічна хімія. Тривіальні назви неорганічних речовин.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
| Назва речовини | Хімічна формула | |||
| тривіальна | систематична | |||
| 1 | негашене вапно | кальцій оксид | B | |
| 2 | поташ | калій карбонат | Д | |
| 3 | гіпс | кальцій сульфат дигідрат | Г | |
| 4 | сухий лід | карбон(VІ) оксид | Б | |
Відповідь: 1В, 2Д, 3Г, 4Б.
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду й уміння прогнозувати можливість перебігу реакцій за його участі.
Карбон(ІV) оксид є кислотним, йому відповідає слабка карбонатна кислота. Як кислотний оксид він реагує з лугами (гідроксидами Натрію і Барію) та з основним калій оксидом.
З іншим кислотним силіцій(ІV) оксидом карбон(ІV) оксид не реагує.
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
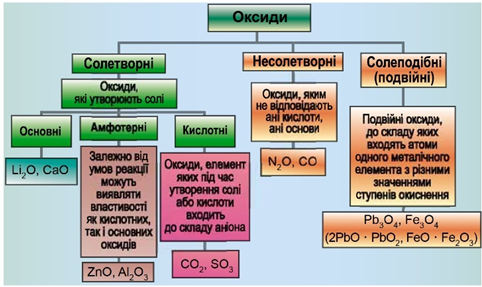
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg – Ra}\) ); - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише сульфур(VІ) оксид є кислотними, реагує з водою з утворенням сульфатної кислоти:
Відповідь: A.




