Розділ: Основні класи неорганічних сполук
Тема: Основи
Кількість завдань: 76
ТЕМА: Реакції металів із кислотами й солей із лугами. Осадження гідроксидів.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів із кислотами, солей із лугами у водних розчинах.
1.
Залишок на фільтрі – магній гідроксид – гідроксид металічного елемента (А).
2.
Залишок на фільтрі – мідь – метал (Б).
3.
Залишок на фільтрі – мідь і магній гідроксид – метал і гідроксид металічного елемента (В).
Відповідь: 1А; 2Б; 3В.
ТЕМА: Реакції між солями, кислотами й основами.
Завдання скеровано на перевірку знання типових реакцій кислот із солями, уміння аналізувати послідовність хімічних перетворень.
Умові завдання відповідає лише варіант В:
Відповідь: B.
ТЕМА: Хімічні властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння за хімічною формулою визначати тип кристалічних ґраток речовини й прогнозувати її хімічні властивості.
| Варіант відповіді | 1 | 2 | 3 |
| А | |||
| Б | |||
| B | |||
| Г |
Натрій гідроксид
Відповідь: Г.
ТЕМА: Кислоти й основи. Значення
Завдання скеровано на перевірку вміння прогнозувати
| Варіант | Речовини | Продукт розчинення у воді речовини або продукту реакції речовини з водою | |
| А | |||
| Б | |||
| B | |||
| Г | |||
Відповідь: Г.
ТЕМА: Властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участю неорганічних сполук різних класів.
| Варіант відповіді | Схема реакції | Оцінка можливості перебігу реакції |
| А | Мідь не реагує з водою | |
| Б | Нерозчинні основи термічно нестійкі й із часом і/або внаслідок нагрівання розкладаються на оксид металічного елемента й воду | |
| B | Основні й амфотерні гідроксиди реагують із кислотами. Продукти реакції – сіль і вода | |
| Г | Активніший метал цинк витісняє мідь із розчиненої у воді солі Купруму |
Відповідь: A.
ТЕМА: Кислоти. Основи. Реакція нейтралізації. Утворення солей.
Завдання скеровано на перевірку розуміння процесу нейтралізації між лугом (основою) і кислотою, уміння визначати продукт реакції – сіль – залежно від складу реактантів, називати солі за систематичною номенклатурою.
| Варіант відповіді | Назва й формула солі | Сіль | Висновок |
| А | Алюміній хлорид |
Є продуктом реакції між нерозчинним гідроксидом і хлоридною кислотою | Неправильно |
| Б | Літій сульфат |
Є продуктом реакції між лугом і сульфатною кислотою |
Правильно |
| B | Купрум(ІІ) нітрат |
Є продуктом реакції між нерозчинним гідроксидом і нітратною кислотою | Неправильно |
| Г | Цинк етаноат |
Є продуктом реакції між нерозчинним гідроксидом й етановою кислотою | Неправильно |
Усі кислоти, про які йдеться в завданні, розчинні у воді. Лугом (розчинною основою) є лише літій гідроксид.
Відповідь: Б.
ТЕМА: Кислоти. Луги. Реакція нейтралізації. Кількісні відношення речовин у хімічних реакціях.
Завдання скеровано на перевірку розуміння процесу нейтралізації між кислотою та основою, уміння зіставляти відношення об’ємів розчинів із відношеннями кількостей речовини в них, застосовувати поняття pH як показника рівноваги між йонами
| Варіант відповіді | Запис | Аналіз запису | Висновок |
| А | Це означало б, що кількість йонів |
Неправильно | |
| Б | Маси кислоти й лугу можуть бути рівні, але це не є достатньою умовою рівності кількості йонів |
Неправильно | |
| B | Це і є умова повної нейтралізації, унаслідок якої |
Правильно | |
| Г | Рівність мас йонів не означає рівності їхньої кількості, бо молярні маси цих йонів різні | Неправильно |
Відповідь: B.
ТЕМА: Неорганічна хімія. Луги. Оксиди. Хімічні властивості натрій гідроксиду й фосфор(V) оксиду.
Завдання скеровано на перевірку знання властивостей лугів і кислотних оксидів, уміння прогнозувати й пояснювати спостереження.
Натрій гідроксид і фосфор(V) оксид – гігроскопічні речовини, тобто легко вбирають водяну пару з повітря. Фосфор(V) оксид реагує з водою з утворенням ортофосфатної кислоти. Тому маси посудин із обома речовинами збільшаться.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Оксиди. Луги.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів лужних елементів.
Продуктом реакції калій оксиду з водою є калій гідроксид – луг.
Відповідь: A.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Як натрій, так і кальцій є активними металами, реагують iз водою з утворенням відповідного гідроксиду й виділенням газуватого водню. Обидві реакції є екзотермічними, унаслідок їхнього перебігу змінюються ступені окиснення хімічних елементів:
Однак кальцій гідроксид на відміну від натрій гідроксиду є малорозчинним (рис. 1).
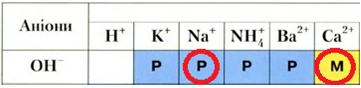
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Б.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Алюміній і залізо.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу хімічних реакцій між неорганічними речовинами.
Твердження Г є неправильним, бо алюміній оксид – малоактивна речовина. Алюміній гідроксид добувають реакцією обміну між солями Алюмінію і лугами в розчині.
Інші наведені в умові завдання твердження правильні:
A |
|
Б |
|
B |
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі неорганічних речовин, класифікувати хімічні реакції за різними ознаками.
Натрій бурхливо реагує з водою з виділенням великої кількості теплоти й утворенням водню і натрій гідроксиду. Тобто ця реакція є екзотермічною:
Атоми Натрію віддають електрони з утворенням катіонів:
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення. Тому його можна використати, щоби дослідити середовище розчину, який утворився в посудині після реакції.
Для якісного виявлення водню – одного з продуктів реакції – використати вапняну воду не можна, бо реакція не відбувається. Вапняна вода – насичений розчин кальцій гідроксиду – є реактивом на вуглекислий газ – карбон(ІV) оксид.
Відповідь: A.
ТЕМА: Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку вміння порівнювати фізичні й хімічні властивості неметалів, оксидів неметалічних елементів.
Для виконання завдання необхідно знати якісну реакцію на карбон(ІV) оксид.
Реактивом на карбон(ІV) оксид, який належить до кислотних, є вапняна вода (насичений розчин кальцій гідроксиду). Карбон(ІV) оксид із вапняною водою утворює осад білого кольору (
Відповідь: B.
ТЕМА: Загальна хімія. Класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати формули неорганічних речовин різних класів.
| Оксигеновмісна органічна речовина | ||||
| Клас неорганічних сполук | Формула | |||
| 1 | сіль | складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Б | |
| 2 | оксид | бінарна сполука з Оксигеном, ступінь окиснення якого –2 | Д | |
| 3 | основа | складна речовина, утворена катіонами металічного елемента й гідроксид-аніонами | B | |
| 4 | кислота | складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами кислотного залишку | Г | |
Відповідь: 1Б, 2Д, 3В, 4Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати хімічні формули основ.
Усі речовини, формули яких наведено, утворені катіонами металічних елементів й гідроксид-аніонами. Ці речовини – основи.
Наведено формули калій гідроксиду, ферум(ІІ) гідроксиду та кальцій гідроксиду.
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку знання умов незворотності реакцій між електролітами у водних розчинах, способів добування нерозчинних основ, уміння встановлювати генетичні зв’язки між неорганічними речовинами.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
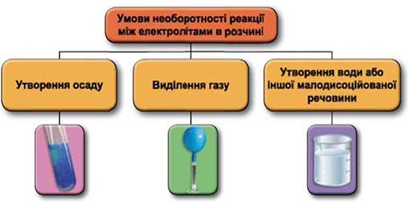
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція між купрум(ІІ) хлоридом і калій гідроксидом у водному розчині:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду, тривіальних назв сполук Кальцію.
У завданні йдеться про основний оксид, що бурхливо реагує з водою. Умову завдання задовольняє кальцій оксид – негашене вапно, продуктом гідратації (реакції з водою) якого є кальцій гідроксид – гашене вапно.
Відповідь: A.
ТЕМА: Неорганічна хімія. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання застосування сполук Кальцію.
Вапняне молоко, суспензія гашеного вапна
Відповідь: Г.
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Речовиною
є кислотний карбон(IV) оксид:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
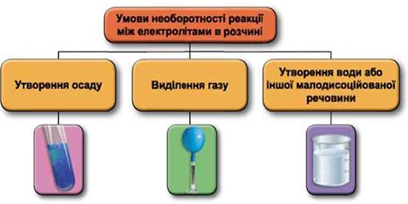
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: Б.
ТЕМА: Властивості і фізіологічна дія неорганічних й органічних речовин.
Завдання скеровано на перевірку знання фізіологічної дії деяких неорганічних й органічних речовин.
Літій гідроксид – луг, їдка речовина, спричиняє хімічний опік шкіри.
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати луги.
Луги – розчинні основи. До лугів відносять гідроксиди лужних елементів і, попри малу розчинність у воді, кальцій гідроксид

Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Основи. Хімічні властивості, способи добування основ.
Завдання перевіряє знання хімічних властивостей і способів добування основ.
Основний оксид взаємодіє з водою з утворенням відповідного гідроксиду за умови, якщо такий гідроксид розчиняється у воді. Із запропонованих оксидів лише кальцій оксиду відповідає розчинний гідроксид.
Відповідь: Г.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Загальні відомості про металічні елементи та метали. Основи.
Завдання перевіряє здатність з опису хімічного досліду зрозуміти тип хімічної реакції, фізичних і хімічних властивостей лужноземельних елементів.
Лужноземельні елементи активно реагують з водою, тому реакція є екзотермічною. Унаслідок взаємодії лужноземельних елементів з водою утворюється основа (кальцій гідроксид – малорозчинна у воді основа) і водень. Тому з наведених тверджень правильними є лише І і ІV.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє знання хімічних властивостей основних класів неорганічних сполук.
Для виконання завдання необхідно знати хімічні властивості основних класів неорганічних сполук.
I твердження правильне , тому що калій гідроксид – це розчинна у воді основа (луг), а луги взаємодіють з кислотами й кислотними оксидами.
II твердження неправильне , тому що оксид та гідроксид Калію – це сполуки металічного елемента, які в реакціях виявляють властивості основного оксиду й основи відповідно.
Отже, правильним є лише I твердження.
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад, будову й загальні властивості лугів для прогнозування властивостей представників цієї групи неорганічних сполук.
Калій гідроксид – добре розчинна у воді речовина йонної будови, термічно стійка, тому як його водний розчин, так і розплав проводить електричний струм. Є продуктом реакції калію з водою:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі. Добування солей.
Завдання перевіряє розуміння утворення середніх і кислих солей залежно від мольного співвідношення речовин у реакціях між лугами і багатоосновними кислотами.
Для виконання завдання необхідно зіставити певні кількості речовин кислот і лугів. Ортофосфатна кислота трьохосновна, тому для утворення середньої солі при взаємодії з натрій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:3. Такого співвідношення немає. Сульфатна кислота двохосновна, тому для утворення середньої солі при взаємодії з калій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:2. Таке співвідношення наведено у варіанті Г.
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Основи. Хімічні властивості, способи добування основ.
Завдання перевіряє знання хімічних властивостей і способів добування основ.
Купрум(ІІ) гідроксид – нерозчинна у воді основа (див. таблицю розчинності в тестовому зошиті), яка за нагрівання легко розкладається (властивість нерозчинних основ), і яку добувають реакцією обміну між розчинною сіллю й лугом. Тому з наведених варіантів відповіді правильний лише Б.
Відповідь: Б.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основи. Лужні та лужноземельні метали.
Завдання перевіряє розуміння з опису досліду типів хімічних реакцій, дії лугів на індикатор, фізичних і хімічних властивостей лужних металів.
Речення «Він плавиться, перетворюючись на кульку, яка швидко рухається поверхнею води» говорить про те, що реакція є екзотермічною. Натрій – лужний метал, а лужні метали з водою утворюють луг і при цьому виділяється водень. Про утворення лугу свідчить те, що розчин поступово набуває малинового кольору. Отже, із наведених тверджень правильними є І і ІV.
Відповідь: Б.
ТЕМА: Основні поняття і закони хімії. Закон збереження маси речовин. хімічні рівняння.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовини для записування хімічних рівнянь.
Сума коефіцієнтів у хімічному рівнянні –
Відповідь: 12.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги й нерозчинні основи.
Завдання скеровано на перевірку знання хімічних властивостей лугів і нерозчинних основ.
Нерозчинні основи за нагрівання розкладаються на відповідний оксид і воду.
Луги реагують із солями у водних розчинах, якщо хоча б один з продуктів реакції обміну між ними – основа чи сіль – є нерозчинним.
Відповідь: 3Б, 4А.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі деяких йонів.
Скорочені йонні рівняння реакцій, про які йдеться в завданні, такі:
Відповідь: 1Г, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Суміші. Розчини. Розчинність речовин.
Завдання скеровано на перевірку вміння порівнювати розчинність речовин.
Целюлоза – біополімер, у воді не розчиняється.
Ацетилен – малорозчинний у воді газ.
Кальцій сульфат – малорозчинна речовина, а барій гідроксид – луг, який добре розчиняється у воді. Про це можна дізнатися з таблиці «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С».
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Нерозчинні основи.
Завдання скеровано на перевірку знання складу та властивостей нерозчинних основ.
Нерозчинні основи за нагрівання розкладаються на оксид металічного елемента й воду. Прикладом є термічне розкладання ферум(ІІІ) гідроксиду.
Відповідь: Б.
ТЕМА: Обчислення в хімії. Загальна хімія. Закон збереження маси речовин у хімічних реакціях. Хімічні рівняння.
Завдання скеровано на перевірку вміння складати хімічні рівняння.
У хімічному рівнянні
сума коефіцієнтів становить
Відповідь: 12.
ТЕМА: Неорганічна хімія. Назви неорганічних сполук.
Завдання скеровано на перевірку вміння називати неорганічні речовини за систематичною номенклатурою.
| Речовина | |||
| Формула | Назва | ||
| 1 | хлоридна кислота | Б | |
| 2 | ортофосфатна кислота | Г | |
| 3 | кальцій оксид | A | |
| 4 | фосфор(V) оксид | B | |
Відповідь: 1Б, 2Г, 3А, 4В.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати рівняння електролітичної дисоціації.
| Речовина | |||
| Назва | Рівняння електролітичної дисоціації | ||
| 1 | нітратна кислота | A | |
| 2 | алюміній сульфат | Г | |
| 3 | барій хлорид | Б | |
| 4 | калій гідроксид | B | |
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Генетичні зв’язки між неорганічними сполуками різних класів. Лужні метали.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій лужних металів із водою.
Натрій – лужний елемент. Натрій реагує з водою з утворенням натрій гідроксиду – лугу – і виділенням водню:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння розпізнавати формули лугів.
Луги – розчинні основи, містять катіони лужного чи лужноземельного елемента й гідроксид-аніони. Умову завдання задовольняє натрій гідроксид
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Електролітична дисоціація лугів.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування продуктів електролітичної дисоціації лугів.
Унаслідок дисоціації у водному розчині натрій гідроксиду утворюються катіони Натрію і гідроксид-аніони:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди, основи, кислоти, солі.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів, основ, кислот, солей.
| Клас неорганічних сполук | Визначення | Речовина | |||
| Формула | Назва | ||||
| 1 | кислоти | Складні речовини, утворені атомами Гідрогену, сполученими з кислотними залишками. Валентність кислотного залишку дорівнює кількості атомів Гідрогену в молекулі кислоти | сульфатна кислота | B | |
| 2 | оксиди | Складні речовини, утворені двома елементами, одним із яких є Оксиген у ступені окиснення –2 | сульфур(VI) оксид | Д | |
| 3 | основи | Складні речовини, утворені катіонами металічних елементів й аніонами гідроксильних груп. Кількість гідроксильних груп у формулі основи дорівнює ступеню окиснення металічного елемента в ній | кальцій гідроксид | A | |
| 4 | солі | Складні речовини, йонні сполуки. Середні солі утворені катіонами металічних елементів або/та амонію й аніонами кислотних залишків | кальцій сульфат | Б | |
Відповідь: 1В; 2Д; 3А; 4Б.
ТЕМА: Класифікація основ. Луги.
Завдання скеровано на перевірку знання класифікації основ за розчинністю.
Луги – розчинні основи (рис. 1). З-поміж сполук, формули яких наведено, умову завдання задовольняє барій гідроксид.
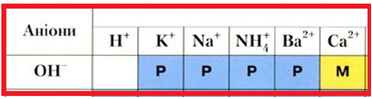
Рис. 1. Луги – розчинні основи
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Луги.
Завдання скеровано на перевірку знання будови й хімічних властивостей лугів.
Натрій гідроксид – луг, йонна речовина, сильний електроліт, у водному розчині дисоціює з утворенням катіонів Натрію і гідроксид-аніонів.
Тобто правильними щодо цієї речовини є твердження:
2 взаємодіє з кислотними оксидами
4 у його водному розчині фенолфталеїн набуває малинового кольору
Відповідь: Г.
ТЕМА: Загальні відомості про металічні елементи й метали. Алюміній, сполуки Алюмінію.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, сполук Алюмінію.
I Алюміній належить до p-елементів, в його атомі заповнюється електронами p-підрівень:
II Алюміній гідроксид за нагрівання розкладається:
III У йона
IV Для добування водню в лабораторії можна використати алюміній і хлоридну кислоту:
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад, будову й загальні властивості лугів для прогнозування властивостей представників цієї групи неорганічних сполук.
Калій гідроксид – добре розчинна у воді речовина йонної будови, сильний електроліт, у водному розчині дисоціює з утворенням гідроксид-аніонів, які зумовлюють зміну забарвлення фенолфталеїну на малиновий, утворюється внаслідок взаємодії металу з водою:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад, будову й загальні властивості лугів для прогнозування властивостей представників цієї групи неорганічних сполук.
Натрій гідроксид – добре розчинна у воді речовина йонної будови, термічно стійка, його розплав проводить електричний струм, не взаємодіє з амоніаком.
Відповідь: A.
ТЕМА: Неорганічні речовини. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду.
Карбон(ІV) оксид є кислотним, тому реагує з натрій гідроксидом (лугом):
Відповідь: A.
ТЕМА: Неорганічна хімія. Сульфур(ІV) оксид.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі сульфур(ІV) оксиду.
Сульфур(ІV) оксиду відповідає двохосновна сульфітна кислота, яка може утворювати як середні солі (сульфіти), так і кислі – гідрогенсульфіти. За мольного співвідношення сульфур(ІV) оксиду й натрій гідроксиду 1 : 1 хімічна реакція між ними відбувається за рівнянням:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Гідроксиди.
Завдання скеровано на перевірку вміння розпізнавати властивості кальцій гідроксиду.
Кальцій гідроксид – речовина білого кольору, малорозчинна у воді. У водному розчині дисоціює на катіони Кальцію і гідроксид-аніони. Тому під дією гідроксид-аніонів у водному розчині кальцій гідроксиду фенолфталеїн набуває малинового кольору.
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання властивостей лугів.
Натрій гідроксид – луг (розчинна основа). Це – електроліт, який у водному розчині дисоціює на катіони Натрію і гідроксид-аніони:
Під дією гідроксид-аніонів у водному розчині фенолфталеїн набуває малинового кольору.
Натрій гідроксид реагує з кислотними оксидами.
Натрій гідроксид – речовина йонної будови.
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння розпізнавати луги за їхніми хімічними формулами, застосовувати знання про способи добування лугів.
Із-поміж металів, яким відповідають основи, формули яких наведено в умові завдання, до активних належить лише кальцій. Йому відповідає луг – кальцій гідроксид. Одним зі способів добування лугів є взаємодія лужних і лужноземельних металів із водою, зокрема кальцій реагує з нею з утворенням кальцій гідроксиду й виділенням водню:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні й несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
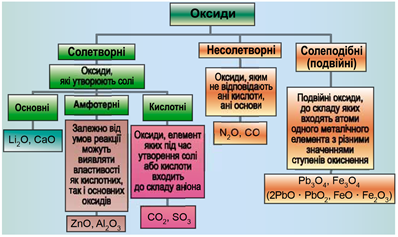
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють iз кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
A силіцій(IV) оксид – кислотний, тому реагує з натрій гідроксидом і не реагує з хлоридною кислотою
Б нітроген(І) оксид несолетворний, тому не реагує ні з натрій гідроксидом , ні з хлоридною кислотою
B магній оксид основний, тому реагує з хлоридною кислотою і не реагує з натрій гідроксидом
Г цинк оксид амфотерний, тому реагує як із натрій гідроксидом , так і з хлоридною кислотою
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
1 натрій гідрогенкарбонат – питна сода (Б)
2 силіцій(IV) оксид – кварцовий пісок (Д)
3 натрій хлорид – кам’яна сіль (А)
4 кальцій гідроксид – гашене вапно (Г)
Відповідь: 1Б, 2Д, 3А, 4Г.
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду й кальцій гідроксиду, уміння прогнозувати продукти електролітичної дисоціації кальцій гідроксиду.
Головним складником негашеного вапна є кальцій оксид. Унаслідок його реакції з водою утворюється кальцій гідроксид:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Основи. Способи добування нерозчинних основ.
Завдання скеровано на перевірку знання способів добування нерозчинних основ.
Нерозчинні основи добувають реакцією обміну між сіллю і лугом у водному розчині:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
Речовина (1) утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, і кислотним залишком сульфітної кислоти – сульфітна кислота (Б).
Речовина (2) утворена катіонами Магнію й ортофосфат-аніонами – сіль магній ортофосфат (Д).
Речовина (3) утворена катіонами Кальцію й гідроксид-аніонами – розчинна основа кальцій гідроксид (Г).
Речовина (4) утворена катіонами Кальцію й аніонами Оксигену – основний кальцій оксид (В).
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Неорганічні речовини. Хімічні властивості ферум(ІІІ) гідроксиду.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі сполук Феруму(ІІІ).
Ферум(ІІІ) гідроксид – нерозчинна основа, унаслідок його термічного розкладання утворюються ферум(ІІІ) оксид і вода:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про способи добування лугів.
Із-поміж гідроксидів, формули яких наведено в умові завдання, до активних належить лише кальцій гідроксид. Одним зі способів добування лугів є взаємодія лужних і лужноземельних металів із водою, зокрема кальцій реагує з нею з утворенням кальцій гідроксиду:
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Луги й нерозчинні основи.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості нерозчинних основ і лугів.
І. За нагрівання нерозчинні основи розкладаються з утворенням оксиду металічного елемента й води:
ІI. Взаємодія активних металів з водою – один зі способів добування лугів:
ІII. У розчинах лугів індикатори змінюють своє забарвлення. У розчинах лугів фенолфталеїн набуває малинового забарвлення, він є специфічним індикатором лужного середовища:
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Способи добування нерозчинних основ.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
Нерозчинні основи добувають реакціями обміну між лугом і сіллю в розчині:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Ферум(ІІІ) гідроксид.
Завдання скеровано на перевірку знання властивостей ферум(ІІІ) гідроксиду.
Продуктами розкладання ферум(ІІІ) гідроксиду є ферум(ІІІ) оксид і вода:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Основи. Луги. Амфотерні гідроксиди.
Завдання скеровано на перевірку знання хімічних властивостей і способів добування амфотерних гідроксидів і лугів.
Цинк гідроксид – нерозчинна речовина, його можна добути реакцією обміну між сіллю Цинку й лугом у водному розчині:
Калій гідроксид – луг, у водному розчині дисоціює з утворенням гідроксид-аніонів, під дією яких фенолфталеїн набуває малинового забарвлення:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Нерозчинні основи.
Завдання скеровано на перевірку знання властивостей нерозчинних основ.
Купрум(ІІ) гідроксид – нерозчинна основа, неелектроліт, стійкий до дії окисників, бо Купрум у ньому має максимальний ступінь окиснення.
За нагрівання купрум(ІІ) гідроксид розкладається на купрум(ІІ) оксид і воду:
Купрум(ІІ) гідроксид реагує з хлоридною кислотою з утворенням купрум(ІІ) хлориду й води:
Відповідь: A.
ТЕМА: Неорганічна хімія. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі неорганічних речовин різних класів.
З-поміж речовин, назви яких наведено в завданні, потрібно вибрати ту, яка реагує з карбон(IV) оксидом і не реагує з киснем. Цим умовам відповідає натрій гідроксид:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання способів добування лугів, уміння розрізняти луги за їхніми хімічними формулами.
Фенолфталеїн – специфічний індикатор лужного середовища, під дією гідроксид-аніонів у водному розчині він набуває малинового забарвлення.
Унаслідок розчинення барій оксиду у воді відбувається хімічна реакція, продуктом якої є луг – барій гідроксид:
У водному розчині барій гідроксид дисоціює на катіони Барію і гідроксид-аніони:
Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Неорганічні основи.
Завдання скеровано на перевірку знання властивостей нерозчинних основ.
Нерозчинні основи за нагрівання розкладаються на оксид металічного елемента й воду.
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції між неорганічними сполуками.
Хімічна реакція між калій гідроксидом і нітратною кислотою – це реакція між двома складними речовинами – лугом і кислотою – з утворенням двох складних речовин – солі й води:
Відповідь: A.
ТЕМА: Неорганічна хімія. Органічна хімія. Фізіологічна дія деяких неорганічних й органічних речовин.
Завдання скеровано на перевірку знання фізіологічної дії деяких неорганічних й органічних речовин.
Умову завдання задовольняє натрій гідроксид – їдка речовина – складник засобу для прочищення каналізаційних труб.
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Д | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | одноосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | B |
Відповідь: 1Д, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Нерозчинні основи.
Завдання скеровано на перевірку знання нерозчинних основ.
Купрум(ІІ) гідроксид є нерозчинною основою, розкладається за нагрівання і реагує з хлоридною кислотою з утворенням солі та води:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Луги. Індикатори. Реакція нейтралізації.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації та знання кольорів індикаторів у різних середовищах – лужному, кислому, нейтральному.
У водному розчині калій гідроксиду є гідроксид-аніони, під дією яких фенолфталеїн набуває малинового кольору. Унаслідок поступового додавання хлоридної кислоти відбувається реакція нейтралізації, гідроксид-аніони реагують із катіонами Гідрогену:
Тому учень, який до розбавленого водного розчину калій гідроксиду, підфарбованого фенолфталеїном, поступово добавлятиме хлоридну кислоту, спостерігатиме знебарвлення розчину.
Відповідь: Г.
ТЕМА: Реакції йонного обміну. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
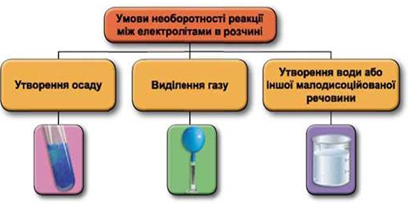
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують натрій сульфат і барій гідроксид, унаслідок цього утворюється осад барій сульфату й розчин натрій гідроксиду:
Відповідь: A.
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду й уміння прогнозувати можливість перебігу реакцій за його участі.
Карбон(ІV) оксид є кислотним, йому відповідає слабка карбонатна кислота. Як кислотний оксид він реагує з лугами (гідроксидами Натрію і Барію) та з основним калій оксидом.
З іншим кислотним силіцій(ІV) оксидом карбон(ІV) оксид не реагує.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Основи.
Завдання скеровано на перевірку знання хімічних властивостей нерозчинних основ.
Продуктами термічного розкладання нерозчинних основ є відповідний оксид і вода:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання властивостей лугів.
1) калій гідроксид добре розчиняється у воді, це луг – розчинна основа;
2) луги стійкі до окиснення;
3) калій гідроксид реагує з кислотними оксидами, зокрема сульфур(IV) оксидом:
4) калій гідроксид – сильний електроліт, який у водному розчині дисоціює на катіони Калію і гідроксид-аніони:
Відповідь: Г.




