Розділ: Будова атома і періодична система хімічних елементів
Тема: Періодичний закон і періодична система хімічних елементів
Кількість завдань: 25
ТЕМА: Періодична система хімічних елементів. Метали і неметали.
Завдання скеровано на перевірку знання ознак неметалів і їхнього місця в періодичній таблиці, уміння класифікувати хімічні елементи за їхніми фізико-хімічними властивостями.
У фрагменті таблиці наведено хімічні символи й зазначено відносні атомні маси десяти елементів. З-поміж них п’ять хімічних елементів належать до неметалічних: Бор, Карбон, Нітроген, Силіцій і Фосфор.
Такого висновку легко дійти, якщо взяти до уваги, що елементи побічних підгруп (у наведеному фрагменті таблиці це Скандій, Титан, Ванадій) є металічними. Алюміній – типовий металічний елемент, а в Галію металічні властивості виражені сильніше, ніж в Алюмінію, бо електрони зовнішнього енергетичного рівня розташовані на більшій відстані від ядра атома. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах – знизу догори.
Відповідь: Б.
ТЕМА: Метали й неметали. Загальні відомості про неметалічні елементи й неметали. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння виявляти причиново-наслідкові зв’язки між хімічною активністю простих речовин і поширеністю їх як форми існування хімічного елемента в природі.
Прості речовини – це речовини, які складаються з атомів одного хімічного елемента. Прості речовини Натрію, Фосфору, Флуору мають порівняно високу реакційну здатність.
Фтор – найактивніший із неметалів, реагує з більшістю простих і складних речовин.
Натрій – представник лужних металів, які вирізняються високою хімічною активністю – реагують із водою, киснем тощо.
Хімічний елемент Фосфор утворює кілька простих речовин. Білий фосфор здатний до самозаймання, червоний менш активний, але також реагує з багатьма речовинами. Тому в природі Фосфор поширений у формі складних речовин.
У природі Фосфор є складником різних сполук, як-от апатити, фосфорити, фосфоліпіди тощо.
Молекула азоту – простої речовини Нітрогену – дуже стійка, тому реакційна здатність азоту низька. Саме тому Нітроген поширений у природі у формі простої речовини – азоту
Відповідь: A.
ТЕМА: Загальна хімія. Місце хімічного елемента в періодичній системі. Найважливіші сполуки хімічного елемента – вищий оксид, гідрат вищого оксиду, летка сполука з Гідрогеном.
Завдання скеровано на перевірку вміння за місцем хімічного елемента в періодичній системі визначати формули його найважливіших сполук.
Хімічний елемент № 14 – Силіцій – міститься в IVА (14) групі періодичної системи. Відповідно формули його леткої сполуки з Гідрогеном і вищого оксиду зазначено в короткоперіодній формі періодичної системи:
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Умову завдання задовольняє пара елементів
Відповідь: B.
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Порядковий номер хімічного елемента в періодичній системі дорівнює його протонному числу й, відповідно, заряду ядра атома. У цьому полягає фізичний зміст порядкового номера хімічного елемента в періодичній системі.
Відповідь: B.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності й окиснювальних властивостей хімічних елементів у періодах і групах (рис. 1).
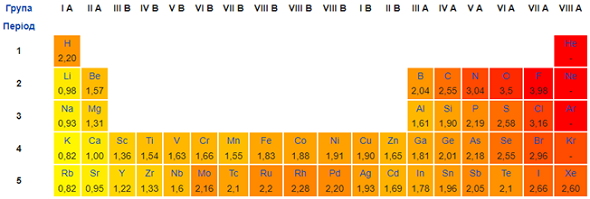
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: В А Г Б.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Сила кислот.
Завдання скеровано на перевірку розуміння закономірностей зміни сили кислот – водних розчинів гідроген галогенідів.
У підгрупі галогенів зі збільшенням протонного числа хімічних елементів збільшується ступінь дисоціації і, відповідно, сила кислот. Це зумовлено зменшенням електронегативності і збільшенням радіуса атомів галогенів, збільшенням довжини зв’язку
Відповідь: В А Г Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодах.
Завдання скеровано на перевірку розуміння закономірностей зміни властивостей хімічних елементів у періодах.
Бор, Карбон, Нітроген, Оксиген – елементи другого періоду. У періодах зі збільшенням протонних чисел посилюються неметалічні властивості хімічних елементів.
Відповідь: В, Б, А, Г.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння поняття «валентні електрони» й уміння визначати валентні можливості атомів.
Валентний електрон – електрон, що може утворювати хімічні зв’язки, в атомі, а отже, визначає поведінку атома в хімічних реакціях.
Електронна конфігурація атома Сульфуру
Електронна конфігурація атома Хрому
Сульфур і Хром – елементи різних періодів, у їхніх атомах різна кількість енергетичних рівнів і валентних орбіталей.
У бінарних сполуках із Гідрогеном Сульфур(ІІ) і Хром(ІІ) мають різні ступені окиснення:
Відповідь: Б.
ТЕМА: Метали.
Завдання скеровано на перевірку вміння порівнювати активність металів.
Для порівняння активності металів потрібно використати їхній ряд активності (рис. 1).

Рис. 1. Ряд активності металів
Мідь у цьому ряду розташована правіше за інші метали, про які йдеться в завданні.
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
Періодична система хімічних елементів - це графічний вираз періодичного закону. Структурними одиницями періодичної системи є періоди і групи хімічних елементів.
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
До головних підгруп належать елементи малих періодів та їхні аналоги з великих періодів. Поміж елементів головних підгруп є як металічні, так і неметалічні. У головних підгрупах зі зростанням атомних мас поступово посилюється металічний і послаблюється неметалічний характер елементів. Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
Відповідь: Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Окиснювальні властивості хімічних елементів у періодах зростають зі збільшенням протонного числа, а в групах – зменшуються (рис. 1).

Рис. 1. Елементи другого та третього періодів періодичної системи хімічних елементів
Відповідь: А, Б, Г, В.
ТЕМА: Періодична система хімічних елементів. Металічні елементи.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
В атомах металічних елементів на зовнішньому енергетичному рівні перебуває від одного до чотирьох електронів. Кількість електронів в атомах елементів головних підгруп періодичної системи дорівнює номеру групи. Тому варіанти відповіді В й Г не задовольняють умову завдання.
У IV групі містяться неметалічні елементи Карбон і Силіцій.
Із-поміж груп хімічних елементів, про які йдеться в завданні, лише металічні елементи містяться в ІІ групі.
Відповідь: A.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи хімічних елементів | ||
| металічних | неметалічних | |
| A | ||
| Б | ||
| B | ||
| Г | ||
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
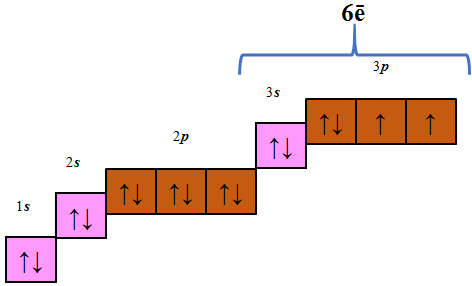
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
Тема: Класифікація хімічних елементів.
Завдання скеровано на перевірку розуміння ознак класифікації хімічних елементів на металічні й неметалічні, знання місцеположення металічних і неметалічних елементів у періодичній системі.
Місцеположення металічних елементів у періодичній системі відображено на рисунку 1.
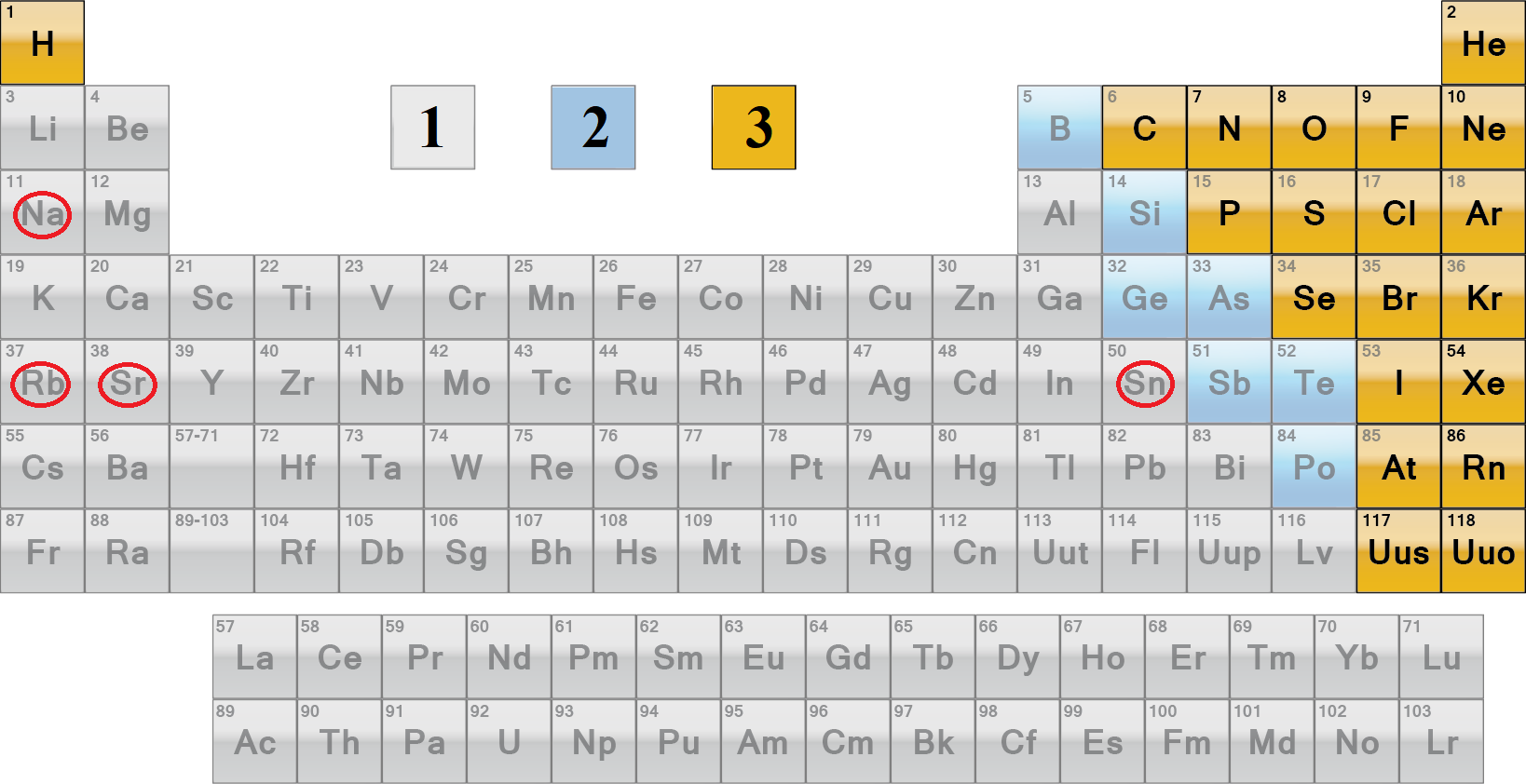
Рис. 1. Місцеположення в періодичній системі хімічних елементів – металічних (1), перехідних між металічними й неметалічними (2), неметалічних (3)
A Na, Ne, N
Б Cl, Sr, Sn
B P, As, Si
Г C, Br, Rb
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи металічних елементів | ||
| A | ||
| Б | ||
| B | – | |
| Г | ||
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи хімічних елементів | ||
| металічних | неметалічних | |
| A | – | |
| Б | ||
| B | ||
| Г | – | |
Відповідь: A.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени. Закономірності зміни властивостей хімічних елементів у групах періодичної системи.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у групах періодичної системи.
Неметалічні властивості й окисна здатність галогенів зростають у ряду
Відповідь: Б В А Г.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності й окиснювальних властивостей хімічних елементів у періодах і групах (рис. 1).
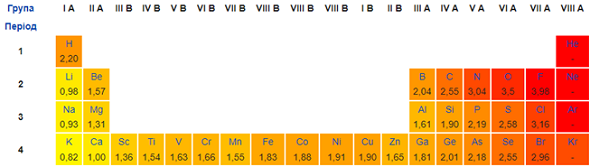
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: Г Б А В.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Усі хімічні елементи, про які йдеться в завданні, розташовані в другому періоді періодичної системи (рис. 1). У періодах зі збільшенням протонного числа посилюються неметалічні властивості хімічних елементів.

Рис. 1. Елементи другого періоду періодичної системи хімічних елементів
Відповідь: В, Б, А, Г.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
А
Б
В
Г
Натрій – лужний елемент, Берилій – металічний елемент, Ферум – металічний елемент (рис. 1).
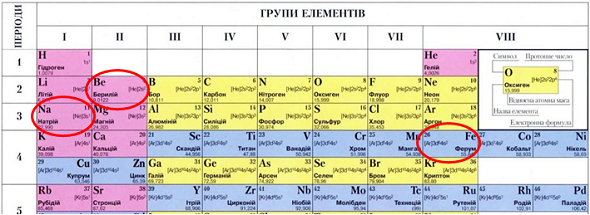
Відповідь: Б.




