Розділ: Будова атома і періодична система хімічних елементів
Тема: Періоди й ряди хімічних елементів
Кількість завдань: 25
ТЕМА: Періодична система хімічних елементів. Метали і неметали.
Завдання скеровано на перевірку знання ознак неметалів і їхнього місця в періодичній таблиці, уміння класифікувати хімічні елементи за їхніми фізико-хімічними властивостями.
У фрагменті таблиці наведено хімічні символи й зазначено відносні атомні маси десяти елементів. З-поміж них п’ять хімічних елементів належать до неметалічних: Бор, Карбон, Нітроген, Силіцій і Фосфор.
Такого висновку легко дійти, якщо взяти до уваги, що елементи побічних підгруп (у наведеному фрагменті таблиці це Скандій, Титан, Ванадій) є металічними. Алюміній – типовий металічний елемент, а в Галію металічні властивості виражені сильніше, ніж в Алюмінію, бо електрони зовнішнього енергетичного рівня розташовані на більшій відстані від ядра атома. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах – знизу догори.
Відповідь: Б.
ТЕМА: Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати властивості хімічних елементів за їхнім положенням у періодичній системі.
Силіцій, Фосфор, Сульфур, Хлор – елементи третього періоду. Чим більше протонне число елемента, тим менше радіус його атома й більша електронегативність порівняно з іншими елементами цього ж періоду. Тож в ряду хімічних елементів Силіцій, Фосфор, Сульфур, Хлор радіус атома зменшується, а електронегативність збільшується.
Відповідь: A.
ТЕМА: Загальна хімія. Місце хімічного елемента в періодичній системі. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронну формулу атома хімічного елемента й визначати його місце в періодичній системі.
Кількість електронів в атомі хімічного елемента дорівнює його протонному числу та, відповідно, порядковому номеру в періодичній системі.
У завданні йдеться про Ванадій, порядковий номер якого в періодичній системі – 23.
Це – елемент V групи побічної підгрупи (VБ або 5 групи), четвертого періоду періодичної системи.
Відповідь: Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності в періодичній системі хімічних елементів.
У періоді зі збільшенням протонного числа хімічних елементів збільшується електронегативність. Усі хімічні елементи, символи яких наведено в умові, належать до третього періоду, тобто їхня електронегативність зростає в такій послідовності:
Відповідь: Г А В Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодах.
Завдання скеровано на перевірку розуміння закономірностей зміни властивостей хімічних елементів у періодах.
Бор, Карбон, Нітроген, Оксиген – елементи другого періоду. У періодах зі збільшенням протонних чисел посилюються неметалічні властивості хімічних елементів.
Відповідь: В, Б, А, Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи.
Умову завдання задовольняють Кальцій, Хром, Манган – елементи четвертого (великого) періоду періодичної системи.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо будови її атома.
Завдання скеровано на перевірку вміння встановлювати зв’язок між місцем елемента в періодичній системі, будовою його атома, формулами найважливіших сполук хімічного елемента та аналізувати їх.
Дано:
Знайти:
Магній – елемент ІІА групи періодичної системи хімічних елементів, у його атомі на зовнішньому енергетичному рівні два електрони. Відповідно в атомі шуканого елемента на зовнішньому енергетичному рівні шість електронів, тож це елемент VІА групи третього періоду.
Умову завдання задовольняє Сульфур, формула його вищого оксиду –
Відповідь: 4.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів того самого періоду.
У періодах зі зростанням протонного числа збільшується кількість електронів на зовнішньому енергетичному рівні атомів хімічних елементів. Ця закономірність справедлива й для елементів 3 періоду (рис. 1).

Рис. 1. Будова зовнішнього енергетичного рівня атомів хімічних елементів 3 періоду
Відповідь: Г.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
Періодична система хімічних елементів - це графічний вираз періодичного закону. Структурними одиницями періодичної системи є періоди і групи хімічних елементів.
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
До головних підгруп належать елементи малих періодів та їхні аналоги з великих періодів. Поміж елементів головних підгруп є як металічні, так і неметалічні. У головних підгрупах зі зростанням атомних мас поступово посилюється металічний і послаблюється неметалічний характер елементів. Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
Відповідь: Г.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІ групі побічній підгрупі міститься Хром. Його порядковий номер 24, тож і протонне число цього хімічного елемент – 24.
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Хімічний елемент V A групи, розташований у ІV періоді, – Арсен.
Його порядковий номер у періодичній системі – 33. Тож і протонне число Арсену дорівнює 33.
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність.
Завдання скеровано на перевірку розуміння змісту поняття електронегативність і закономірностей зміни електронегативності в періодах і групах періодичної системи хімічних елементів.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
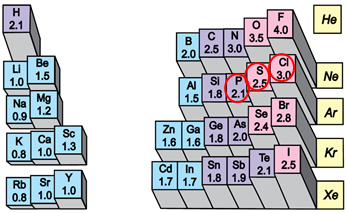
Рис. 1. Закономірності зміни електронегативності у періодичній системі
Відповідь: A.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Карбон – хімічний елемент IV А групи, Титан – IV А групи. Тобто Карбон і Титан – елементи однієї групи, але різних підгруп.
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Леткі сполуки з Гідрогеном складу
Його порядковий номер у періодичній системі – 15.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
A Натрій – хімічний елемент І А, а Хлор – VII А групи періодичної системи, в атомі Натрію один, а в атомі Хлору – сім електронів на зовнішньому енергетичному рівні
Б Натрій і Хлор – хімічні елементи третього періоду періодичної системи, електрони в їхніх атомах перебувають на трьох енергетичних рівнях
В Натрій – s-елемент, а Хлор p-елемент, тому кількість енергетичних рівнів, на яких перебувають електрони в їхніх атомах, різна
Г у Натрію і Хлору різні протонні числа, і, відповідно, різні кількості електронів в атомах
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце хімічного елемента в періодичній системі, розрізняти групи, підгрупи, періоди.
Купрум і Калій – металічні елементи першої групи періодичної системи, але належать до різних підгруп. Купрум – хімічний елемент побічної (І Б), а Калій – головної (І А) підгрупи.
Відповідь: B.
ТЕМА: Загальна хімія. Електронна формула. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодичній системі.
У завданні наведено електронні формули атомів елементів третього періоду. У періоді зі збільшенням кількості електронів на зовнішньому енергетичному рівні атомів посилюються неметалічні властивості хімічних елементів.
| Б | |
| A | |
| Г | |
| B |
Відповідь: Б А Г В.
ТЕМА: Загальна хімія. Будова атома. Кількість енергетичних рівнів в атомі.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в атомі за його місцем у періодичній системі.
Кількість енергетичних рівнів, на яких містяться електрони в атомі, визначають за номером періоду, у якому розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів того самого періоду. З-поміж наведених це елементи з протонними числами
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
Силіцій і Сульфур – елементи третього періоду, тобто електрони в їхніх атомах містяться на трьох енергетичних рівнях:
Відповідь: A.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів другого періоду послідовно збільшуються номери груп, до яких вони належать, і, відповідно, кількість електронів на зовнішньому енергетичному рівні їхніх атомів.
Відповідь: Г.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння розрізняти малі й великі періоди.
Періодична система хімічних елементів – це графічний вираз періодичного закону. Нині в періодичній системі
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. Кожен період починається лужним і завершується інертним елементом.
Перший, другий і третій періоди називають малими. У першому періоді – два елементи, у другому й третьому – по вісім. Ці періоди (короткоперіодна форма періодичної системи) містять по одному ряду хімічних елементів.
Умову завдання задовольняє добірка елементів третього періоду
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Усі хімічні елементи, про які йдеться в завданні, розташовані в другому періоді періодичної системи (рис. 1). У періодах зі збільшенням протонного числа посилюються неметалічні властивості хімічних елементів.

Рис. 1. Елементи другого періоду періодичної системи хімічних елементів
Відповідь: В, Б, А, Г.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІІ групі головній підгрупі міститься Бром. Його порядковий номер 35, тож і протонне число цього хімічного елемент – 35.
Відповідь: Г.




