Розділ: Будова атома і періодична система хімічних елементів
Тема: Радіус атома. Електронегативність
Кількість завдань: 34
ТЕМА: Закономірності зміни в періодичній таблиці радіуса атома, електронегативності, ступеня окиснення, окисних властивостей хімічних елементів.
Завдання скеровано на перевірку знання закономірностей періодичної таблиці, уміння порівнювати атомні радіуси, електронегативність й окисні властивості елементів.
У періодичній таблиці зі збільшенням протонного числа:
електронегативність хімічних елементів у періоді (зліва направо) зростає, а в групі (зверху вниз): зменшується. Найвища електронегативність у Флуору
атомний радіус у періоді зменшується (через збільшення заряду ядра), у групі зростає (через збільшення кількості енергетичних рівнів);
окисні властивості в періоді зростають у неметалів, у групі зменшуються. Флуор – найсильніший окисник поміж хімічних елементів, фтор – найсильніший окисник поміж галогенів й інших речовин.
Максимальний ступінь окиснення галогенів дорівнює семи
Тому:
А Радіус атома Хлору менший, ніж радіус атома Силіцію, бо Хлор
Б Хлор і Флуор мають різний максимальний ступінь окиснення.
В Електронегативність Хлору
Г Окисні властивості хлору слабші, ніж окисні властивості фтору, бо фтор – найсильніший окисник серед усіх елементів.
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній таблиці.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах періодичної таблиці електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Електронегативність хімічних елементів збільшується в
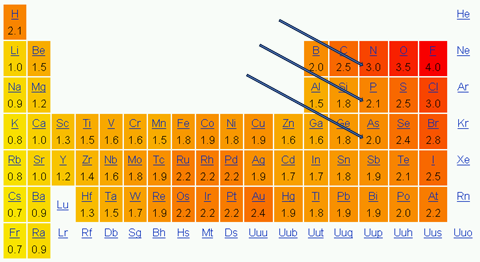
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Електронегативність елемента.
Завдання скеровано на перевірку вміння аналізувати зміну властивостей хімічних елементів у періодах і групах періодичної системи.
У періодах періодичної системи зі збільшенням величини заряду ядра атома електронегативність збільшується, у групах – зменшується.
Умову завдання задовольняє варіант Г – елементи третього періоду
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
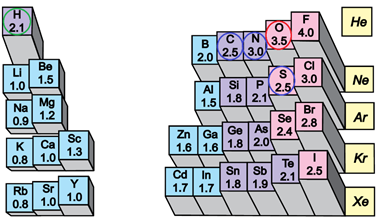
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: A.
ТЕМА: Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати властивості хімічних елементів за їхнім положенням у періодичній системі.
Силіцій, Фосфор, Сульфур, Хлор – елементи третього періоду. Чим більше протонне число елемента, тим менше радіус його атома й більша електронегативність порівняно з іншими елементами цього ж періоду. Тож в ряду хімічних елементів Силіцій, Фосфор, Сульфур, Хлор радіус атома зменшується, а електронегативність збільшується.
Відповідь: A.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння використовувати знання про закономірності зміни властивостей хімічних елементів у періодичній системі й аналізувати склад і будову їхніх атомів.
А В атомах Флуору й Хлору різна загальна кількість електронів, бо в них різні порядкові номери і, відповідно, протонні числа.
Б Електронегативність Флуору більша, ніж електронегативність Хлору, оскільки в групах хімічних елементів електронегативність зменшується зі збільшенням протонних чисел атомів. Флуор – самий електронегативний елемент.
В Радіус атома Хлору більший, ніж радіус атома Флуору, оскільки в групах зі збільшенням кількості енергетичних рівнів в атомах хімічних елементів збільшується їхній радіус.
Г Окисні властивості хлору виражені слабше, ніж фтору, бо окисні властивості простих речовин галогенів зростають зі збільшенням електронегативності атомів відповідних хімічних елементів.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді А – В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей (рис. 1).
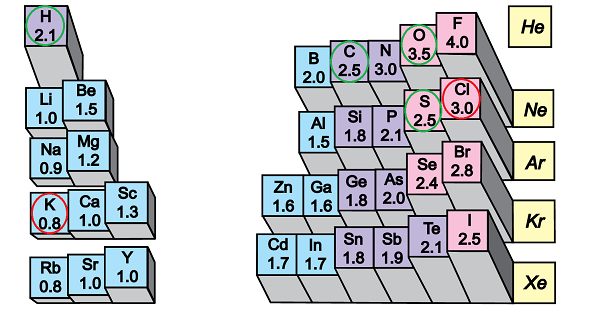
Натомість у калій хлориді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Калію і хлорид-аніонами.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
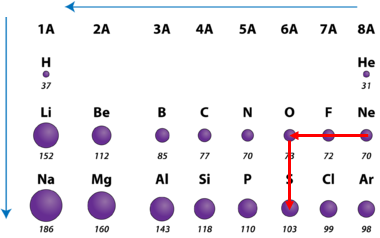
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: А Г В Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).

Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку то більша, що більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: Г В А Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується (рис. 1).
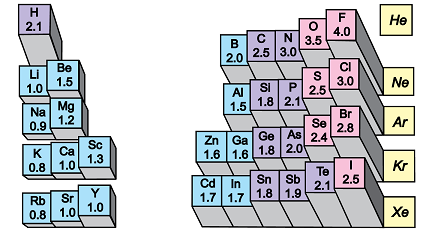
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атомів і простих йонів. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння застосовувати знання про будову атомів і закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а радіус атома збільшується. Тому радіус атома Оксигену менший за радіус атома Сульфуру, а електронегативність – більша. В Оксигену й Сульфуру різні протонні числа, тож з огляду на електронейтральність атомів загальна кількість електронів в їхніх атомах також різна. Тобто твердження А, В і Г неправильні.
Правильним є твердження Б, оскільки Оксиген і Сульфур – елементи тієї самої головної підгрупи й утворюють леткі сполуки з Гідрогеном складу
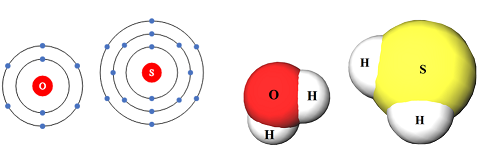
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Електронегативність. Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання і розуміння періодичного закону і зміни властивостей елементів у групах.
Для виконання завдання необхідно розуміти, що Карбон і Силіцій – елементи IV групи головної підгрупи. Необхідно знати, що електронегативність
У групі
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва.
Завдання перевіряє знання електронегативності, розуміння зміни атомного радіуса та електоронегативності в групі, загальної формули летких сполук галогенів із Гідрогеном, визначення загальної кількості електронів в атомі.
Для виконання завдання необхідно розуміти, що йдеться про галогени – елементи VIIа групи. Загальна кількість електронів в атомах різна, формула летких сполук галогенів з Гідрогеном
Проаналізувавши твердження, можна зробити висновок, що правильна відповідь В.
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
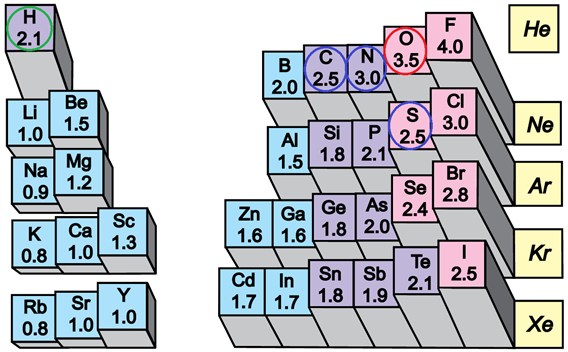
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементамипро сполуки яких ідеться, тому і зв’язок
Відповідь: A.
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі. Електронегативність. Радіус атома.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах зі збільшенням протонних чисел (зверху вниз) радіус атомів хімічних елементів збільшується (рис. 1, 1), а електронегативність (рис. 1, 2) і, відповідно, окисні властивості зменшуються.
Флуор і Хлор – елементи однієї групи, але різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів (рис. 1, 1).
Тобто помилковим є твердження, наведене в рядку A.
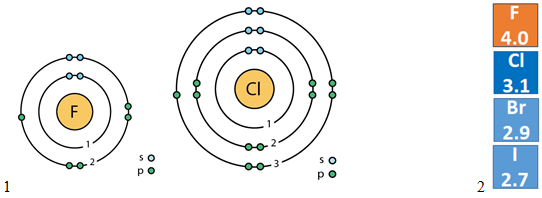
Рис. 1. 1. Будова атомів Флуору і Хлору. 2. Електронегативність галогенів
Відповідь: A.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє розуміння зміни електронегативності, радіуса атома елементів в групі та залежність властивостей елементів від радіуса атома. Зверніть увагу на виділення в умові «ПОМИЛКОВИМ»!
Необхідно розуміти, що в групі радіус атома збільшується, тому електронегативність і окисні властивості зменшується. Номер періоду показує число енергетичних рівнів в атомі. Оксиген (2 період) і Сульфур (3 період) – елементи різних періодів. Тому «ПОМИЛКОВИМ» є твердження Б.
Відповідь: Б.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності в періодичній системі хімічних елементів.
У періоді зі збільшенням протонного числа хімічних елементів збільшується електронегативність. Усі хімічні елементи, символи яких наведено в умові, належать до третього періоду, тобто їхня електронегативність зростає в такій послідовності:
Відповідь: Г А В Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
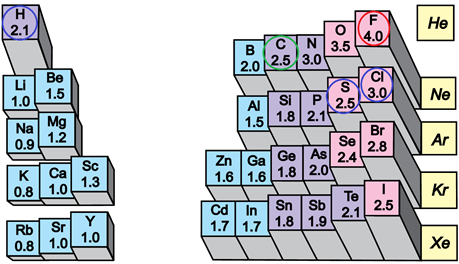
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність й радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Сульфуру (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Оксигену – на двох, тож радіус атома Сульфуру більший за радіус атома Оксигену |
| II | порядковий номер Неону в періодичній системі 10, у ядрі його атома 10 протонів й 11 (21 – 10) нейтронів |
| III | Хлор – елемент третього періоду, а Бром – четвертого, тому електрони в атомі Хлору перебувають на трьох, а в атомі Брому – на чотирьох енергетичних рівнях |
| IV | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Нітрогену більша за електронегативність Фосфору |
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
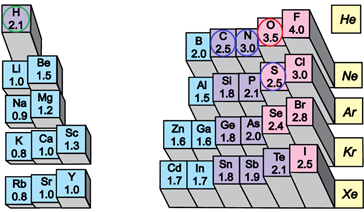
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, про які йдеться в завданні, тому і зв’язок
Відповідь: A.
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність і радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Хлору (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Флуору – на двох, тож радіус атома Хлору більший за радіус атома Флуору |
| II | порядковий номер Сульфуру в періодичній системі |
| III | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Оксигену більша за електронегативність Сульфуру |
| IV | в атомі Сульфуру |
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Радіус атома.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
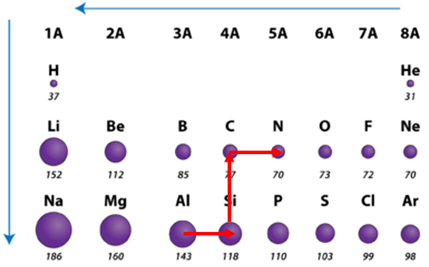
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: 1А, 2Б, 3В, 4Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Окиснювальні властивості хімічних елементів у періодах зростають зі збільшенням протонного числа, а в групах – зменшуються (рис. 1).

Рис. 1. Елементи другого та третього періодів періодичної системи хімічних елементів
Відповідь: А, Б, Г, В.
ТЕМА: Загальна хімія. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність хімічних елементів за їхнім місцем у періодичній системі.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується. Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, про які йдеться в завданні. Електронегативність Хлору більша за електронегативність Фосфору (обидва – хімічні елементи третього періоду). Електронегативність Селену більша за електронегативність Фосфору.
Електронегативність збільшується від Фосфору до Оксигену в ряду елементів
Відповідь: 1Г, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів більші за радіуси відповідних простих катіонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Рубідію більший за радіус атома Калію. Радіус атома Кальцію менший за радіус атома Калію, а радіус катіона Кальцію менший за радіус його атома.
Радіус частинок зменшується від атома Рубідію до катіона Кальцію в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність.
Завдання скеровано на перевірку розуміння змісту поняття електронегативність і закономірностей зміни електронегативності в періодах і групах періодичної системи хімічних елементів.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
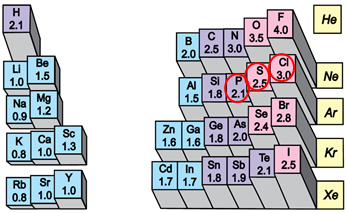
Рис. 1. Закономірності зміни електронегативності у періодичній системі
Відповідь: A.
ТЕМА: Закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Радіус катіона менший за радіус атома того самого хімічного елемента. У періодах радіус атомів зменшується зі збільшенням протонного числа, а в групах – збільшується.
Відповідь: 1А, 2Б, 3В, 4Г.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Радіус атома.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і радіус атома.
У поданому ряду хімічних елементів збільшуються їхні протонні числа. Тому з огляду на електронейтральність атомів загальна кількість електронів на зовнішньому енергетичному рівні також збільшується.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи й у поданому ряду хімічних елементів збільшується.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується. Подані елементи належать до одного періоду, тому зі збільшенням протонного числа їхня електронегативність збільшується.
Атомний радіус – половина віддалі, на якій перебувають сусідні атоми в структурі простої речовини. Величина залежить від алотропної видозміни елемента. Також атомним радіусом називають половинну відстань між ядрами атомів того самого елемента, коли атоми зв’язані одинарним ковалентним зв’язком або перебувають у кристалі металу. У періодах зі збільшенням протонних чисел атомні радіуси зменшуються, у групах хімічних елементів – збільшуються (рис. 1). Подані елементи належать до одного періоду, тому зі збільшенням протонного числа збільшується електронегативність атомів.
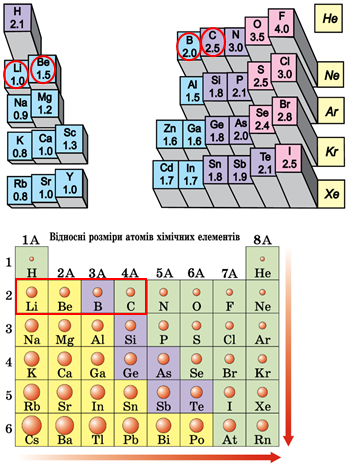
Рис. 1. Закономірності зміни електронегативності й радіуса атомів хімічних елементів у періодичній системі
Відповідь: Б.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
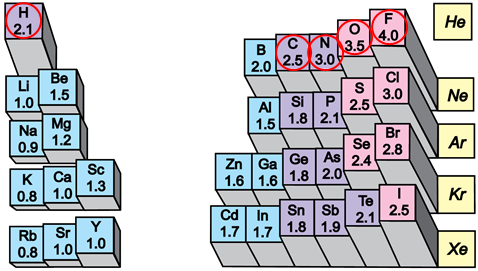
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Будова атомів. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність хімічних елементів за їхнім місцем у періодичній системі.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується. Електронегативність Оксигену більша за електронегативність Нітрогену (обидва – хімічні елементи другого періоду). Електронегативність Нітрогену більша за електронегативність Фосфору, а Фосфору – більша ніж електронегативність Арсену (усі – хімічні елементи V А групи).
Електронегативність збільшується від Арсену до Оксигену в ряду елементів
Відповідь: 1А, 2Г, 3B, 4Б.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність атомів.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується.
Сульфур і Хлор – елементи третього періоду, протонне число Хлору більше за протонне число Сульфуру, тож електронегативність Хлору також більша.
Сульфур, Селен і Телур – елементи однієї підгрупи, їхні протонні числа збільшуються, а електронегативність зменшується від Сульфуру до Телуру.
Електронегативність збільшується від Телуру до Хлору в ряду елементів
Відповідь: 1В, 2А, 3Б, 4Г.
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів менші за радіуси відповідних простих аніонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Оксигену більший за радіус атома Флуору (обидва – хімічні елементи другого періоду). Радіус атома Сульфуру більший за радіус атома Оксигену (обидва – хімічні елементи VІА групи), а радіус аніона Сульфуру більший за радіус атома цього хімічного елемента.
Радіус частинок збільшується від атома Флуору до аніона Сульфуру в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
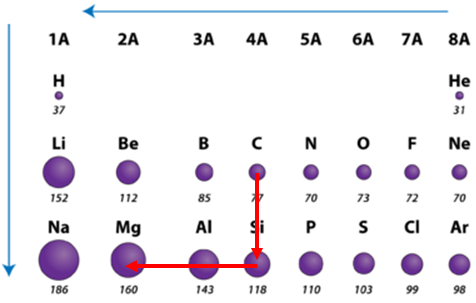
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: Г Б А В.




