Розділ: Речовина
Тема: Реакції йонного обміну
Кількість завдань: 89
ТЕМА: Реакції металів із кислотами й солей із лугами. Осадження гідроксидів.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів із кислотами, солей із лугами у водних розчинах.
1.
Залишок на фільтрі – магній гідроксид – гідроксид металічного елемента (А).
2.
Залишок на фільтрі – мідь – метал (Б).
3.
Залишок на фільтрі – мідь і магній гідроксид – метал і гідроксид металічного елемента (В).
Відповідь: 1А; 2Б; 3В.
ТЕМА: Йонний склад розчинів. Реакції обміну. Осадження малорозчинних сполук.
Завдання скеровано на перевірку знання умов утворення осаду в реакціях обміну між солями у водних розчинах, уміння аналізувати йонний склад розчинів.
Після зливання розчинів хлорид-іони утворюються внаслідок електролітичної дисоціації двох солей, бо відбулася реакція обміну:
Рівняння електролітичної дисоціації розчинених у воді солей.
Загальна кількість йонів
Кількість речовини (моль) катіонів
Унаслідок реакції обміну між барій хлоридом і цинк сульфатом утворюється нерозчинний у воді барій сульфат.
Відповідь: Б.
ТЕМА: Класифікація солей. Реакції солей із лугами й кислотами. Ознаки утворення осаду й газу.
Завдання скеровано на перевірку вміння тлумачити спостереження і робити висновки з них.
| Варіант відповіді | Формула солі | Хімічні властивості | Реактанти | Посудина | |
| А | Не реагує з натрій гідроксидом і сульфатною кислотою, осад не утворюється | ||||
| Б | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з виділенням газу | ||||
| B | Не реагує з натрій гідроксидом і сульфатною кислотою | ||||
| Г | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з утворенням осаду | ||||
| Д | Реагує з натрій гідроксидом з утворенням осаду й не реагує із сульфатною кислотою | ||||
Відповідь: 1Г; 2Д; 3Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі. Електролітична дисоціація. Умови необоротності реакцій йонного обміну в розчинах електролітів.
Завдання скеровано на перевірку знання умов необоротності реакцій йонного обміну в розчинах електролітів і вміння прогнозувати продукти реакцій.
Скориставшись таблицею «Розчинність кислот, основ, амфотерних гідроксидів, солей у воді за температури 20–25 °С», можна дійти висновку, що осад не утвориться внаслідок змішування водних розчинів амоній хлориду й калій ортофосфату, тому що не утворюється жодної нерозчинної солі, а лише суміш катіонів й аніонів. У решті реакцій утворюються нерозчинні солі.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Реакції йонного обміну.
Завдання скеровано на перевірку вміння застосовувати знання про необоротність реакцій йонного обміну в розчині для прогнозування перебігу реакцій.
У разі використання розчину сульфатної кислоти іншим реактантом може бути лише натрій гідроксид. Бо в разі використання барій гідроксиду утвориться осад барій сульфату, який у воді не розчиняється. Тож скорочене йонне рівняння буде іншим:
У разі використання натрій гідроксиду іншим реактантом може бути і хлоридна, і сульфатна кислоти:
Відповідь: B.
ТЕМА: Речовина. Реакції йонного обміну.
Завдання скеровано на перевірку розуміння суті електролітичної дисоціації та умов необоротності реакцій йонного обміну між електролітами у водних розчинах, уміння прогнозувати перебіг цих реакцій за допомогою таблиці «Poзчинність ocнов, амфотерних гідроксидів, кислот і солей у воді за
Умову завдання задовольняє пара йонів
Тому кількості цих йонів, а відповідно й кількості речовин цих йонів, зменшаться, бо йони з розчину перейдуть до складу нерозчинної солі.
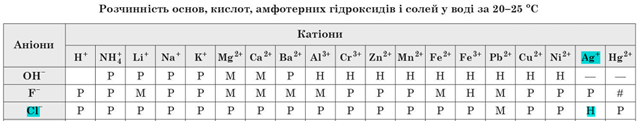
Відповідь: Б.
ТЕМА: Неорганічна хімія. Властивості кислот і лугів. Реакція нейтралізації. Водневий показник pH розчину.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації, уміння тлумачити водневий показник pH розчину, графіки.
Унаслідок нейтралізації лугу сильною кислотою в розчині поступово зменшуватиметься вміст гідроксид-аніонів, тобто його водневий показник pH також поступово зменшуватиметься. Умову завдання задовольняє графік Б.
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння суті реакцій йонного обміну.
Натрій сульфат і барій хлорид – сильні електроліти, у водному розчині повністю дисоціюють на йони. Катіони Барію
Відповідь: Б.
ТЕМА: Загальна хімія. Електролітична дисоціація. Умови необоротності реакцій обміну між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати необоротність реакцій йонного обміну між електролітами у водних розчинах.
Умову завдання задовольняють барій сульфат й аргентум(І) хлорид:
Відповідь: B.
ТЕМА: Загальна хімія. Гідроліз солей. Умови необоротності реакцій між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і можливість перебігу реакцій між електролітами у водних розчинах.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
Кисле середовище у водних розчинах плюмбум(ІІ) нітрату й цинк сульфату, нейтральне – натрій хлориду й калій нітрату. У водному розчині натрій карбонату середовище лужне.
Тобто в посудинах 1 і 3 можуть міститися розчини плюмбум(ІІ) нітрату й цинк сульфату, а в посудині 2 – натрій хлориду й калій нітрату.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
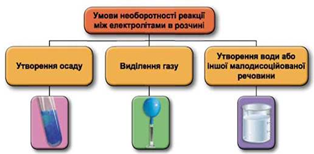
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Тобто розчин калій нітрату не може міститися в посудині 2, бо із жодною із солей, про які йдеться в завданні, не реагує. Отже, у посудині 2 міститься водний розчин натрій хлориду.
Потрібно розрізнити розчини двох солей – цинк сульфату та плюмбум(ІІ) нітрату. Плюмбум(ІІ) нітрат у водному розчині реагує як із натрій хлоридом, так й із цинк сульфатом з утворенням малорозчинних плюмбум(ІІ) хлориду й плюмбум(ІІ) сульфату. Тобто розчин плюмбум(ІІ) нітрат міститься в посудині 1, а цинк сульфату – у посудині 3.
| Номер посудини | 1 |
2 |
3 |
| 1 |
|||
| 2 |
– | ||
| 3 |
– |
Відповідь: 1В, 2Б, 3А.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
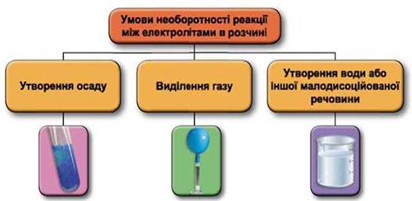
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Катіони Магнію взаємодіють із гідроксид-аніонами з утворенням осаду – малорозчинного магній гідроксиду.
Сульфат-аніони зв’язують катіони Барію в нерозчинний барій сульфат.
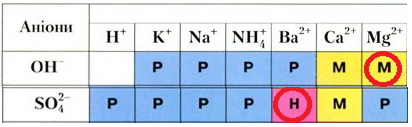
Рис. 2. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Г.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності реакцій між електролітами в розчині.
Хлоридна кислота є сильною, тому може витіснити із солей слабші за неї сульфідну, залишок якої є в натрій сульфіді (варіант відповіді А) і сульфітну, залишок якої є в натрій сульфіті (варіант відповіді Г) кислоти. Однак осад з барій хлоридом у водному розчині утворить лише натрій сульфіт – він є малорозчинною речовиною, а барій сульфід розчиняється у воді (рис. 1).
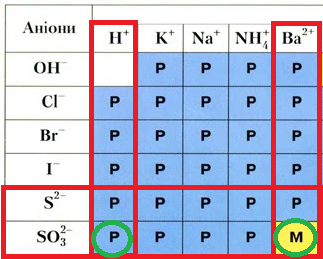
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей у воді за температури 20–25 °С»
Відповідь: Г.
ТЕМА: Розчини. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Під час розв’язування завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20‑25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
У першій пробірці містився розчин солі карбонатної кислоти, оскільки під дією сильної сульфатної кислоти виділився газ – карбон(IV) оксид:
У другій пробірці містився розчин солі Магнію, бо внаслідок дії водного розчину натрій гідроксиду утворився осад магній гідроксиду:
У третій пробірці був розчин солі Барію, бо внаслідок дії водного розчину сульфатної кислоти утворився осад барій сульфату:
Відповідь: 1Б, 2Д, 3А.
ТЕМА: Основні класи неорганічних сполук. Солі. Реакції обміну між електролітами в розчині. Явище амфотерності.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
У кожну пробірку добавляли краплями водний розчин калій гідроксиду. У пробірках 1 і 3 утворився осад, а в пробірці 2 змін не було. Із калій гідроксидом не реагуватиме натрій хлорид. Тому пошуки правильної відповіді потрібно обмежити варіантами А і Г.
У пробірці 3 під дією надлишку лугу спостерігали швидке розчинення осаду, що утворився на попередньому етапі досліду, а в пробірці 1 осад не розчинився. Це дає змогу дійти висновку, що від початку в пробірці 1 був розчин магній хлориду. Унаслідок дії на нього розчину лугу утворився осад основного магній гідроксиду, що за описаних умов досліду з лугами не реагує.
Натомість цинк гідроксид, осад якого утворився під дією лугу в розчині на цинк хлорид, є амфотерним, тобто реагує і з кислотами, і з лугами.
Суть реакцій, що відбулися, можна описати за допомогою скорочених йонних рівнянь:
Відповідь: A.
ТЕМА: Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати склад солей за допомогою якісних реакцій на йони.
Узявши до уваги дані, наведені в довідковій таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді», можна дійти висновку, що для підтвердження якісного складу барій хлориду потрібно використати водні розчини калій сульфату й аргентум(І) нітрату. Адже реактивом на катіони Барію є сульфат-аніони, а реактивом на хлорид-аніони є катіони аргентуму(І):
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Гідроліз солей. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах. Якісна реакція на сульфат-аніони.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу, перебіг реакцій йонного обміну між солями в розчині.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Тобто за умовою завдання потрібно визначити сіль сильної основи й слабкої кислоти. Такою сіллю є натрій силікат
Рівняння реакцій, описаних у завданні, такі:
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння ідентифікувати речовини за допомогою якісних реакцій на йони в їхньому складі.
Для правильного розв’язання завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
1 |
Під дією хлоридної кислоти на калій силікат (В) утвориться осад силікатної кислоти. Унаслідок реакції калій силікату з барій хлоридом у розчині утвориться осад барій силікату. |
2 |
Магній сульфат (А) у розчині не реагує ні з хлоридною кислотою, ні з барій хлоридом, усі ці речовини перебувають у розчині у формі йонів. |
3 |
Натрій карбонат (Б) реагує з хлоридною кислотою з виділенням газу. Унаслідок взаємодії з барій хлоридом у розчині утворюється осад барій карбонату. |
Відповідь: 1В, 2А, 3Б.
ТЕМА: Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати склад солей за допомогою якісних реакцій на йони.
Узявши до уваги дані, наведені в довідковій таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді», можна дійти висновку, що сіль, про яку йдеться в умові завдання, – натрій гідрогенкарбонат. Рівняння реакцій, описаних у завданні, такі:
Відповідь: B.
ТЕМА: Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку вміння порівнювати фізичні й хімічні властивості неметалів, оксидів неметалічних елементів.
Для виконання завдання необхідно знати якісну реакцію на карбон(ІV) оксид.
Реактивом на карбон(ІV) оксид, який належить до кислотних, є вапняна вода (насичений розчин кальцій гідроксиду). Карбон(ІV) оксид із вапняною водою утворює осад білого кольору (
Відповідь: B.
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Для виконання завдання необхідно знати, за яких умов відбуваються реакції обміну між електролітами в розчинах.
Проаналізуємо описані в завданні досліди й зіставимо їх із варіантами відповіді.
У першій пробірці після добавляння до розчину речовини Х розчину барій нітрату утворився осад:
У другій пробірці після добавляння до розчину речовини Х розчину натрій гідроксиду також утворюється осад:
Відповідь: A.
ТЕМА: Суміші речовин. Розчини. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку розуміння реакцій йонного обміну, якісне виявлення катіонів Ферум(3+).
Для виконання завдання необхідно знати, що осадити катіон можна аніоном, і вміти користуватися таблицею розчинності.
Проаналізуємо запропоновані водні розчини на вміст аніонів і за допомогою таблиці розчинності визначимо, який саме аніон з катіоном
| Катіон | |||
| Аніон | |||
A |
p | ||
Б |
н | ||
B |
p | ||
Г |
p | ||
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Амоніак. Йони амонію.
Завдання скеровано на перевірку знання якісної реакції на катіони амонію.
Реактивом на катіони амонію є гідроксид-аніони:
Унаслідок реакції виділяється амоніак – газ iз характерним різким запахом, у якому вологий універсальний індикаторний папірець набуває синього кольору.
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічні речовини та їхні властивості. Електролітична дисоціація. Якісні реакції на катіони й аніони.
Завдання скеровано на перевірку вміння доводити якісний склад неорганічних речовин за допомогою характерних реакцій на катіони й аніони в їхньому складі.
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони. Тому реагує з алюмінієм з утворенням відповідної солі та водню і з аргентум(І) нітратом з утворенням осаду аргентум(І) хлориду:
Відповідь: B.
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за хімічною формулою.
Завдання скеровано на перевірку вміння розпізнавати аніони за допомогою якісних реакцій та обчислювати молярну масу речовини за хімічною формулою.
Умову завдання задовольняє силікат-аніон. Під дією хлоридної кислоти на розчинний силікат випадає склоподібний осад силікатної кислоти. Осад розчиняється внаслідок нейтралізації кислоти лугом.
Відповідь: 76.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
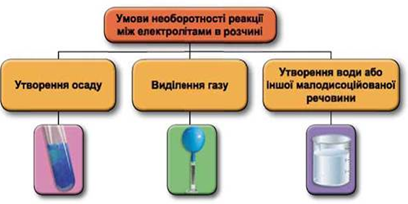
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
| Назва реагентів | Молекулярне та йонно-молекулярні рівняння | ||
| 1 | аргентум(І) нітрат і барій хлорид |
|
B |
| 2 | ферум(III) оксид і нітратна кислота |
|
Д |
| 3 | калій гідроксид і сульфатна кислота |
|
A |
| 4 | ферум(II) сульфід і хлоридна кислота |
|
Г |
Відповідь: 1В, 2Д, 3А, 4Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
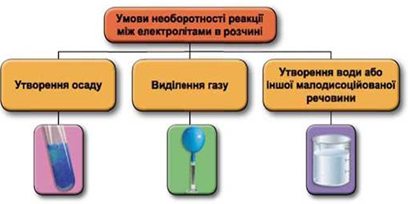
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сильною кислотою (наприклад хлоридною) і середньою сіллю (силікатом):
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
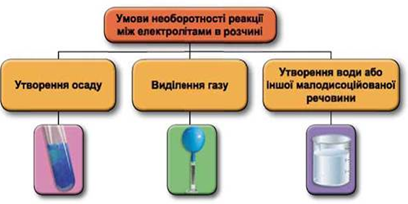
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сіллю Магнію і лугом:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
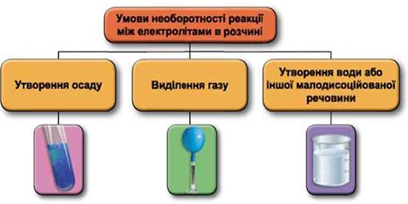
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді магній сульфат дисоціює на йони:
З-поміж аніонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із катіоном Магнію утворюють лише гідроксид-аніони:
З-поміж катіонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із сульфат-аніоном утворюють лише катіони Барію:
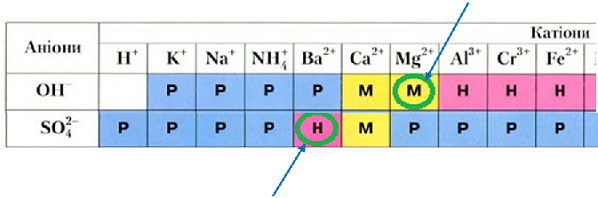
Тобто для підтвердження якісного складу магній сульфату потрібно використати водні розчини натрій гідроксиду і барій хлориду.
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Солі.
Завдання перевіряє вміння якісно визначати солі за аніоном.
Для розв’язання завдання необхідно знати якісні реакції на аніони. За умовою завдання є водні розчини солей магній нітрат
з нітрат-аніонами катіони барію не реагують. Таким чином, магній сульфат можна відрізнити від магній нітрату, використавши водний розчин барій хлориду.
Відповідь: Г.
ТЕМА: Розчини. Електролітична дисоціація, йонно-молекулярні рівняння.
Завдання перевіряє вміння визначати можливість перебігу реакції обміну між електролітами в розчинах.
Для виконання завдання необхідно розуміти що означає осадити йон і за яких умов можлива реакція між електролітами в розчинах, уміння користуватися таблицею розчинності.
Осадити йон означає зв’язати його іншим йоном в осад. В умові завдання йдеться про катіон, а катіон можна осадити аніоном. Проаналізуємо, які є аніони в запропонованих варіантах водних розчинів:
За таблицею розчинності, яка є в тестовому зошиті, визначаємо, з яким із запропонованих аніонів катіон
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами. Неорганічна хімія. Основні класи неорганічних сполук. Хімічні властивості солей і лугів. Добування нерозчинних основ.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині, знання хімічних властивостей солей і лугів.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині, уміти користуватися таблицею розчинності, знати хімічні властивості солей і лугів, способи добування нерозчинних основ.
Однією з умов, за якою відбувається реакція обміну в розчині, є утворення осаду.
У пробірці 1 осад не утворюється, тому що реакція між калій сульфатом і натрій гідроксидом не відбувається, речовини перебувають в розчині у вигляді йонів:
У пробірці 2 осад утворюється, тому що реакція між купрум(ІІ) сульфатом і натрій гідроксидом відбувається з утворенням нерозчинної основи купрум(ІІ) гідроксиду:
Відповідь: B.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами у розчині, уміти користуватися таблицею розчинності. Реакція у водних розчинах відбувається за умови утворення осаду, або газу, або води. У завданні необхідно визначити, між якими речовинами відбувається реакція з утворенням осаду. Перша пара речовин магній хлорид і арґентум нітрат, унаслідок зливання водних розчинів цих речовин утворюється осад:
Магній хлорид і натрій нітрат не взаємодіють між собою у водному розчині. Розчини сульфатної кислоти і натрій карбонату взаємодіють з утворенням газу, а за умовою завдання необхідно, щоб випав осад. Розчини сульфатної кислоти і натрій гідроксиду взаємодіють з утворенням води.
Отже, завдання має лише одну правильну відповідь – А.
Відповідь: A.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині, уміти користуватися таблицею розчинності.
У завданні наведено карбонат-аніон
Отже, правильна відповідь – Б.
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині. Магній сульфат і магній нітрат – солі магнію, тому відрізнити їх можна лише за аніоном. Сульфат від нітрату у водному розчині можна відрізнити катіонами барію, із запропонованих речовин це водний розчин барій хлориду. Магній сульфат у водному розчині вступає в реакцію з барій хлоридом, а магній нітрат – ні.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Розчини. Йонно-молекулярне рівняння. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей і умови необоротності реакцій обміну між електролітами в розчині для прогнозування можливості перебігу хімічних реакцій, їхніх продуктів.
Солі, про які йдеться в завданні, утворені катіоном Магнію i різними аніонами – хлорид-аніоном і нітрат-аніоном. З-поміж йонів, назви яких наведено у варіантах відповіді, два катіони й два аніони. Тобто для розрізнення розчинів магній хлориду й магній нітрату потрібно використати певний катіон, який осаджуватиме або нітрат-, або хлорид-аніон.
Скориставшись таблицею розчинності, легко дійти висновку, що цю умову задовольняє катіон Аргентуму(І):
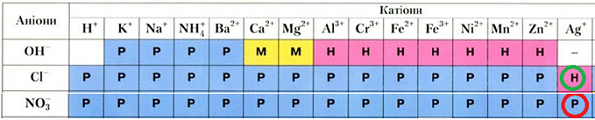
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей, визначати можливість перебігу реакції обміну між електролітами в розчині.
Проаналізувавши умову завдання, можна дійти висновку, що її задовольнить речовина, яка у водному розчині дисоціює з утворенням:
- аніонів, які осаджують катіони Калію і Барію;
- катіонів, які утворюють осад із гідроксид- і хлорид-аніонами.
Цю умову з-поміж наведених варіантів відповіді задовольняє лише магній сульфат:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Аналіз скороченого йонного рівняння дає змогу дійти висновку, що як реагенти, так і продукти реакції – розчинні речовини, а реакція необоротна, бо внаслідок її перебігу утворюється вода – неелектроліт.
Розчинними є обидва реагенти (нітратна й сульфатна кислоти, барій гідроксид) лише у варіантах відповіді Б і В.
Однак у варіанті відповіді Б один з продуктів реакції – барій сульфат – нерозчинна речовина, що не відповідає скороченому йонному рівнянню.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді калій нітрат, натрій карбонат і кальцій хлорид дисоціюють на йони:
З-поміж йонів, які утворюються внаслідок електролітичної дисоціації речовин, про які йдеться в завданні, осад утворюється лише внаслідок взаємодії катіонів Кальцію і карбонат-аніонів:
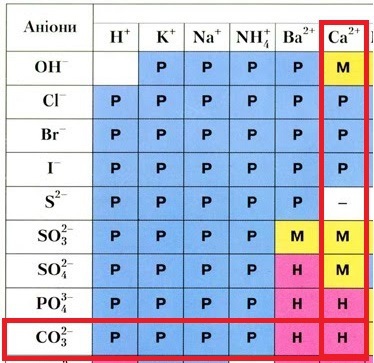
Тому осад випаде лише в пробірці ІІ.
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі. Хімічні властивості і добування солей.
Завдання перевіряє знання хімічних властивостей і добування солей.
Для виконання завдання необхідно знати за якої умови солі реагують між собою у водному розчині й вміти користуватися таблицею розчинності, яка є в тестовому зашиті. Дві солі можуть реагувати за умови, якщо вихідні солі розчинні у воді, а одна із солей, що утворюється, не розчина у воді. Розчинна чи нерозчинна сіль у воді – визначають за таблицею розчинності. Таким умовам з наведеного переліку назв речовин відповідає лише барій нітрат.
Відповідь: Г.
ТЕМА: Розчини. Йонно-молекулярне рівняння. Реакції обміну між електролітами у розчині.
Завдання перевіряє вміння визначати можливість перебігу реакції обміну між електролітами в розчині
Реакція обміну між електролітами в розчині відбувається за умов утворення осаду, або виділення газу, або утворення слабкого електроліту (води). Бажано написати рівняння хімічних реакцій:
Аналіз рівнянь показує, що осад випадає лише в одній реакції.
Відповідь: Б
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі деяких йонів.
Скорочені йонні рівняння реакцій, про які йдеться в завданні, такі:
Відповідь: 1Г, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами у водних розчинах.
Завдання скеровано на перевірку розуміння умов необоротності реакцій обміну між електролітами у водних розчинах.
Відповідь: Б, А, Г, В
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування можливості перебігу реакцій йонного обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
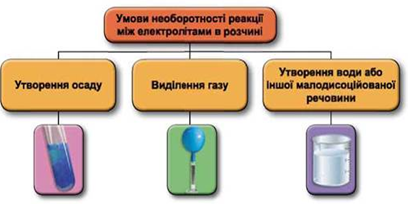
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині відбудеться реакція між аргентум(І) нітратом і калій хлоридом:
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування можливості перебігу реакцій йонного обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
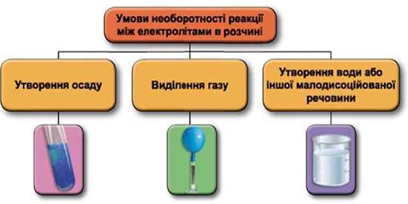
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Одночасно в розчині не можуть перебувати катіони Барію та ортофосфат-аніони, оскільки реагують з утворенням нерозчинного барій ортофосфату:
Відповідь: Б.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умову завдання задовольняє такий варіант відповіді:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині. Йонно-молекулярне рівняння.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині й уміння складати йонно-молекулярні рівняння.
Для того, щоби скласти повне йонно-молекулярне рівняння реакції між купрум(ІІ) гідроксидом і нітратною кислотою, потрібно формули електролітів записати в йонній формі:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Умовою необоротності перебігу реакцій між електролітами у водному розчині є утворення води, осаду, виділення газу.
Між натрій нітратом і калій сульфатом (варіант відповіді А) реакція не відбувається, бо як реагенти, так і продукти реакції є сильними електролітами.
Між речовинами, формули яких наведено у варіантах відповіді Б – Г відбуваються хімічні реакції:
Б
В
Г
Відповідь: A.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
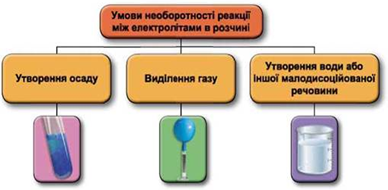
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій нітрат (В), на відміну від аргентум(І) нітрату (Г), не реагує з калій хлоридом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
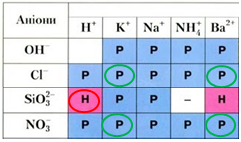
Рис. 2. Хлориди й нітрати Калію і Барію – розчинні речовини, а силікатна кислота нерозчинна
Унаслідок реакції між сульфатною кислотою і натрій силікатом (А) утворюється нерозчинна силікатна кислота, а в реакції з натрій карбонатом виділяється карбон(IV) оксид (Б).
Відповідь: B.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
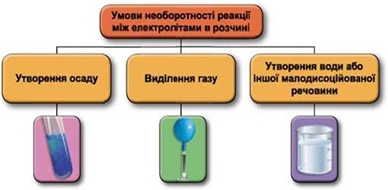
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити катіони Барію з водного розчину барій хлориду можна за допомогою розчину натрій карбонату (рис. 2).
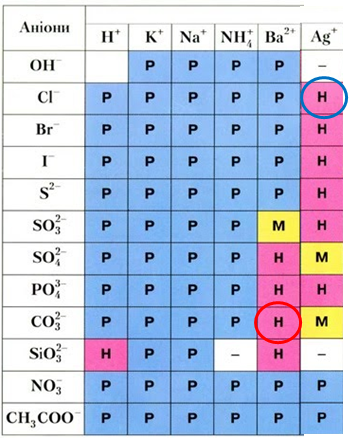
Рис. 2. Барій карбонат утворюється внаслідок осадження катіонами Барію карбонат-аніонами
Унаслідок дії калій нітрату й натрій етаноату на барій хлорид усі речовини залишаються в розчині у формі йонів, тобто про осадження не йдеться. Аргентум(І) нітрат осадить із розчину барій хлориду аніони Хлору. Барій карбонат є нерозчинною речовиною, тому для осадження з розчину барій хлориду катіонів Барію можна використати водний розчин натрій карбонату.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Солі. Середні й кислі солі. Ортофосфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про кислі й середні солі, способи добування солей для прогнозування складу продуктів хімічних реакцій.
Середня сіль – продукт повного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить лише катіони металічних елементів й аніони кислотних залишків.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить катіони металічних елементів, атоми Гідрогену, здатні до заміщення на катіони металічних елементів, й аніони кислотних залишків.
Відповідь: Б.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
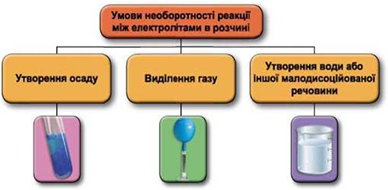
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Натрій нітрат (А), на відміну від натрій силікату (Б), не реагує з хлоридною кислотою у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
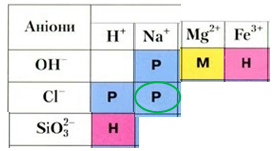
Рис. 2. Натрій хлорид – розчинна речовина, натомість силікатна кислота й ферум(ІІІ) гідроксид нерозчинні, магній гідроксид – малорозчинний
Унаслідок реакції між ферум(ІІІ) хлоридом і лугом (В) утворюється нерозчинний ферум(ІІІ) гідроксид, а в реакції між магній хлоридом і лугом – малорозчинний магній гідроксид (Г).
Відповідь: A.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
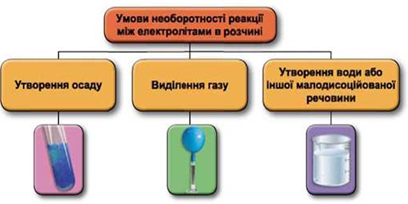
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів барій нітрату й натрій сульфату утвориться осад барій сульфату:
Відповідь: Б.
ТЕМА: Йонні рівняння.
Завдання скеровано на перевірку вміння за скороченими йонно-молекулярними рівняннями відтворювати молекулярні.
Скорочене йонне рівняння
Реакція нейтралізації – це реакція між основою і кислотою з утворенням солі та води.
Умову завдання задовольняє пара речовин «натрій гідроксид і нітратна кислота».
Відповідь: Б.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
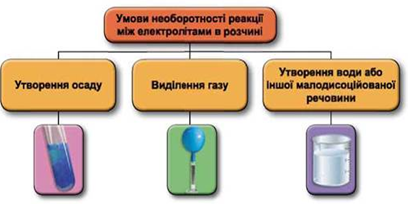
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Лише між калій нітратом і кальцій гідроксидом у водному розчині реакція не відбувається, оскільки всі речовини перебувають у розчині у вигляді йонів.
У варіантах відповіді А та В внаслідок реакцій утворюються осади ферум(ІІІ) гідроксиду й аргентум(І) хлориду відповідно.
У хімічній реакції між натрій карбонатом і нітратною кислотою (варіанті відповіді Б) виділяється газ.
Відповідь: Г.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
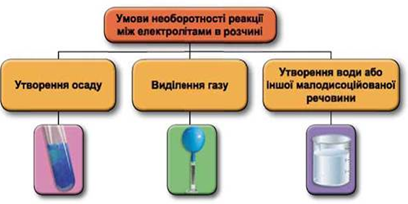
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів натрій карбонату та барій хлориду утвориться осад барій карбонату:
Відповідь: Б.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
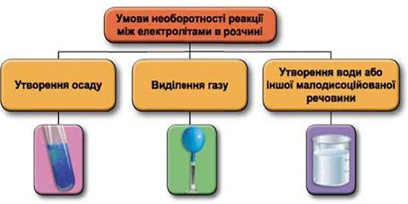
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують купрум(ІІ) сульфат і барій хлорид, унаслідок цього утворюється осад барій сульфату:
Відповідь: Г.
ТЕМА: Загальна хімія. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання властивостей солей карбонатної кислоти, взаємного перетворення карбонатів і гідрогенкарбонатів.
Натрій гідрогенкарбонат – кисла сіль, тому реагує з натрій гідроксидом:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Реактивом на хлорид-аніони є катіони Аргентуму(І), за їхньою допомогою можна розрізнити водні розчини натрій хлориду й натрій нітрату:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння використовувати закон збереження маси речовин і розпізнавати неорганічні сполуки за їхніми властивостями.
У завданні наведено схему реакції обміну між лугом і невідомою речовиною. Продукти цієї реакції – нерозчинна сіль і натрій гідроксид. За законом збереження маси речовин під час хімічних реакцій можна дійти висновку, що невідома речовина – натрій карбонат:
Натрій карбонат утворений катіонами металічного елемента й аніоном кислотного залишку, це – середня сіль.
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині й складати повні й скорочені йонно-молекулярні рівняння.
Цинк оксид – нерозчинна у воді речовина, вода не практично не дисоціює. Гідроген хлорид – сильний електроліт, який у водному розчині дисоціює на катіони Гідрогену й хлорид-аніони. На катіони Цинку й хлорид-аніони дисоціює цинк хлорид – розчинна у воді сіль:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
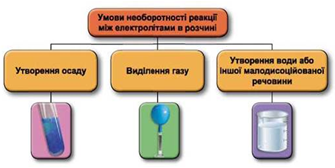
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою натрій нітрат і кальцій гідроксид, оскільки поміж йонів, які утворюються внаслідок їхньої електролітичної дисоціації, немає таких, що взаємодіють з утворенням слабкого електроліту.
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині, складати повні й скорочені йонні та йонно-молекулярні рівняння.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
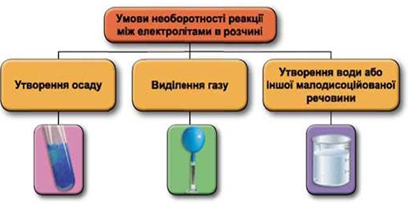
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Взаємодію у водному розчині ферум(ІІ) гідроксиду й хлоридної кислоти описують такими рівняннями:
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
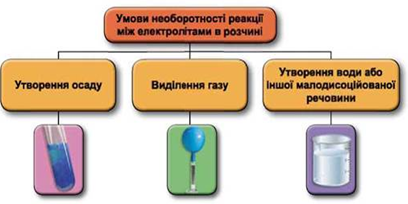
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Скорочене йонне рівняння
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
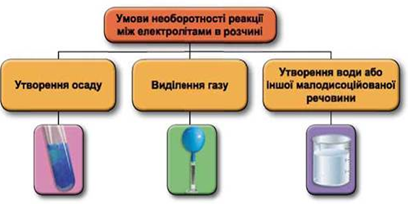
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою калій хлорид і натрій нітрат:
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині, складати повні й скорочені йонні та йонно-молекулярні рівняння.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
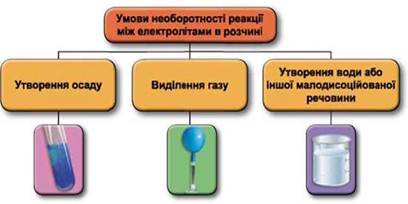
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Взаємодію у водному розчині ферум(ІІ) гідроксиду й хлоридної кислоти описують такими рівняннями:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
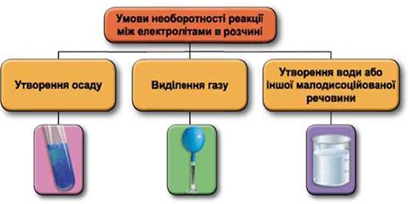
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою барій хлорид і сульфатна кислота, одним із продуктів реакції є осад барій сульфату:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
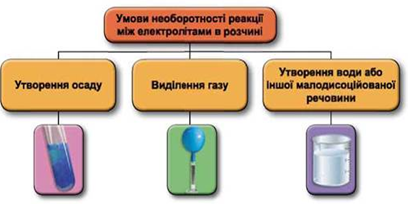
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою аргентум(І) нітрат і калій хлорид, одним із продуктів реакції є осад аргентум(І) хлориду:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Умовою необоротності перебігу реакцій між електролітами у водному розчині є утворення води, осаду, виділення газу.
A
Б
B
Г
Відповідь: Б.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
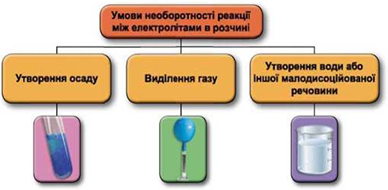
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити карбонат-аніони з водного розчину можна за допомогою розчину барій хлориду (рис. 2).
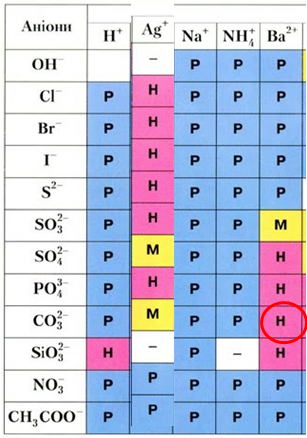
Рис. 2. Барій карбонат утворюється внаслідок осадження карбонат-аніонів катіонами Барію
Унаслідок дії сульфатної та етанової кислот на карбонат-аніони виділяється газ – карбон(ІV) оксид, тобто про осадження не йдеться. Натрій карбонат є розчинною речовиною, тож осадити карбонат-аніони за допомогою розчину натрій хлориду не можна. Натомість барій карбонат є нерозчинною речовиною, тому для осадження карбонат-аніонів можна використати водний розчин барій хлориду.
Відповідь: Г.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
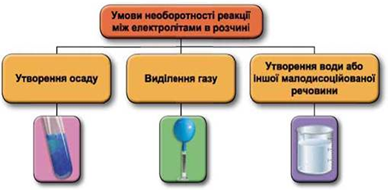
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій хлорид (А), на відміну від магній хлориду (Б), не реагує з натрій гідроксидом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
Рис. 2. Барій гідроксид – розчинна речовина, натомість магній гідроксид малорозчинний
Сильна й нелетка сульфатна кислота витісняє слабку й летку карбонатну з її солі (В), а сильна нітратна кислота – слабку сульфітну. Також можливе окиснення сульфітної кислоти до сульфатної (Г).
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Реакції обміну між електролітами у розчині.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій обміну між електролітами в розчині, продукти цих реакцій.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
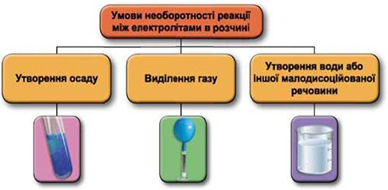
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє натрій карбонат:
Сильна хлоридна кислота витісняє слабку й нестійку карбонатну кислоту з її солі (рис. 2).
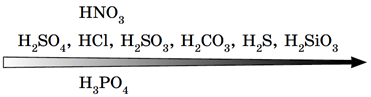
Рис. 2. Витискувальний ряд кислот
Відповідь: В.
ТЕМА: Основні класи неорганічних сполук. Солі. Реакції обміну між електролітами у розчині. Явище амфотерності.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Якщо в кожну пробірку добавляти краплями водний розчин натрій гідроксиду спочатку в обох пробірках утворяться осади нерозчинних гідроксидів. Магній гідроксид осно́вний, тому з надлишком лугу не реагуватиме. Натомість осад амфотерного алюміній гідроксиду в надлишку лугу розчиниться.
Суть реакцій, що відбулися, можна описати за допомогою скорочених йонних рівнянь:
Відповідь: А.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
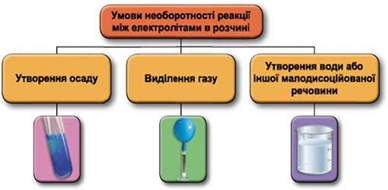
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують барій сульфат і хлоридна кислота – летка хлоридна кислота не витісняє сильну нелетку сульфатну кислоту з її солі – нерозчинного барій сульфату (рис. 2).
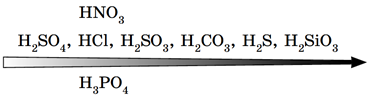
Рис. 2. Витискувальний ряд кислот
У решті поданих варіантів відповіді внаслідок перебігу реакцій між речовинами в розчинах утворюються осади силікатної кислоти (А), ферум(ІІ) гідроксиду (В), барій карбонату (Г).
Відповідь: В.
ТЕМА: Загальна хімія. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
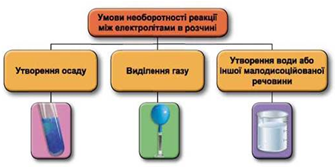
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Між собою у водному розчині не реагують натрій нітрат і калій хлорид, тому що йони, які утворюються внаслідок їхньої дисоціації, не взаємодіють між собою з утворенням слабких електролітів (газу, осаду, води тощо):
| A |
|
| Б |
|
| B |
|
| Г |
|
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині. Йонно-молекулярне рівняння.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині й уміння складати йонно-молекулярні рівняння.
З-поміж карбонатів, які беруть участь у реакції, лише калій карбонат є розчинним і дисоціює у водному розчині на йони (рис. 1).
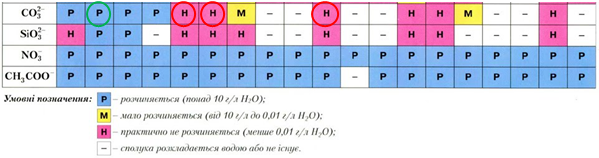
Рис. 1. Розчинність карбонатів Калію, Кальцію, Барію, Феруму(ІІ)
Відповідь: Г.
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
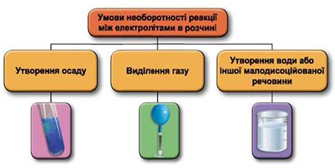
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити катіони Феруму(ІІІ) з водного розчину ферум(ІІІ) нітрату можна гідроксид-аніонами, які утворюються внаслідок електролітичної дисоціації натрій гідроксиду:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
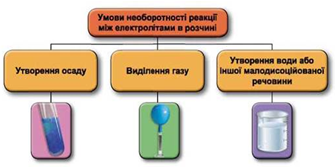
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою барій гідроксид і ферум(ІІІ) хлорид, бо внаслідок взаємодії катіона Феруму(ІІІ) з гідроксид-аніонами утворюється нерозчинний ферум(ІІІ) гідроксид:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
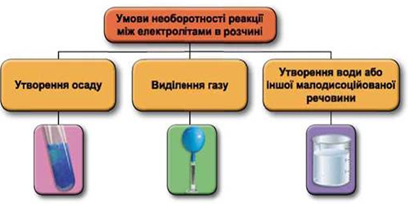
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє хлоридна кислота, яка не реагує з натрій сульфатом і реагує з натрій карбонатом:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
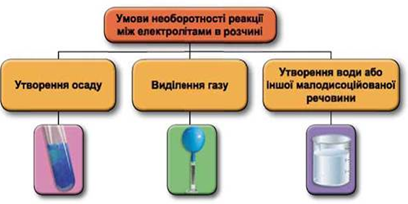
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція між барій гідроксидом і калій сульфатом:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині для розпізнавання деяких йонів за допомогою якісних реакцій.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
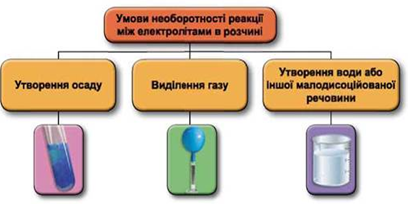
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом.
У цьому контексті реагент – речовина відомого складу, яку використовують для виявлення йонів у складі аналізованої речовини.
Якісні (характерні) реакції супроводжувані добре помітними змінами, як-от: утворення або розчинення осаду, поява інтенсивного забарвлення або знебарвлення розчину, виділення або поглинання газу, утворення кристалів характерної форми тощо. Якісний аналіз у водних розчинах ґрунтується на йонних реакціях і дає змогу виявити катіони або аніони.
Водний розчин натрій хлорид можна відрізнити від водного розчину натрій ацетату за допомогою аргентум(І) нітрату. Катіони Аргентуму(І) із хлорид аніонами утворюють нерозчинний аргентум(І) хлорид – білий сирнистий осад, стійкий до дії нітратної кислоти:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
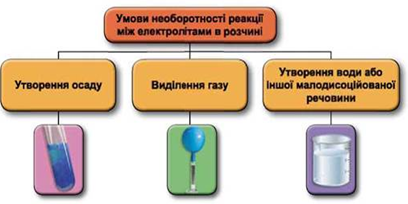
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сіллю Купруму(ІІ) і лугом:
Відповідь: Г.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. За умовою завдання мають прореагувати дві розчинні сполуки, одна з яких дисоціює з утворенням катіона Алюмінію, а друга – з утворенням гідроксид-аніона. Умову завдання задовольняють алюміній нітрат і калій гідроксид:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
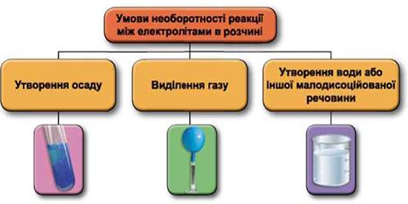
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: B.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
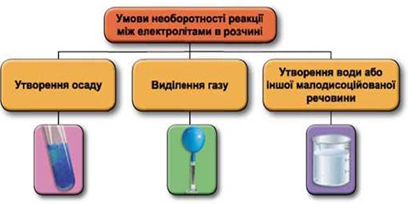
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Реакція у водному розчині відбудеться між натрій сульфатом і барій нітратом:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Луги. Індикатори. Реакція нейтралізації.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації та знання кольорів індикаторів у різних середовищах – лужному, кислому, нейтральному.
У водному розчині калій гідроксиду є гідроксид-аніони, під дією яких фенолфталеїн набуває малинового кольору. Унаслідок поступового додавання хлоридної кислоти відбувається реакція нейтралізації, гідроксид-аніони реагують із катіонами Гідрогену:
Тому учень, який до розбавленого водного розчину калій гідроксиду, підфарбованого фенолфталеїном, поступово добавлятиме хлоридну кислоту, спостерігатиме знебарвлення розчину.
Відповідь: Г.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
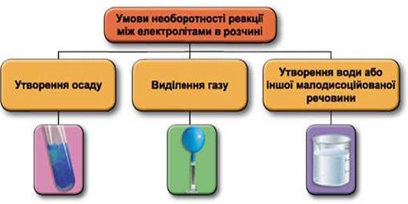
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують купрум(ІІ) сульфат і натрій гідроксид, унаслідок цього утворюється осад купрум(ІІ) гідроксиду:
Відповідь: A.




