Розділ: Речовина
Тема: Розчинення. Розчинність
Кількість завдань: 23
ТЕМА: Температурна залежність розчинності солей. Аналіз графіків.
Завдання скеровано на перевірку вміння тлумачити криві розчинності речовин.
| Варіант відповіді | Формула солі | Температура | Орієнтовна розчинність (із графіка) |
| A | |||
| Б | |||
| B | |||
| Г |
Найбільше значення розчинності – у натрій нітрату за
Відповідь: Г.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння аналізувати криві розчинності солей у воді й обчислювати масу розчину за даними щодо його складників.
За кривою розчинності рубідій нітрату за
Маса розчину дорівнює сумі мас розчинника й розчиненої речовини й становить
Відповідь: 270.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, метану, гідроген хлориду, амоніаку, етену, кисню, азоту, нітроген(I) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).

Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Розчинність речовин, її залежність від різних чинників.
Завдання скеровано на перевірку вміння аналізувати й інтерпретувати подану в графічній формі інформацію щодо залежності розчинності солей від температури.
За кривими розчинності (рис. 1), наведеними в умові завдання, легко визначити, що:
– за температури 40 °С розчинність натрій нітрату більша за розчинність калій нітрату;
– за температури 20 °С розчинність рубідій нітрату не є найбільшою.
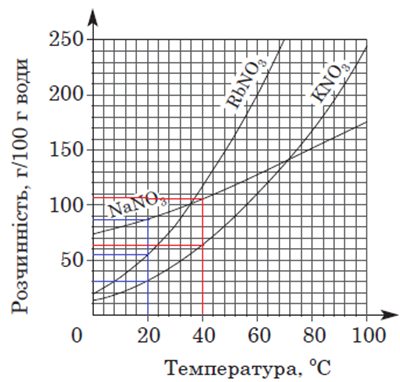
Рис. 1. Криві розчинності нітратів Рубідію, Калію і Натрію
Тобто правильним є лише твердження I.
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Розчинність речовин у воді. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння за хімічною формулою прогнозувати фізичні й хімічні властивості речовини та робити висновки щодо її розчинності у воді.
Щоби правильно розв’язати завдання, потрібно проаналізувати хімічні формули речовин, про які йдеться в завданні, їхні фізичні й хімічні властивості:
A |
нітроген(IV) оксид – |
Б |
гідроген хлорид – |
B |
амоніак – |
Г |
кисень – |
У спосіб, схематично зображений на рисунку, збирають кисень.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Розчинність речовин, її залежність від різних чинників.
Завдання скеровано на перевірку вміння аналізувати й інтерпретувати подану в графічній формі інформацію щодо залежності розчинності солей від температури.
За кривими розчинності, наведеними в умові завдання, легко визначити, що за температури 60 °С в порціях води масою 100 г для отримання насичених розчинів потрібно розчинити калій нітрат масою 110 г і рубідій нітрат масою 200 г (рис. 1).
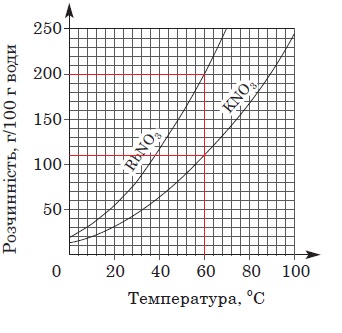
Рис. 1. Криві розчинності нітратів Рубідію і Калію
За умовою завдання для приготування насичених розчинів солей узято їхні наважки масою по 110 г. Тож для приготування насиченого за температури 60 °С розчину калій нітрату потрібно використати воду масою 100 г. Маса виготовленого розчину становить 210 г.
Для приготування насиченого за температури 60 °С розчину рубідій нітрату води масою 100 г достатньо для розчинення солі масою 200 г. Тобто для розчинення рубідій нітрату масою 110 г потрібно використати воду, маса якої трохи більша за 50 г, точніше – 55 г. Тож маса розчину рубідій нітрату дорівнює 165 г, що менше за масу розчину калій нітрату.
Масова частка солі в розчині дорівнює відношенню маси солі до маси розчину. Порівнявши вирази 110/210 і 110/165 легко дійти висновку, що масова частка калій нітрату у його розчині менша за масову частку рубідій нітрату.
Тобто правильним є лише твердження I.
Відповідь: A.
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння аналізувати табличні дані й зіставляти їх із текстовою частиною завдання.
Проаналізуємо табличні дані й зіставимо їх із реченнями, щоб утворилося правильне твердження.
1. З підвищенням температури розчинність речовини … зменшується. Із даних таблиці видно, що лише розчинність речовини Г з підвищенням температури зменшується. Отже, 1Г.
2. За температури 40 °С в насиченому розчині речовини … її маса більша, ніж маса розчинника. Із даних таблиці видно, що за температури 40 °С лише маса речовини Б більша, ніж маса розчинника. Отже, 2Б.
3. Максимальна маса речовини …, яку можна розчинити у воді масою 150 г за температури 20 °С, становить 47,4 г. Маса води в 1,5 раза більше за наведену в таблиці масу води (розчинника), тому й маса солі має бути в 1,5 раза більше за масу розчиненої речовини і становитиме 47,4 г. Із даних таблиці зрозуміло, що за температури 20 °С речовини Б, Г, Д не задовольняють умову завдання (Г і Д набагато менше за вказану масу, Б набагато більше за вказану масу). Для речовини В 1,5 m(речовини) = 1,5 · 36 = 54, не задовольняє умову. Для речовини А 1,5 m(речовини) = 1,5 · 31,6 = 47,4 г, задовольняє умову. Отже, 3А.
Відповідь: 1Г, 2Б, 3А.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, азоту, кисню, метану, бутану, гідроген хлориду, амоніаку, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (рис. 1).
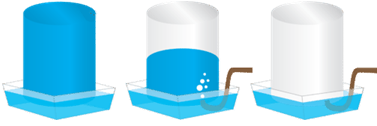
Рис. 1. Збирання газу витісненням води
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Тож умову завдання задовольняє варіант відповіді водень, кисень, пропан, адже ці гази малорозчинні у воді.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку знання властивостей нітроген(IV) оксиду, гідроген хлориду, амоніаку, метану, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
Із-поміж наведених у завданні речовин малорозчинною є лише кисень.
Нітроген(IV) оксид кислотний і реагує з водою, гідроген хлорид і амоніак добре розчиняються в ній.
Відповідь: Г.
ТЕМА: Загальна хімія. Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння аналізувати інформацію щодо розчинності солей, подану в графічній формі.
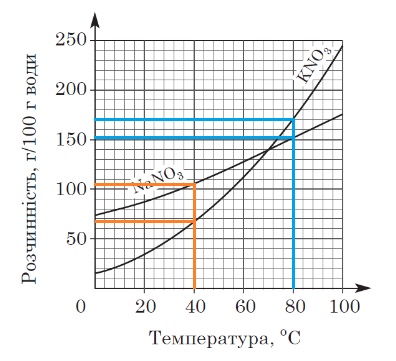
Залежність розчинності речовин від температури виражають за допомогою кривих розчинності. Їх будують за експериментально здобутими даними. Для побудови кривої розчинності відкладають на горизонтальній осі температуру, а на вертикальній – розчинність речовини за відповідної температури.
За результатами аналізування кривих розчинності, наведених в умові завдання, можна дійти висновку, що за температури 40 °С розчинність натрій нітрату більша за розчинність калій нітрату, а за температури 80 °С – навпаки.
Відповідь: Б.
ТЕМА: Розчини. Неорганічна хімія.
Завдання перевіряє знання розчинності газів у воді й способи збирання газів, а саме витисненням води.
Для розв’язання завдання необхідно знати, що гази, які розчиняються у воді, не можна зібрати витисненням води. Нітроген(IV) оксид, гідроген бромід і амоніак – гази, які добре розчиняються у воді, тому зібрати їх витисненням води не можна, а кисень – газ, який погано розчиняється у воді, тому його можна зібрати у такий спосіб.
Відповідь: Г.
ТЕМА: Розчини
Завдання перевіряє знання понять «розчинність», «насичені та ненасичені розчини», розуміння масової частки розчиненої речовини в розчині, уміння визначати масу речовини в розчині, зіставляти отримані дані з табличними даними.
Для розв’язання завдання необхідно розрахувати маси солей у вихідних розчинах, масу води і маси солей в утворених після добавляння відповідних мас солей.
Масова частка речовини – це відношення маси речовини до маси розчину:
із цієї формули можна знайти масу речовини:
Після добавляння до кожного розчину по 5 г солі, маса солей у кожній посудині становить 30 г, маса води не змінюється – по 100 г у кожній посудині. Розчинність – маса речовини, яка може розчинитися в 100 г води з отриманням насиченого розчину, наведена у таблиці. У кожній посудині після проведення досліду по 30 г солі у 100 г води. Не складно зіставити отримані дані з даними таблиці й зробити висновок, що в обох посудинах розчини будуть ненасиченими.
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші. Розчини. Розчинність речовин.
Завдання скеровано на перевірку вміння порівнювати розчинність речовин.
Целюлоза – біополімер, у воді не розчиняється.
Ацетилен – малорозчинний у воді газ.
Кальцій сульфат – малорозчинна речовина, а барій гідроксид – луг, який добре розчиняється у воді. Про це можна дізнатися з таблиці «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С».
Відповідь: B.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей нітроген(IV) оксиду, метану, амоніаку, гідроген броміду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
Із-поміж наведених у завданні речовин лише метан погано розчиняється у воді, тому цей газ збирають її витісненням.
Відповідь: Б.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, метану, гідроген хлориду, амоніаку, етену, кисню, азоту, нітроген(I) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
Із-поміж наведених у завданні речовин добре розчинним є амоніак. Тому його не збирають витісненням води.
Відповідь: A.
ТЕМА: Розчини. Розчинення.
Завдання скеровано на перевірку розуміння природи теплових явищ під час розчинення.
Теплові явища, що супроводжують розчинення речовин, є наслідком взаємодії складників розчину. Молекули води руйнують зв’язки між частинками розчинюваної речовини – молекулами або йонами. Під час цього процесу утворюються продукти приєднання молекул води до частинок розчинюваної речовини – гідрати. На руйнування зв’язків між частинками розчинюваної речовини енергія (
Відповідь: B.
ТЕМА: Дисперсні системи. Розчини. Розчинність речовин.
Завдання скеровано на перевірку розуміння впливу різних чинників на розчинність речовин.
Розчинність залежить від природи розчинюваної речовини й розчинника, температури й (для газуватих речовин) тиску. Розчинність газуватих речовин зменшується зі зниженням тиску.
Відповідь: A.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей амоніаку, гідроген хлориду, нітроген(I) оксиду, нітроген(IV) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (рис. 1).
Рис. 1. Збирання газу витісненням води
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид, амоніак, нітроген(IV) оксид. Тому їх не збирають витісненням води. Нітроген(І) оксид – малорозчинний газ, його можна зібрати витісненням води.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Розчинність речовин.
Завдання скеровано на перевірку знання залежності розчинності речовин від різних чинників.
Розчинність – максимальна маса речовини, яка може за певних умов (температури, тиску) розчинитися в розчиннику масою 100 г. Розчинність залежить від природи розчинюваної речовини та розчинника, температури й (для газуватих речовин) тиску.
Розчинність газів із підвищенням температури зменшується, зі збільшенням тиску – збільшується.
Відповідь: А.
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку вміння пояснювати результати досліду хімічними властивостями амоніаку.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він під дією гідроксид-аніонів набуває малинового кольору. З-поміж речовин, хімічні формули яких наведено в завданні, лише розчин амоніаку у воді має лужне середовище. Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію:
Відповідь: Г.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей амоніаку, гідроген хлориду, нітроген(I) оксиду, нітроген(IV) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею.
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид, амоніак, нітроген(IV) оксид. Тому їх не збирають витісненням води. Метан – малорозчинний газ, його можна зібрати витісненням води.
Відповідь: Г.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, азоту, кисню, метану, бутану, гідроген хлориду, амоніаку, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (рис. 1).
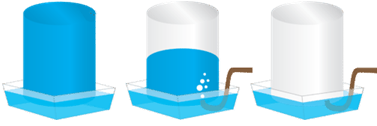
Рис. 1. Збирання газу витісненням води
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Тож умову завдання задовольняє варіант відповіді метан, кисень, азот, адже ці гази малорозчинні у воді.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Розчинність.
Завдання скеровано на перевірку знання впливу різних чинників на розчинність речовин.
Розчинність – це максимальна маса (г) речовини, яка може за певних умов (температури, тиску) розчинитися в розчиннику масою
Розчинність залежить від природи розчинюваної речовини й розчинника, температури й (для газуватих речовин) тиску.
Зі зменшенням тиску розчинність газів у воді зменшується.
На відміну від більшості твердих речовин, розчинність газів у воді зі зростанням температури зменшується.
Відповідь: B.




