Розділ: Обчислення в хімії
Тема: Розв’язування задач за формулами речовин
Кількість завдань: 116
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій ортофосфатної кислоти
\begin{gather*} M_r(\mathrm{H_3PO_4})=3A_r(\mathrm{H})+A_r(\mathrm{P})+4A_r(\mathrm{O});\\[7pt] M_r(\mathrm{H_3PO_4})=3\cdot 1+31+4\cdot 16;\\[7pt] M_r(\mathrm{H_3PO_4})=98;\\[7pt] M_r(\mathrm{H_3PO_4})=98\ \text{г/моль}. \end{gather*}Відповідь: A.
ТЕМА: Загальна хімія. Основні хімічні поняття. Молярна маса. Молярний об’єм.
Завдання скеровано на перевірку розуміння фізичного змісту молярної маси й молярного об’єму.
Молярна маса – маса речовини кількістю \(1\ \text{моль}\).
Молярний об’єм – об’єм речовини кількістю \(1\ \text{моль}\).
Густина речовини – відношення її маси до об’єму.
За нормальних умов \((t=0\ ^\circ\text{C};\ P=10^5\ \text{Па})\) молярний об’єм будь-якого газу становить \(22,4\ \text{л/моль}\).
Частка від ділення середньої молярної маси повітря на молярний об’єм газів (н. у.) – це густина повітря.
Відповідь: A.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати молярну масу за формулою речовини.
Дано:
\(A_r(\mathrm{Ca})=40\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{P})=31\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Ca(H_2PO_4)_2})\ -\ ?\)
Відповідь: 234.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватої речовини за її масою.
Дано:
\(m(\mathrm{SO_2})=320\ \text{г}\)
\(V_m(\mathrm{SO_2})=22,4\ \text{л/моль}\)
\(M(\mathrm{SO_2})=64\ \text{г/моль}\)
Знайти:
\(V(\mathrm{SO_2})\ -\ ?\)
Відповідь: 112.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
\begin{gather*} m(\mathrm{X})=n(\mathrm{X})M(\mathrm{X}). \end{gather*}| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | \(\mathrm{C_2H_6}\) | 30 | 2 | 60 | Г |
| 2 | \(\mathrm{H_2O}\) | 18 | 3 | 54 | A |
| 3 | \(\mathrm{CaO}\) | 56 | 0,25 | 14 | Д |
| 4 | \(\mathrm{NH_3}\) | 17 | 4 | 68 | Б |
Відповідь: 1Г, 2А, 3Д, 4Б.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Кількість речовини дорівнює частці від ділення її маси на молярну масу: $$ n(\mathrm{X})=m(\mathrm{X}):M(\mathrm{X}). $$
За однакової маси кількість речовини в порції збільшується зі зменшенням молярної маси. Тобто розв’язання завдання полягає в розташуванні формул речовин за зменшенням їхніх молярних мас.
| Формула | Молярна маса, г/моль | |
| $$ \mathrm{Cu_2S} $$ | 160 | B |
| $$ \mathrm{CuO} $$ | 96 | Б |
| $$ \mathrm{SO_2} $$ | 64 | A |
| $$ \mathrm{S} $$ | 32 | Г |
Відповідь: В Б А Г.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(\mathrm{D}\) газуватої речовини \(\mathrm{X}\) за газуватою речовиною \(\mathrm{Y}\) дорівнює відношенню густин \(\mathrm{\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}}\) цих газів, виміряних за однакових умов. оскільки молярні об'єми різних газів за однакових умов рівні, відносна густина \(\mathrm{D}\) газуватої речовини \(\mathrm{X}\) за газуватою речовиною \(\mathrm{Y}\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метан | $$ \mathrm{CH_4} $$ | 16 | A |
| Карбон(II) оксид | $$ \mathrm{CO} $$ | 28 | B |
| Кисень | $$ \mathrm{O_2} $$ | 32 | Б |
| Гідроген сульфід | $$ \mathrm{H_2S} $$ | 34 | Г |
Відповідь: А В Б Г.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
\begin{gather*} m(\mathrm{X})=n(\mathrm{X})M(\mathrm{X}). \end{gather*}| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | \(\mathrm{MgO}\) | 40 | 1,5 | 60 | Б |
| 2 | \(\mathrm{O_2}\) | 32 | 0,5 | 16 | A |
| 3 | \(\mathrm{H_2O}\) | 18 | 2 | 36 | Г |
| 4 | \(\mathrm{CaCO_3}\) | 100 | 5 | 500 | B |
Відповідь: 1Б, 2А, 3Г, 4В.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Кількість речовини дорівнює частці від ділення її маси на молярну масу: $$ n(\mathrm{X})=m(\mathrm{X}):M(\mathrm{X}). $$
За однакової маси кількість речовини в порції збільшується зі зменшенням молярної маси. Тобто розв’язання завдання полягає в розташуванні формул речовин за зменшенням їхніх молярних мас.
| Формула | Молярна маса, г/моль | |
| $$ \mathrm{CuO} $$ | 80 | B |
| $$ \mathrm{Cu} $$ | 64 | A |
| $$ \mathrm{O_3} $$ | 48 | Б |
| $$ \mathrm{CH_4} $$ | 16 | Г |
Відповідь: В А Б Г.
ТЕМА: Загальна хімія. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу й порівнювати склад вуглеводнів різних гомологічних рядів.
Послідовність розташування за збільшенням молекулярної маси очевидна з хімічних формул вуглеводнів.
| Вуглеводень | |||
| Назва | Молекулярна формула | Відносна молекулярна маса | |
| пропан | $$ \mathrm{C_3H_8} $$ | 44 | A |
| бутен | $$ \mathrm{C_4H_8} $$ | 56 | B |
| пентин | $$ \mathrm{C_5H_8} $$ | 68 | Г |
| гексин | $$ \mathrm{C_6H_{10}} $$ | 82 | Б |
Відповідь: А В Г Б.
ТЕМА: Обчислення в хімії. Розрахунки за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу речовини за кількістю речовини елемента в ній.
Дано:
\(n(\mathrm{H})=1,2\ \text{моль}\)
\(M(\mathrm{CH_3COOH})=60\ \text{г/моль}\)
Знайти:
\(m(\mathrm{CH_3COOH})\ -\ ?\)
Відповідь: 18.
ТЕМА: Обчислення в хімії. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масову частку кристалізаційної води в кристалогідраті.
Дано:
\(M_r(\mathrm{CuSO_4\cdot 5H_2O})=250\)
\(M(\mathrm{H_2O})=18\)
Знайти:
\(w(\mathrm{H_2O})\ -\ ?\)
Відповідь: 36.
ТЕМА: Загальна хімія. Молярні маса й об’єм. Закон Авогадро.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою, кількістю газуватої речовини та її об’ємом.
Маса речовини дорівнює добутку її кількості на молярну масу: $$ m(\mathrm{X})=n(\mathrm{X})M(\mathrm{X}). $$
Об’єм газу дорівнює добутку її кількості на молярний об’єм: $$ V(\mathrm{Y_{\text{газ}}})=n(\mathrm{Y_{\text{газ}}})V_m(\mathrm{Y_{\text{газ}}}). $$
| Речовина | ||||||
| Формула | Молярна маса, г/моль | Молярний об’єм газу, л/моль | Кількість, моль | Маса (г) чи об’єм (л) | ||
| 1 | $$\mathrm{C_2H_4}$$ | 28 | 22,4 | 0,2 | 5,6 г | A |
| 2 | $$\mathrm{HCl}$$ | 36,5 | 0,5 | 11,2 л | Г | |
| 3 | $$\mathrm{CO_2}$$ | 44 | 5 | 220 г | B | |
| 4 | $$\mathrm{N_2}$$ | 28 | 10 | 224 л | Д | |
Відповідь: 1А, 2Г, 3В, 4Д.
ТЕМА: Загальна хімія. Обчислення в хімії.
Завдання скеровано на перевірку розуміння поняття масової частки хімічного елемента в речовині й уміння її обчислювати.
Масова частка хімічного елемента в речовині – відношення маси елемента в ній до маси речовини.
В усіх поданих формулах речовин по одному атому Нітрогену, тож його масова частка то більша, що менша молярна маса речовини. власне, розв’язання завдання полягає в розташуванні формул за зменшенням молярних мас речовин:
$$ \mathrm{KNO_3;\ \ KNO_2;\ \ NO_2;\ \ NO.} $$Відповідь: Б А Г В.
ТЕМА: Загальна хімія. Обчислення в хімії. Молярна маса.
Завдання скеровано на перевірку розуміння поняття молярної маси й уміння обчислювати її за формулою речовини.
Молярна маса – маса речовини кількістю \(1\) моль. Молярна маса чисельно дорівнює відносній молекулярній масі.
| Речовина | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метаналь | $$ \mathrm{HCHO} $$ | 30 | Г |
| Метанова кислота | $$ \mathrm{HCOOH} $$ | 46 | Б |
| Етанова кислота | $$ \mathrm{CH_3COOH} $$ | 60 | B |
| Гліцин | $$ \mathrm{NH_2CH_2COOH} $$ | 75 | A |
Відповідь: Г Б В А.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за хімічною формулою речовини.
Завдання скеровано на перевірку вміння обчислювати молярну масу за хімічною формулою речовини.
Дано:
\(\mathrm{Ca(H_2PO_4)_2}\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{P})=31\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Ca(H_2PO_4)_2})\ -\ ?\)
Відповідь: 234.
ТЕМА: Обчислення в хімії. Визначення найпростішої формули речовини за масовими частками хімічних елементів у ній.
Завдання скеровано на перевірку вміння визначати найпростішу формулу речовини за масовими частками хімічних елементів у ній.
Дано:
\(\mathrm{C}_x\mathrm{H}_y\mathrm{O}_z\mathrm{N}_g\)
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{N})=14\)
\(w(\mathrm{C})=0,397\)
\(w(\mathrm{H})=0,033\)
\(w(\mathrm{O})=0,106\)
\(w(\mathrm{N})=0,464\)
Знайти:
\(x,\ y,\ z,\ g\ -\ ?\)
Відповідь: 151.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Завдання скеровано на перевірку вміння визначати формулу речовини за даними щодо місця одного з хімічних елементів – її складників – у періодичній системі.
Дано:
\(M_r(\mathrm{E_2O_5})=142\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(Z(\mathrm{E})\ -\ ?\)
Відповідь: 15.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його кількістю речовини.
Дано:
\(n(\mathrm{H_2})=5\ \text{моль}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
Знайти:
\(V(\mathrm{H_2})\ -\ ?\)
Відповідь: 112.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її формулою.
Дано:
\(M(\mathrm{NH_4NO_3})=80\ \text{г/моль}\)
\(A(\mathrm{N})=14\ \text{г/моль}\)
Знайти:
\(w(\mathrm{N})\ -\ ?\)
Відповідь: 35.
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й уміння застосовувати наслідки з нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями:
\begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV ;\\[6pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac{M}{V_m}. \end{gather*}Тобто для розв’язання завдання потрібно порівняти відносні молекулярні маси газів, якими заповнювали колби:
Гази, густина яких більша за густину повітря, збирають у посудину, розташовану отвором угору, а гази, густина яких менша за густину повітря, – у посудину, розташовану отвором униз. З огляду на це умову завдання задовольняє лише варіант відповіді Г, бо:
1) метан (варіанти відповіді А й Б) не збирають у посудину, розташовану отвором угору, а кисень (А) і пропан (В) – у посудину, розташовану отвором униз;
2) густина кисню більша, а метану – менша за густину повітря.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини хімічного елемента за масою сполуки.
Дано:
\(M(\mathrm{N})=14\ \text{г/моль}\)
\(m(\mathrm{N_2O_5})=162\ \text{г}\)
\(M(\mathrm{N_2O_5})=108\ \text{г/моль}\)
Знайти:
\(n(\mathrm{N})\ -\ ?\)
Відповідь: 3.
ТЕМА: Основні хімічні поняття. Моль. Кількість речовини. Число Авогадро.
Завдання скеровано на розуміння взаємозв’язків між кількістю газу, його об’ємом і кількістю структурних і частинок.
Кількість речовини – фізична величина, яка прямо пропорційна кількості структурних одиниць речовини в певній її порції.
Одиниця кількості речовини – моль – це порція речовини, у якій 6,02 · 1023 моль-1 структурних одиниць.
6,02 · 1023 моль-1 – стала Авогадро.
Існує пряма пропорційна залежність між кількістю речовини й кількістю структурних частинок речовини та її (рис. 1).
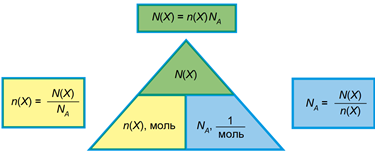
Рис. 1. Взаємозв’язок між кількістю структурних одиниць речовини, її кількістю і сталою Авогадро
Молярний об’єм – об’єм речовини кількістю 1 моль.
Існує пряма пропорційна залежність між об’ємом речовини та її кількістю (рис. 2).
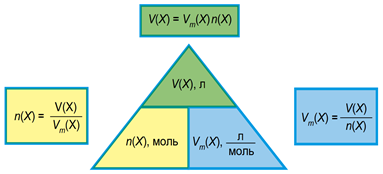
Рис. 2. Взаємозв’язок між об’ємом газу, його кількістю і молярним об’ємом
Якщо стисло:
Відповідь: A.
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й наслідків із нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Оскільки молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями: \begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV;\\[6pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac{M}{V_m}. \end{gather*}
Тобто однакові густини в газів із однаковою молярною масою.
Молярна маса кисню 32 г/моль. Така сама молярна маса в силану \(\mathrm{SiH_4}\).
Відповідь: Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносну густину газу.
Дано:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{CH_4})=75\ \text{%}\)
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{O_2})=25\ \text{%}\)
\(M(\mathrm{CH_4})=16\ \text{г/моль}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(D_{\mathrm{H_2}}(\mathrm{CH_4,\ O_2})\ -\ ?\)
Відповідь: 10.
ТЕМА: Масова частка хімічного елемента.
Завдання скеровано на перевірку розуміння змісту поняття «масова частка хімічного елемента».
Масова частка хімічного елемента – відношення маси хімічного елемента в речовині до маси речовини.
Маса Феруму в усіх речовинах, формули яких наведено, та сама. Тобто потрібно порівняти маси решти хімічних елементів у речовинах.
| А | \(\mathrm{O}\) | 16 | 4 |
| Б | \(\mathrm{SO_4}\) | 32+16· 4 | 1 |
| В | \(\mathrm{Cl_2}\) | 2· 35,5 | 2 |
| 4 | \(\mathrm{S_2}\) | 35· 2 | 3 |
Відповідь: 1Б, 2В, 3Г, 4А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{SO_2})=64\)
\(M_r(\mathrm{He})=4\)
Знайти:
\(D_{He}(\mathrm{SO_2})\ -\ ?\)
\begin{gather*} D_{He}(\mathrm{SO_2})=M_r(\mathrm{SO_2})/M_r(\mathrm{He})\\[7pt] D_{He}(\mathrm{SO_2})=64:4\\[7pt] D_{He}(\mathrm{SO_2})=16. \end{gather*}
Відповідь: 16.
ТЕМА: Відносна густина газів.
Завдання скеровано на перевірку розуміння змісту поняття «відносна густина газу».
Відносна густина першого газу за другим – відношення молярної маси першого газу до молярної маси другого.
Оскільки йдеться про відносну густину газів за тим самим газом, то що більша молярна маса газу, тим більша його відносна густина за гелієм.
| Хімічна формула | Молярна маса (г/моль) | ||
| A | \(\mathrm{C_3H_4}\) | 56 | 4 |
| Б | \(\mathrm{O_2}\) | 32 | 3 |
| B | \(\mathrm{CH_4}\) | 16 | 1 |
| Г | \(\mathrm{N_2}\) | 28 | 2 |
Відповідь: 1В, 2Г, 3Б, 4А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її хімічною формулою.
Дано:
\(M_r(\mathrm{CH_4})=16\)
\(A_r(\mathrm{C})=12\)
Знайти:
\(w(\mathrm{C})\ -\ ?\)
Відповідь: 75.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{N})=14\)
Знайти:
\(M_r(\mathrm{CH_3NHC_2H_5})\ -\ ?\)
Відповідь: 59.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна густина газів.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її відносною густиною.
Дано:
\(M_r(\mathrm{O_2})=32\)
\(D_{\mathrm{O_2}}(X)=2\)
Знайти:
\(M_r(X)\ -\ ?\)
Відповідь: 64.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його масою.
Дано:
\(m(\mathrm{H_2})=5\ \text{г}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
Знайти:
\(V(\mathrm{H_2})\ -\ ?\)
Відповідь: 56.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її кількістю.
Дано:
\(n(\mathrm{P_2O_5})=0,5\ \text{моль}\)
\(M(\mathrm{P})=31\ \text{г/моль}\)
Знайти:
\(m(\mathrm{P})\ -\ ?\)
Відповідь: 31.
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина \(D\) газуватої речовини \(D\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. Оскільки молярні об’єми газів за однакових умов рівні, для порівняння відносних густин газів достатньо порівняти їхні молярні маси, які чисельно дорівнюють відносним молекулярним масам:
\begin{gather*} M_r(\mathrm{H_2S})=34;\ \ M_r(\mathrm{SO_2})=64\\[7pt] M_r(\mathrm{N_2O})=44;\ \ M_r(\mathrm{NO})=30. \end{gather*}Відповідь: 1Г, 2А, 3В, 4Б.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{N})=14\)
Знайти:
\(M_r(\mathrm{H_2N-CH_2COOH})\ -\ ?\)
Відповідь: 75.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна густина газів.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її відносною густиною.
Дано:
\(\left\langle M_r(\text{пов.})\right\rangle=29\)
\(D_{\mathrm{O_2}}(X)=2\)
Знайти:
\(M_r(X)\ -\ ?\)
Відповідь: 58.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Кристалогідрати.
Завдання скеровано на перевірку вміння визначати хімічний склад кристалогідрату.
Дано:
\(M_r(\mathrm{CuSO_4\cdot 5H_2O})=250\)
\(M_r(\mathrm{H_2O})=18\)
Знайти:
\(w(\mathrm{H_2O})\ -\ ?\)
Відповідь: 36.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати кількість речовини газу за його об’ємом.
Дано:
\(m(\mathrm{CO_2})=112\ \text{л}\)
\(V_m(\mathrm{CO_2})=22,4\ \text{л/моль}\)
Знайти:
\(n(\mathrm{CO_2})\ -\ ?\)
Відповідь: 5.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її масою.
Дано:
\(m(\mathrm{NH_4NO_3})=40\ \text{г}\)
\(M(\mathrm{NH_4NO_2})=80\ \text{г/моль}\)
\(M(\mathrm{N})=14\ \text{г/моль}\)
Знайти:
\(m(\mathrm{N})\ -\ ?\)
Відповідь: 14.
ТЕМА: Кількість речовини.
Завдання скеровано на перевірку розуміння змісту поняття кількість речовини.
Маса \(m\) і кількість речовини \(n\) зв’язані формулою $$ n(X)=\frac{m(X)}{M(X)}, $$ де \(M\) – молярна маса речовини, яка чисельно дорівнює його відносній молекулярній масі.
Тобто чим більша відносна молекулярна маса речовини, тим менша її кількість в порції певної маси.
| А | \(M_r(\mathrm{Cu_2S})=2\cdot 64+32\) | 1 |
| Б | \(M_r(\mathrm{CuO})=64+16\) | 2 |
| В | \(M_r(\mathrm{SO_3})=32+2\cdot 16\) | 3 |
| 4 | \(M_r(\mathrm{CH_4})=12+1\cdot 4\) | 4 |
Відповідь: 1А, 2Б, 3В, 4Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм (н. у.) газу певної маси.
Дано:
\(V_m(\mathrm{C_3H_8})=22,4\ \text{л/моль}\)
\(m(\mathrm{C_3H_8})=110\ \text{г}\)
\(M(\mathrm{C_3H_8})=44\ \text{г/моль}\)
Знайти:
\(V(\mathrm{C_3H_8})\ -\ ?\)
Відповідь: 56.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносної густини.
Дано:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{N_2})=50\ \text{%}\)
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{O_2})=50\ \text{%}\)
\(M(\mathrm{N_2})=28\ \text{г/моль}\)
\(M(\mathrm{O_2})=32\ \text{г/моль}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(\left\langle M(\mathrm{N_2,\ O_2})\right\rangle\ -\ ?\)
Відповідь: 15.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{SO_2})=64\)
\(M_r(\mathrm{CH_4})=16\)
Знайти:
\(D_{\mathrm{CH_4}}(\mathrm{SO_2})\ -\ ?\)
Відповідь: 4.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її кількістю.
Дано:
\(M(\mathrm{C})=12\ \text{г/моль}\)
\(n(\mathrm{CaC_2})=0,75\ \text{моль}\)
Знайти:
\(m(\mathrm{C})\ -\ ?\)
Відповідь: 18.
ТЕМА: Обчислення в хімії. Обчислення кількості речовини за її масою.
Завдання скеровано на перевірку знання формул для обчислення кількості речовини.
Кількість речовини – фізична величина, пропорційна кількості частинок (структурних одиниць) у порції речовини. Одиниця кількості речовини – моль.
Умову завдання задовольняє формула $$ n=\frac mM, $$ де \(n\) – кількість речовини (моль), \(m\) – маса речовини (г), \(M\) – молярна маса речовини (г/моль).
Відповідь: B.
ТЕМА: Обчислення в хімії. Молярна маса. Обчислення кількості речовини за її масою.
Завдання скеровано на перевірку вміння обчислювати молярну масу за формулою речовини.
Молярна маса речовини чисельно дорівнює її відносній молекулярній масі.
Відповідь: B.
ТЕМА: Періодична система хімічних елементів. Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Відносна густина газу \(\mathrm{H_2E}\) за воднем 17. Це означає, що його відносна молекулярна маса вдвічі більша за відносну молекулярну масу водню, яка дорівнює 2. Тобто відносна молекулярна маса газу \(\mathrm{H_2E}\) становить 34, відносна атомна маса хімічного елемента \(\mathrm{E}\) – 32. Цей елемент – Сульфур.
Його летка сполука з Гідрогеном – гідроген сульфід – виявляє у водному розчині кислотні властивості й реагує з лугом.
Відповідь: Г.
ТЕМА: Відносна густина газів.
Завдання скеровано на перевірку розуміння змісту поняття «відносна густина газів».
Відносна густина газуватої речовини \(\mathrm{X}\) за газуватою речовиною \(\mathrm{Y}\) дорівнює відношенню їхніх відносних молекулярних і, відповідно, молярних мас. Тобто молярні маси газів, що мають однакову відносну густину за воднем, однакові.
Цю умову задовольняє варіант відповіді А – відносні молекулярні маси азоту й карбон(ІІ) оксиду однакові:
Відповідь: A.
ТЕМА: Обчислення в хімії. Обчислення кількості речовини за її масою.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
\(m(\mathrm{H_2O})=1,8\ \text{кг}\)
\(M(\mathrm{H_2O})=18\ \text{кг/кмоль}\)
Знайти:
\(n(\mathrm{H_2O})\ -\ ?\)
Відповідь: 100.
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій гідрогенкарбонату
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Відносна густина.
Завдання скеровано на перевірку розуміння змісту поняття «Відносна густина газу».
Відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов: $$ D_Y(X)=\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}(X):\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}(X). $$
Відповідно за формулою \(\frac{\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}(\text{пов.})}{\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}(\mathrm{H_2})}\) обчислюють відносну густину повітря за воднем.
Відповідь: A.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини.
Дано:
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{C})=12\)
Знайти:
\(M_r(\mathrm{(CuOH)_2CO_3})\ -\ ?\)
Відповідь: 222.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його масою.
Дано:
\(m(\mathrm{CO_2})=110\ \text{г}\)
\(M(\mathrm{CO_2})=2\ \text{г/моль}\)
\(V_m(\mathrm{CO_2})=22,4\ \text{л/моль}\)
Знайти:
\(V(\mathrm{CO_2})\ -\ ?\)
Відповідь: 56.
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина D газуватої речовини X за газуватою речовиною Y дорівнює відношенню густин ρ цих газів, виміряних за однакових умов. Оскільки молярні об’єми газів за однакових умов рівні, для порівняння відносних густин газів достатньо порівняти їхні молярні маси, які чисельно дорівнюють відносним молекулярним масам: \begin{gather*} M_r(\mathrm{C_2H_2})=26;\ \ M_r(\mathrm{Cl_2})=71;\\[7pt] M_r(\mathrm{CO_2})=44;\ \ M_r(\mathrm{SO_2})=64. \end{gather*}
Відповідь: А, В, Г, Б.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води за масою кристалогідрату.
Дано:
\(m(\mathrm{FeSO_4\cdot 7H_2O})=139\ \text{г}\)
\(M(\mathrm{FeSO_4\cdot 7H_2O})=278\ \text{г/моль}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2O})\ -\ ?\)
Відповідь: 63.
ТЕМА: Органічна хімія. Ізомерія. Гомологія.
Завдання скеровано на перевірку вміння застосовувати знання основних понять органічної хімії для розпізнавання ізомерів і гомологів, порівняння молекулярних і найпростіших формул речовин, їхніх хімічних властивостей.
1 у молекулі речовини І п’ять атомів Карбону, а в молекулі бутану – чотири, тому ці речовини не ізомерні одна одній
2 речовини ІІ і ІІІ мають однакову молекулярну формулу \(\mathrm{C_4H_8}\) за різної будови молекул, тобто є ізомерами
3 у речовини ІІ немає просторових ізомерів, бо лише один вуглеводневий замісник
4 у речовин ІV і V однакова найпростіша формула \(\mathrm{CH}\), тобто однакові масові частки хімічних елементів
5 речовини V і VІ належать до аренів
Відповідь: Б.
ТЕМА: Масова частка хімічного елемента.
Завдання скеровано на перевірку розуміння змісту поняття «масова частка хімічного елемента».
Масова частка хімічного елемента – відношення маси хімічного елемента в речовині до маси речовини.
Маса Цинку в усіх речовинах, формули яких наведено, та сама. Тобто потрібно порівняти маси решти хімічних елементів у речовинах.
| А | \(\mathrm{SO_4}\) | 32 + 16 · 4 | 1 |
| Б | \(\mathrm{CO_3}\) | 12 + 16 · 3 | 2 |
| В | \(\mathrm{O}\) | 16 | 4 |
| 4 | \(\mathrm{S}\) | 32 | 3 |
Відповідь: 1А, 2Б, 3Г, 4В.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{CO_2})=44\)
\(M_r(\mathrm{He})=4\)
Знайти:
\(D_{\mathrm{He}}(\mathrm{CO_2})\ -\ ?\)
Відповідь: 11.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
\(m(\mathrm{H_2})=18\ \text{г}\)
\(V(\mathrm{H_2})+V(\mathrm{N_2})=56\ \text{л}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
\(M(\mathrm{N_2})=28\ \text{г/моль}\)
\(V_m(\mathrm{H_2})=V_m(\mathrm{N_2})=22,4\ \text{л/моль}\)
Знайти:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{H_2})\ -\ ?\)
Відповідь: 80.
ТЕМА: Кількість речовини.
Завдання скеровано на перевірку розуміння змісту поняття «кількість речовини».
Кількість речовини дорівнює частці від ділення маси речовини на її молярну масу. Оскільки маси порцій речовин однакові, то що більша молярна маса речовини, тим менша її кількість у порції.
| А | \(\mathrm{56+32\cdot 2}\) | 1 |
| Б | \(56+16\) | 3 |
| В | \(32+16\cdot 3\) | 2 |
| 4 | \(1\cdot 2+16\) | 4 |
Відповідь: 1А, 2В, 3Б, 4Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу газу за його відносною густиною.
Дано:
\(M_r(\mathrm{O_2})=32\)
\(D_{\mathrm{O_2}}(X)=2\)
Знайти:
\(M(X)\ -\ ?\)
Відповідь: 64.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
\(M(\mathrm{MgO})=40\ \text{г/моль}\)
\(n(\mathrm{MgO})=4,5\ \text{моль}\)
Знайти:
\(m(\mathrm{MgO})\ -\ ?\)
Відповідь: 180.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни. Визначення відносної молекулярної маси речовини за її відносною густиною.
Завдання скеровано на перевірку вміння визначати відносну молекулярну масу речовини за її відносною густиною.
Відносна густина газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню відносних молекулярних мас \(M_r\) цих газів. Для аміну, про який ідеться,
Умову завдання задовольняє метиламін.
Відповідь: Б.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. Оскільки молярні об’єми різних газів за однакових умов рівні, відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Карбон(II) оксид | $$ \mathrm{CO} $$ | 28 | A |
| Нітроген(II) оксид | $$ \mathrm{NO} $$ | 30 | B |
| Карбон(IV) оксид | $$ \mathrm{CO_2} $$ | 44 | Б |
| Нітроген(IV) оксид | $$ \mathrm{NO_2} $$ | 46 | Г |
Відповідь: А В Б Г.
ТЕМА: Обчислення в хімії. Обчислення за хімічною формулою молярної маси речовини.
Завдання скеровано на перевірку вміння обчислювати за хімічною формулою кристалогідрату його молярної маси.
Дано:
\(\mathrm{FeSO_4\cdot 7H_2O}\)
\(A_r(\mathrm{Fe})=56\)
\(A_r(\mathrm{S})=32\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M(\mathrm{FeSO_4\cdot 7H_2O})\ -\ ?\)
Відповідь: 278.
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й уміння застосовувати наслідки з нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями:
\begin{gather*} \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac mV;\\[7pt] \style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}=\frac MV. \end{gather*}Тобто для розв’язання завдання потрібно порівняти відносні молекулярні маси газів із середньою відносною молекулярною масою повітря, яка становить \(29\).
Умову завдання задовольняє кисень, відносна молекулярна маса якого \(32\):
\begin{gather*} M_r(\mathrm{CH_4})=12+4=16\\[7pt] M_r(\mathrm{O_2})=2\cdot 16=32\\[7pt] M_r(\mathrm{H_2})=2\cdot 1=2\\[7pt] M_r(\mathrm{N_2})=2\cdot 14=28 \end{gather*}Відповідь: Б.
ТЕМА: Загальна хімія. Молярна маса.
Завдання скеровано на перевірку знання хімічної формули сульфатної кислоти й уміння обчислювати молярну масу речовини.
Молярна маса речовини чисельно дорівнює її відносній молекулярній масі:
\begin{gather*} M_r(\mathrm{H_2SO_4})=2\cdot 1+16+4\cdot 16=98\\[7pt] M(\mathrm{H_2SO_4})=98\ \text{г/моль} \end{gather*}Відповідь: Г.
ТЕМА: Основні хімічні поняття. Хімічна і графічна формули. Масова частка елемента у сполуці.
Завдання перевіряє розуміння молекулярної і структурної формул речовини та розуміння масової частки елементів без проведення обчислень масової частки кожного хімічного елемента, який входить до складу речовини.
І. Перше твердження є правильним. Для відповіді на це запитання необхідно порахувати число атомів кожного елемента в структурній формулі й зіставити з молекулярною формулою у твердженні І. Формули однакові.
ІІ. Друге твердження є неправильним. Масова частка елемента – це відношення маси атомів елемента в молекулі речовини до молекулярної маси речовини. Тобто \begin{gather*} \mathrm{ w(E)\ =\ \frac{n\ \cdotp\ Ar(E)}{Mr(\text{речовини})}. } \end{gather*}
Під час розрахунку масової частки кожного елемента необхідно масу атомів елемента в молекулі речовини поділити на відносну молекулярну масу речовини, тобто знаменник буде однаковим, і тому достатньо порівняти чисельник. Чисельником є маса атомів елемента в молекулі речовини. Отже, завдання зводиться до того, щоб порівняти маси атомів елемента в молекулі речовини: \begin{gather*} \mathrm{m(C)\ = \ 4\ \cdotp\ 12\ =\ 48;}\\[7pt] \mathrm{ m(H)\ =\ 8\ \cdotp\ 1\ =\ 8;}\\[7pt] \mathrm{m(O)\ =\ 3\ \cdotp\ 16\ =\ 48.} \end{gather*} Як показують елементарні розрахунки, маса атомів Гідрогену в молекулі речовини найменша, тому й масова частка Гідрогену буде найменшою, що суперечить твердженню ІІ.
Відповідь: A.
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки.
Завдання перевіряє знання формули для обчислення маси речовини за її кількістю і вміння застосувати форму для розрахунку; уміння обчислювати молярну масу речовини.
Для розв’язання завдання необхідно застосувати формулу для розрахунку маси речовини за її кількістю.
\begin{gather*} \mathrm{m(MgCO_3)\ =\ n(MgCO_3)\ \cdotp\ M(MgCO_3)\ =\ }\\[1pt] \mathrm{=\ 2,5\ \text{моль}\ \cdotp\ 84\frac{\text{г}}{\text{моль}}\ =\ 210\ \text{г};\ \text{де}} \end{gather*}\(\mathrm{m(MgCO_3)}\) – маса речовини магній карбонату;
\(\mathrm{M(MgCO_3)}\) – молярна маса речовини магній карбонату;
\(\mathrm{n(MgCO_3)}\) – кількість речовини магній карбонату.
Відповідь: 210.
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Молекулярна формула – запис, що показує тип і кількість атомів у молекулі.
За наведеною в умові завдання структурною формулою можна визначити молекулярну, підрахувавши загальну кількість атомів кожного хімічного елемента. Молекулярна формула речовини – \(\mathrm{C_4H_8O_4}.\)
Масова частка хімічного елемента – відношення маси хімічного елемента в речовині до маси речовини. Найпростіша формула цієї речовини – \(\mathrm{CH_2O}.\) Сума відносних атомних мас Карбону й Гідрогену – 14, атомна маса Оксигену ‑ 16. Вочевидь його масова частка в цій речовині найбільша.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(\mathrm{SO_2;\ CH_4}\)
\(M_r(\mathrm{SO_2})=64\)
\(M_r(\mathrm{CH_4})=16\)
Знайти:
\(D_{\mathrm{CH_4}}(\mathrm{SO_2})\ -\ ?\)
\begin{gather*} D_{\mathrm{CH_4}}(\mathrm{SO_2})=M_r(\mathrm{SO_2}):M_r(\mathrm{CH_4})\\[7pt] D_{\mathrm{CH_4}}(\mathrm{SO_2})=64:16=4 \end{gather*}
Відповідь: 4.
ТЕМА: Загальна хімія. Основні хімічні поняття. Речовини. Масова частка елемента у сполуці.
Завдання перевіряє вміння аналізувати формули й визначати масову частку без додаткових розрахунків.
Для виконання завдання необхідно проаналізувати формули наведених речовин за складом. Масова частка елемента – це відношення атомної маси елемента до відносної молекулярної маси речовини з урахуванням числа атомів елемента. \begin{gather*} \mathrm{ w(E) =\frac{n\ \cdotp\ Ar(E)}{Mr( речовини)}. } \end{gather*} У завданні наведено чотири формули сполук Купруму. У всіх сполуках атом Купруму один, тобто в чисельнику буде відносна атомна маса Купруму, а в знаменнику – відповідні молекулярні маси різних речовин. Масова частка Купруму буде найбільшою в речовині з найменшою відносною молекулярною масою. Найменші маси будуть у бінарних сполуках \(\mathrm{CuO}\) і \(\mathrm{CuS.}\) Відносна атомна маса Оксигену менша за відносну атомну масу Сульфуру, тому й відносна молекулярна маса \(\mathrm{CuO}\) менша за відносну молекулярну масу \(\mathrm{CuS.}\)
Отже, масова частка Купруму буде найбільшою в \(\mathrm{CuO}\).
Відповідь: B.
ТЕМА: Обчислення в хімії. Кількість речовини. Моль. Молярний об’єм.
Завдання перевіряє вміння обчислювати кількість речовини (моль) за нормальних умов у певному об’ємі цієї речовини.
Для виконання завдання необхідно знати формулу для розрахунку кількості речовини і молярний об’єм газів за нормальних умов. \begin{gather*} \mathrm{ n(O_2) =\frac{V(O_2)}{V_m} = \frac{560\ \text{л}}{22,4\ \text{л/моль}}\ =\ 25\ \text{моль} } \end{gather*}
Відповідь: 25.
ТЕМА: Обчислення в хімії. Кількість речовини. Моль. Молярна маса.
Завдання перевіряє вміння обчислювати масу речовини за певною кількістю цієї речовини.
Для виконання завдання необхідно знати формулу для розрахунку маси речовини. \begin{gather*} \mathrm{ m(H_2SO_4) = n(H_2SO_4) \cdotp M(H_2SO_4) =}\\[1pt] \mathrm{= 5\ \text{моль} \cdotp 98\frac{\text{г}}{\text{моль}}\ =\ 490\ \text{г}} \end{gather*}
Відповідь: 490.
ТЕМА: Основні хімічні поняття. Хімічна і графічна формули. Масова частка елемента у сполуці.
Завдання перевіряє розуміння молекулярної, структурної і найпростішої формул речовини. Розуміння масової частки елементів, не проводячи обчислень масової частки хімічного елемента, який входить до складу речовини.
І. Перше твердження є правильним. Для ствердження або спростування цього твердження необхідно порахувати число атомів кожного елемента в структурній формулі \( \mathrm{ C_4H_8O_2 }\), що відповідає найпростішій формулі \( \mathrm{ C_2H_4O}\) (індекси можна скоротити на 2).
ІІ. Друге твердження є неправильним. Масова частка елемента – це відношення маси атомів елемента в молекулі речовини до молекулярної маси речовини. Тобто \begin{gather*} \mathrm{ w(E) =\frac{n\ \cdotp\ Ar(E)}{Mr(\text{речовини})}. } \end{gather*}
Під час розрахунку масової частки кожного елемента необхідно масу атомів елемента в молекулі речовини поділити на відносну молекулярну масу речовини, тобто знаменник буде однаковим, і тому достатньо порівняти чисельник. Чисельником є маса атомів елемента в молекулі речовини. Гідроген має найменшу відносну атомну масу \( \mathrm{ Ar(H)=1}\), тому маса атомів Гідрогену в молекулі речовини найменша і масова частка Гідрогену буде найменшою, що суперечить твердженню ІІ.
Відповідь: A.
ТЕМА: Обчислення в хімії.
Завдання перевіряє знання формули розрахунку об’єму через кількість речовини, уміння проводити нескладні обчислення.
Для розв’язання задачі необхідно знати формулу, яка пов’язує кількість речовини з об’ємом за нормальних умов, і зробити нескладні розрахунки.
\begin{gather*} \mathrm{n = \frac{V}{V_m},\ \ V = n \cdotp V_m}\\[1px] \mathrm{V(C_3H_8) = 5\ \text{моль} \cdotp 22,4\frac{\text{л}}{\text{моль}} = 112\ \text{л}}. \end{gather*}Відповідь: 112.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку елемента в речовині за її хімічною формулою.
Дано:
\(\mathrm{NH_4NO_3}\)
\(M_r(\mathrm{NH_4NO_3})=80\)
\(A_r(\mathrm{N})=14\)
Знайти:
\(w(\mathrm{NH_4NO_3})\ -\ ?\)
\begin{gather*} w(\mathrm{NH_4NO_3})=m(\mathrm{N}):m(\mathrm{NH_4NO_3})\\[7pt] w(\mathrm{NH_4NO_3})=2A_r(\mathrm{N}):M(\mathrm{NH_4NO_3})\\[7pt] w(\mathrm{NH_4NO_3})=2\cdot 14:80=0,35\ (35\ \text{%}) \end{gather*}
Відповідь: 35.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
\(m(\mathrm{CH_3COOH})=120\ \text{г}\)
\(M(\mathrm{CH_3COOH})=60\ \text{г/моль}\)
\(M(\mathrm{H})=1\ \text{г/моль}\)
Знайти:
\(n(\mathrm{H})\ -\ ?\)
Відповідь: 8.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
\begin{gather*} m(\mathrm{X})=n(\mathrm{X})M(\mathrm{X}). \end{gather*}| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | \(\mathrm{C_2H_2}\) | 26 | 1,5 | 39 | A |
| 2 | \(\mathrm{H_2S}\) | 34 | 0,5 | 17 | Д |
| 3 | \(\mathrm{MgO}\) | 40 | 0,25 | 10 | Г |
| 4 | \(\mathrm{NH_3}\) | 17 | 2 | 34 | B |
Відповідь: 1А, 2Д, 3Г, 4В.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Кількість речовини дорівнює частці від ділення її маси на молярну масу: $$ n(\mathrm{X})=m(\mathrm{X}):M(\mathrm{X}). $$
За однакової маси кількість речовини в порції збільшується зі зменшенням молярної маси. Тобто розв’язання завдання полягає в розташуванні формул речовин за зменшенням їхніх молярних мас.
| Формула | Молярна маса, г/моль | |
| $$ \mathrm{Tl} $$ | 204 | Б |
| $$ \mathrm{Al_2O_3} $$ | 102 | B |
| $$ \mathrm{H_2S} $$ | 34 | A |
| $$ \mathrm{NH_3} $$ | 17 | Г |
Відповідь: Б В А Г.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(D\) газуватої речовини \(\mathrm{X}\) за газуватою речовиною \(\mathrm{Y}\) дорівнює відношенню густин \(\mathrm{\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}}\) цих газів, виміряних за однакових умов. Оскільки молярні об'єми різних газів за однакових умов рівні, відносна густина \(D\) газуватої речовини \(\mathrm{X}\) за газуватою речовиною \(\mathrm{Y}\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Етен | $$ \mathrm{C_2H_4} $$ | 28 | A |
| Кисень | $$ \mathrm{O_2} $$ | 32 | Г |
| Гідроген хлорид | $$ \mathrm{HCl} $$ | 36,5 | Б |
| Карбон(ІV) оксид | $$ \mathrm{CO_2} $$ | 44 | B |
Відповідь: А Г Б В.
ТЕМА: Обчислення в хімії. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води в кристалогідраті.
Дано:
\(m(\mathrm{CaCl_2\cdot 2H_2O})=294\ \text{г}\)
\(M(\mathrm{CaCl_2\cdot 2H_2O})=147\ \text{г/моль}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2O})\ -\ ?\)
Відповідь: 72
ТЕМА: Неорганічна хімія. Сполуки Силіцію. Силіцій(IV) оксид.
Завдання скеровано на перевірку знання поширеності в природі, будови й застосування силіцій(IV) оксиду.
Умову завдання задовольняє силіцій(IV) оксид, молярна маса якого становить \(60\ \text{г/моль}\):
\begin{gather*} M_r(\mathrm{SiO_2})=A_r(\mathrm{Si})+2A_r(\mathrm{O});\\[7pt] M_r(\mathrm{SiO_2})=28+2\cdot 16;\\[7pt] M_r(\mathrm{SiO_2})=60;\\[7pt] M(\mathrm{SiO_2})=60\ \text{г/моль}. \end{gather*}Відповідь: Г.
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
\begin{gather*} m(\mathrm{X})=n(\mathrm{X})M(\mathrm{X}). \end{gather*}| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | \(\mathrm{CaO}\) | 56 | 1,5 | 84 | Г |
| 2 | \(\mathrm{H_2}\) | 2 | 0,5 | 1 | A |
| 3 | \(\mathrm{H_2O}\) | 18 | 3 | 54 | Д |
| 4 | \(\mathrm{CaCO_3}\) | 100 | 2 | 200 | B |
Відповідь: 1Г, 2А, 3Д, 4В.
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за хімічною формулою.
Завдання скеровано на перевірку вміння розпізнавати аніони за допомогою якісних реакцій та обчислювати молярну масу речовини за хімічною формулою.
Умову завдання задовольняє силікат-аніон. Під дією хлоридної кислоти на розчинний силікат випадає склоподібний осад силікатної кислоти. Осад розчиняється внаслідок нейтралізації кислоти лугом.
\begin{gather*} M(\mathrm{SiO^{2-}_3})=(28+3\cdot 16)\ \text{г/моль}\\[7pt] M(\mathrm{SiO^{2-}_3})=76\ \text{г/моль} \end{gather*}Відповідь: 76.
ТЕМА: Обчислення в хімії. Обчислення відносної молекулярної маси за формулою речовини.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу за формулою речовини.
Дано:
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M_r(\mathrm{(CuOH)_2CO_3})\ -\ ?\)
Відповідь: 222.
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню густин \(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\rho}\) цих газів, виміряних за однакових умов. оскільки молярні об’єми різних газів за однакових умов рівні, відносна густина \(D\) газуватої речовини \(X\) за газуватою речовиною \(Y\) дорівнює відношенню їхніх молекулярних або молярних мас.
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метан | $$ \mathrm{CH_4} $$ | 16 | B |
| Амоніак | $$ \mathrm{NH_2} $$ | 17 | Б |
| Карбон(II) оксид | $$ \mathrm{CO} $$ | 28 | A |
| Карбон(IV) оксид | $$ \mathrm{CO_2} $$ | 44 | Г |
Відповідь: В Б А Г.
ТЕМА: Обчислення в хімії. Обчислення за хімічною формулою молярної маси речовини.
Завдання скеровано на перевірку знання формул кристалогідратів і вміння обчислювати за хімічною формулою кристалогідрату його молярну масу.
Дано:
\(\mathrm{CuSO_4\cdot 5H_2O}\)
\(A_r(\mathrm{Cu})=64\)
\(A_r(\mathrm{S})=32\)
\(A_r(\mathrm{O})=16\)
\(A_r(\mathrm{H})=1\)
Знайти:
\(M(\mathrm{CuSO_4\cdot 5H_2O})\ -\ ?\)
Відповідь: 250.
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за її кількістю.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її хімічною формулою та кількістю.
Дано:
\(M(\mathrm{KCl})=74,5\ \text{г/моль}\)
\(n(\mathrm{KCl})=10\ \text{моль}\)
Знайти:
\(m(\mathrm{KCl})\ -\ ?\)
Відповідь: 745.
ТЕМА: Обчислення в хімії. Обчислення масової частки хімічного елемента в речовині за її формулою.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її формулою.
Дано:
\(M(\mathrm{Fe_2(SO_4)_3})=400\ \text{г/моль}\)
\(M(\mathrm{Fe})=56\ \text{г/моль}\)
Знайти:
\(w(\mathrm{Fe})\ -\ ?\)
Відповідь: 28.
ТЕМА: Розв’язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за об’ємом, який вона має за нормальних умов:
Відповідь: 30.
ТЕМА: Розв'язування задач за хімічними формулами і на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати масу певної кількості речовини:
Відповідь: 400.
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати об’єм (н.у.) газуватої речовини за певною кількістю (моль) атомів елемента – її складника.
1) обчислюємо кількість речовини атомів Нітрогену, яка дана за умовою завдання:
2) з атомів Нітрогену кількістю речовини 2 моль утворюється азот кількістю речовини 1 моль. Визначаємо кількість речовини азоту:
\begin{gather*} \underset{2\ моль}{\overset{1\ моль}{\mathrm{2N}}}\ \rightarrow\ \underset{1\ моль}{\overset{2,5\ моль}{\mathrm{N_2}}} \\[6pt] n(\mathrm{N_2})=\frac12n(\mathrm{N})=\frac12\cdot 5\ \text{моль}=2,5\ \text{моль}. \end{gather*}3) обчислюємо об’єм азоту:
Відповідь: 56.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
\(n(\mathrm{H_2O})=10\ \text{моль}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2O})\ -\ ?\)
$$ m(\mathrm{H_2O})=M(\mathrm{H_2O})n(\mathrm{H_2O}); $$ $$ m(\mathrm{H_2O})=18\ \text{г/моль}\cdot 10\ \text{моль}=180\ \text{г}. $$
Відповідь: 180.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за її об’ємом.
Молярний об’єм газу за нормальних умов (н. у.) становить 22,4 л/моль.
Кількість речовини водню дорівнює частці від ділення його об’єму (н. у.) на молярний об’єм і становить 20 моль.
Дано:
\(V(\mathrm{H_2})=448\ \text{л}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
Знайти:
\(n(\mathrm{H_2})\ -\ ?\)
\begin{gather*} n(\mathrm{H_2})=V(\mathrm{H_2}):V_m(\mathrm{H_2});\\[7pt] n(\mathrm{H_2})=448\ \text{л}: 22,4\ \text{л/моль}=20\ \text{моль}. \end{gather*}
Відповідь: 20.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
\(n(\mathrm{C_2H_6O})=5\ \text{моль}\)
\(M(\mathrm{C_2H_6O})=46\ \text{г/моль}\)
Знайти:
\(m(\mathrm{C_2H_6O})\ -\ ?\)
$$ m(\mathrm{C_2H_6O})=M(\mathrm{C_2H_6O})n(\mathrm{C_2H_6O}); $$ $$ m(\mathrm{C_2H_6O})=46\ \text{г/моль}\cdot 5\ \text{моль}=230\ \text{г}. $$
Відповідь: 230.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M(\mathrm{He})=4\ \text{г/моль}\)
\(M(\mathrm{CO})=28\ \text{г/моль}\)
Знайти:
\(D_{\mathrm{He}}(\mathrm{CO})\ -\ ?\)
\begin{gather*} D_{\mathrm{He}}(\mathrm{CO})=\frac{M(\mathrm{CO})}{M(\mathrm{He})}; \\[1pt] D_{\mathrm{He}}(\mathrm{CO})=\frac{28\ \text{г/моль}}{4\ \text{г/моль}}=7. \end{gather*}
Відповідь: 7.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за її об’ємом.
Дано:
\(V(\mathrm{CH_4})=560\ \text{л}\)
\(V_m(\mathrm{CH_4})=22,4\ \text{л/моль}\)
Знайти:
\(n(\mathrm{CH_4})\ -\ ?\)
\begin{gather*} n(\mathrm{CH_4})=V(\mathrm{CH_4})\ :\ V_m(\mathrm{CH_4}); \\[1pt] n(\mathrm{CH_4})=560\ \text{л}\ :\ 22,4\ \text{л/моль}=25\ \text{моль}. \end{gather*}
Відповідь: 25.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
\(A_r(\mathrm{Na})=23\)
\(A_r(\mathrm{C})=12\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{Na_2CO_3})\ -\ ?\)
Відповідь: 106.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за її об’ємом (н. у.).
Дано:
\(V_m(\mathrm{O_2})=22,4\ \text{л/моль}\)
\(V(\mathrm{O_2})=112\ \text{л}\)
Знайти:
\(n(\mathrm{O_2})\ -\ ?\)
Відповідь: 5.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
\(M(\mathrm{H_2SO_4})=98\ \text{г/моль}\)
\(m(\mathrm{H_2SO_4})=49\ \text{г}\)
Знайти:
\(n(\mathrm{H_2SO_4})\ -\ ?\)
Відповідь: 2.
ТЕМА: Загальна хімія. Хімічна формула. Масова частка хімічного елемента в речовині.
Завдання скеровано на перевірку вміння аналізувати якісний і кількісний склад речовини за її хімічною формулою, інтерпретувати інформацію, подану в графічній формі.
Масова частка хімічного елемента в речовині – це відношення маси хімічного елемента до маси речовини. Чим більша маса елемента в речовині, тим більша його масова частка в ній.
| \(\mathrm{KHCO_3}\) | |||
| \(\mathrm{K}\) | \(\mathrm{H}\) | \(\mathrm{C}\) | \(\mathrm{O}\) |
| 39 | 1 | 12 | 3 · 16 |
Скориставшись даними щодо відносних атомних мас хімічних елементів й індексів у формулі калій гідрогенкарбонату, можна дійти висновку, що масовій частці Карбону на діаграмі відповідає стовпчик B.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
\(\mathrm{NH_4NO_3}\)
\(A_r(\mathrm{N})=14\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(M(\mathrm{NH_4NO_3})\ -\ ?\)
\begin{gather*} M_r(\mathrm{NH_4NO_3})=14+4\cdot 1+14+3\cdot 16\\[7pt] M_r(\mathrm{NH_4NO_3})=80\\[7pt] M(\mathrm{NH_4NO_3})=80\ \text{г/моль}. \end{gather*}
Відповідь: 80.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
\(\mathrm{H_2O}\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{O})=16\)
Знайти:
\(n(\mathrm{H_2O})\ -\ ?\)
\begin{gather*} M_r(\mathrm{H_2O})=2\cdot 1+ 1\cdot 16\\[7pt] M_r(\mathrm{H_2O})=18\\[7pt] M(\mathrm{H_2O})=18\ \text{г/моль}\\[7pt] n(\mathrm{H_2O})=m(\mathrm{H_2O}):M(\mathrm{H_2O})\\[7pt] n(\mathrm{H_2O})=36\ \text{г}:18\ \text{г/моль}\\[7pt] n(\mathrm{H_2O})=2\ \text{моль}. \end{gather*}
Відповідь: 2.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за кількістю атомів хімічного елемента в її молекулі.
Дано:
\(M(\mathrm{CH_3COOH})=60\ \text{г/моль}\)
\(N_A=6,02\cdot 10^{23}\ \text{моль}^{-1}\)
\(N(\mathrm{H})=1,204\cdot 10^{24}\)
Знайти:
\(m(\mathrm{CH_3COOH})\ -\ ?\)
Відповідь: 30.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(\mathrm{CH_3NH_2}\)
\(A_r(\mathrm{N})=14\)
\(A_r(\mathrm{H})=1\)
\(A_r(\mathrm{C})=12\)
Знайти:
\(M_r(\mathrm{CH_3NH_2})\ -\ ?\)
\begin{gather*} M_r(\mathrm{CH_3NH_2})=12+3\cdot 1+14+2\cdot 1\\[7pt] M_r(\mathrm{CH_3NH_2})=31. \end{gather*}
Відповідь: 31.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватої речовини за її кількістю.
Дано:
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
\(n(\mathrm{H_2})=10\ \text{моль}\)
Знайти:
\(V(\mathrm{H_2})\ -\ ?\)
\begin{gather*} V(\mathrm{H_2})=n(\mathrm{H})V_m(\mathrm{H_2})\\[7pt] V(\mathrm{H_2})=224\ \text{л}. \end{gather*}
Відповідь: 224.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Обчислення маси речовини за її кількістю (моль) і молярною масою.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
\(M(\mathrm{Cu})=64\ \text{г/моль}\)
\(M(\mathrm{O})=16\ \text{г/моль}\)
\(n(\mathrm{CuO})=5\ \text{моль}\)
Знайти:
\(m(\mathrm{CuO})\ -\ ?\)
Розв’язання
Відповідь: 400.
ТЕМА: Обчислення в хімії. Обчислення кількості речовини газу за його об’ємом (н. у.).
Завдання скеровано на перевірку вміння застосовувати закон Авогадро й наслідки з нього для обчислення кількості речовини газу за його об’ємом.
Дано:
\(V(\mathrm{C_2H_4})=448\ \text{л}\)
\(V_m(\mathrm{C_2H_4})=22,4\ \text{л/моль}\)
Знайти:
\(n(\mathrm{C_2H_4})\ -\ ?\)
Розв’язання
\begin{gather*} n(\mathrm{C_2H_4})=V(\mathrm{C_2H_4}):V_m(\mathrm{C_2H_4})\\[7pt] n(\mathrm{C_2H_4})=448\ \text{л}:22,4\frac{\text{л}}{\text{моль}}\\[7pt] n(\mathrm{C_2H_4})=20\ \text{моль}. \end{gather*}Відповідь: 20.
ТЕМА: Обчислення в хімії. Обчислення маси за кількістю речовини.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
\(n(\mathrm{C_6H_5OH})=5\ \text{моль}\)
\(M(\mathrm{C_6H_5OH})=94\ \text{г/моль}\)
Знайти:
\(m(\mathrm{C_6H_5OH})\ -\ ?\)
Розв’язання
Відповідь: 470.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку розуміння взаємозв’язку між кількістю (моль), масою й об’ємом речовини, умінням застосовувати закон Авогадро.
Дано:
\(V(\mathrm{H_2})=56\ \text{л}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль (н. у.)}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2})\ -\ ?\)
Розв’язання
Відповідь: 5.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й застосовувати розуміння взаємозв’язку між кількістю (моль), масою і молярною масою речовини.
Дано:
\(m(\mathrm{H_2SO_4})=49\ \text{г}\)
\(M(\mathrm{H_2SO_4})=(2\cdot 1+32+4\cdot 16)\ \text{г/моль}=98\ \text{г/моль}\)
Знайти:
\(n(\mathrm{O})\ -\ ?\)
Розв’язання
\begin{gather*} n(\mathrm{H_2SO_4})=m(\mathrm{H_2SO_4}):M(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4n(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4m(\mathrm{H_2SO_4}):M(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4\cdot 49\ \text{г}:98\ \text{г/моль}\\[7pt] n(\mathrm{O})=2\ \text{моль} \end{gather*}Відповідь: 2.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини. Обчислення кількості речовини за масою.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу, обчислювати молярну масу речовини й кількість речовини за її масою.
Формула озону \(\mathrm{O_3}.\) В молекулі озону три атоми Оксигену, тобто кількість речовини атомів Оксигену втричі більша за кількість речовини озону.
Молярна маса озону \(M\mathrm{(O_3)=3\cdot 16\ \text{г/моль}=48\ \text{г/моль}}.\)
Кількість речовини озону є часткою від ділення маси озону на молярну масу: \begin{gather*} n(\mathrm{O})=3n(\mathrm{O_3})=3m(\mathrm{O_3}):M(\mathrm{O_3})\\[7pt] n(\mathrm{O})=3\cdot 480\ \text{г}:48\ \text{г/моль}\\[7pt] n(\mathrm{O})=30\ \text{моль}. \end{gather*}
Відповідь: 30.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини.
Завдання скеровано на перевірку вміння аналізувати структурну формулу речовини, визначати за нею молекулярну формулу, обчислювати молярну масу речовини.
Аналізування структурної формули дає змогу визначити кількість атомів Карбону, Гідрогену, Оксигену в молекулі речовини й написати молекулярну формулу:
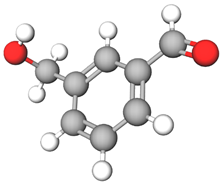
$$ \mathrm{HO-C_6H_4-CH_2OH}\ \text{або}\ \mathrm{C_7H_8O_2.} $$
Відповідь: 124.
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини. Обчислення маси речовини за кількістю. Фенол.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу, обчислювати молярну масу речовини й кількість речовини за кількістю речовини хімічного елемента – її складника.
Формула фенолу \(\mathrm{C_6H_5OH}.\) У молекулі фенолу шість атомів Карбону, тобто кількість речовини фенолу вшестеро менша за кількість речовини атомів Карбону:
Молярна маса фенолу
Маса фенолу є добутком кількості речовини фенолу на його молярну масу:
Відповідь: 47.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння аналізувати якісний і кількісний склад речовини за її моделлю.
Атоми Фосфору в моделі молекули кислоти – дві найтемніші кульки. Атоми Гідрогену в моделі – найменші за розміром кульки. Їх чотири. Решта сім кульок у моделі відповідають атомам Оксигену. Тобто формула кислоти $$ \mathrm{H_4P_2O_7}. $$
Тобто сума індексів дорівнює \(13.\)
Розв’язок може бути ще простішим, без записування формули кислоти: адже кількість атомів у молекулі дорівнює сумі індексів у хімічній формулі.
Відповідь: 13.





