Розділ: Розв’язування задач за формулами речовин
Тема: Розв’язування задач за формулами речовин: комбіновані задачі
Кількість завдань: 20
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння аналізувати якісний і кількісний склад речовини за її моделлю.
Атоми Фосфору в моделі молекули кислоти – дві найтемніші кульки. Атоми Гідрогену в моделі – найменші за розміром кульки. Їх чотири. Решта сім кульок у моделі відповідають атомам Оксигену. Тобто формула кислоти $$ \mathrm{H_4P_2O_7}. $$
Тобто сума індексів дорівнює \(13.\)
Розв’язок може бути ще простішим, без записування формули кислоти: адже кількість атомів у молекулі дорівнює сумі індексів у хімічній формулі.
Відповідь: 13.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й застосовувати розуміння взаємозв’язку між кількістю (моль), масою і молярною масою речовини.
Дано:
\(m(\mathrm{H_2SO_4})=49\ \text{г}\)
\(M(\mathrm{H_2SO_4})=(2\cdot 1+32+4\cdot 16)\ \text{г/моль}=98\ \text{г/моль}\)
Знайти:
\(n(\mathrm{O})\ -\ ?\)
Розв’язання
\begin{gather*} n(\mathrm{H_2SO_4})=m(\mathrm{H_2SO_4}):M(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4n(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4m(\mathrm{H_2SO_4}):M(\mathrm{H_2SO_4})\\[7pt] n(\mathrm{O})=4\cdot 49\ \text{г}:98\ \text{г/моль}\\[7pt] n(\mathrm{O})=2\ \text{моль} \end{gather*}Відповідь: 2.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку розуміння взаємозв’язку між кількістю (моль), масою й об’ємом речовини, умінням застосовувати закон Авогадро.
Дано:
\(V(\mathrm{H_2})=56\ \text{л}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль (н. у.)}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2})\ -\ ?\)
Розв’язання
Відповідь: 5.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за кількістю атомів хімічного елемента в її молекулі.
Дано:
\(M(\mathrm{CH_3COOH})=60\ \text{г/моль}\)
\(N_A=6,02\cdot 10^{23}\ \text{моль}^{-1}\)
\(N(\mathrm{H})=1,204\cdot 10^{24}\)
Знайти:
\(m(\mathrm{CH_3COOH})\ -\ ?\)
Відповідь: 30.
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати об’єм (н.у.) газуватої речовини за певною кількістю (моль) атомів елемента – її складника.
1) обчислюємо кількість речовини атомів Нітрогену, яка дана за умовою завдання:
2) з атомів Нітрогену кількістю речовини 2 моль утворюється азот кількістю речовини 1 моль. Визначаємо кількість речовини азоту:
\begin{gather*} \underset{2\ моль}{\overset{1\ моль}{\mathrm{2N}}}\ \rightarrow\ \underset{1\ моль}{\overset{2,5\ моль}{\mathrm{N_2}}} \\[6pt] n(\mathrm{N_2})=\frac12n(\mathrm{N})=\frac12\cdot 5\ \text{моль}=2,5\ \text{моль}. \end{gather*}3) обчислюємо об’єм азоту:
Відповідь: 56.
ТЕМА: Обчислення в хімії. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води в кристалогідраті.
Дано:
\(m(\mathrm{CaCl_2\cdot 2H_2O})=294\ \text{г}\)
\(M(\mathrm{CaCl_2\cdot 2H_2O})=147\ \text{г/моль}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2O})\ -\ ?\)
Відповідь: 72
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
\(m(\mathrm{H_2})=18\ \text{г}\)
\(V(\mathrm{H_2})+V(\mathrm{N_2})=56\ \text{л}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
\(M(\mathrm{N_2})=28\ \text{г/моль}\)
\(V_m(\mathrm{H_2})=V_m(\mathrm{N_2})=22,4\ \text{л/моль}\)
Знайти:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{H_2})\ -\ ?\)
Відповідь: 80.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{CO_2})=44\)
\(M_r(\mathrm{He})=4\)
Знайти:
\(D_{\mathrm{He}}(\mathrm{CO_2})\ -\ ?\)
Відповідь: 11.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води за масою кристалогідрату.
Дано:
\(m(\mathrm{FeSO_4\cdot 7H_2O})=139\ \text{г}\)
\(M(\mathrm{FeSO_4\cdot 7H_2O})=278\ \text{г/моль}\)
\(M(\mathrm{H_2O})=18\ \text{г/моль}\)
Знайти:
\(m(\mathrm{H_2O})\ -\ ?\)
Відповідь: 63.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його масою.
Дано:
\(m(\mathrm{CO_2})=110\ \text{г}\)
\(M(\mathrm{CO_2})=2\ \text{г/моль}\)
\(V_m(\mathrm{CO_2})=22,4\ \text{л/моль}\)
Знайти:
\(V(\mathrm{CO_2})\ -\ ?\)
Відповідь: 56.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її кількістю.
Дано:
\(M(\mathrm{C})=12\ \text{г/моль}\)
\(n(\mathrm{CaC_2})=0,75\ \text{моль}\)
Знайти:
\(m(\mathrm{C})\ -\ ?\)
Відповідь: 18.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{SO_2})=64\)
\(M_r(\mathrm{CH_4})=16\)
Знайти:
\(D_{\mathrm{CH_4}}(\mathrm{SO_2})\ -\ ?\)
Відповідь: 4.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм (н. у.) газу певної маси.
Дано:
\(V_m(\mathrm{C_3H_8})=22,4\ \text{л/моль}\)
\(m(\mathrm{C_3H_8})=110\ \text{г}\)
\(M(\mathrm{C_3H_8})=44\ \text{г/моль}\)
Знайти:
\(V(\mathrm{C_3H_8})\ -\ ?\)
Відповідь: 56.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її масою.
Дано:
\(m(\mathrm{NH_4NO_3})=40\ \text{г}\)
\(M(\mathrm{NH_4NO_2})=80\ \text{г/моль}\)
\(M(\mathrm{N})=14\ \text{г/моль}\)
Знайти:
\(m(\mathrm{N})\ -\ ?\)
Відповідь: 14.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його масою.
Дано:
\(m(\mathrm{H_2})=5\ \text{г}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
\(V_m(\mathrm{H_2})=22,4\ \text{л/моль}\)
Знайти:
\(V(\mathrm{H_2})\ -\ ?\)
Відповідь: 56.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
\(M_r(\mathrm{SO_2})=64\)
\(M_r(\mathrm{He})=4\)
Знайти:
\(D_{He}(\mathrm{SO_2})\ -\ ?\)
\begin{gather*} D_{He}(\mathrm{SO_2})=M_r(\mathrm{SO_2})/M_r(\mathrm{He})\\[7pt] D_{He}(\mathrm{SO_2})=64:4\\[7pt] D_{He}(\mathrm{SO_2})=16. \end{gather*}
Відповідь: 16.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносну густину газу.
Дано:
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{CH_4})=75\ \text{%}\)
\(\style{font-style:normal;font-weight:bold;font-size:1.1em}{\varphi}(\mathrm{O_2})=25\ \text{%}\)
\(M(\mathrm{CH_4})=16\ \text{г/моль}\)
\(M(\mathrm{H_2})=2\ \text{г/моль}\)
Знайти:
\(D_{\mathrm{H_2}}(\mathrm{CH_4,\ O_2})\ -\ ?\)
Відповідь: 10.
ТЕМА: Основні хімічні поняття. Моль. Кількість речовини. Число Авогадро.
Завдання скеровано на розуміння взаємозв’язків між кількістю газу, його об’ємом і кількістю структурних і частинок.
Кількість речовини – фізична величина, яка прямо пропорційна кількості структурних одиниць речовини в певній її порції.
Одиниця кількості речовини – моль – це порція речовини, у якій 6,02 · 1023 моль-1 структурних одиниць.
6,02 · 1023 моль-1 – стала Авогадро.
Існує пряма пропорційна залежність між кількістю речовини й кількістю структурних частинок речовини та її (рис. 1).
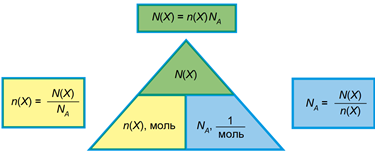
Рис. 1. Взаємозв’язок між кількістю структурних одиниць речовини, її кількістю і сталою Авогадро
Молярний об’єм – об’єм речовини кількістю 1 моль.
Існує пряма пропорційна залежність між об’ємом речовини та її кількістю (рис. 2).
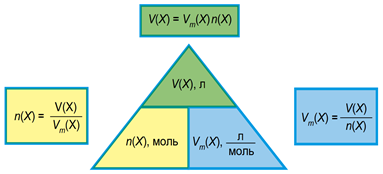
Рис. 2. Взаємозв’язок між об’ємом газу, його кількістю і молярним об’ємом
Якщо стисло:
Відповідь: A.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини хімічного елемента за масою сполуки.
Дано:
\(M(\mathrm{N})=14\ \text{г/моль}\)
\(m(\mathrm{N_2O_5})=162\ \text{г}\)
\(M(\mathrm{N_2O_5})=108\ \text{г/моль}\)
Знайти:
\(n(\mathrm{N})\ -\ ?\)
Відповідь: 3.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватої речовини за її масою.
Дано:
\(m(\mathrm{SO_2})=320\ \text{г}\)
\(V_m(\mathrm{SO_2})=22,4\ \text{л/моль}\)
\(M(\mathrm{SO_2})=64\ \text{г/моль}\)
Знайти:
\(V(\mathrm{SO_2})\ -\ ?\)
Відповідь: 112.





