Розділ: Хімічна реакція
Тема: Тепловий ефект хімічної реакції. Екзо- й ендотермічні реакції
Кількість завдань: 17
ТЕМА: Тепловий ефект хімічної реакції.
Завдання скеровано на перевірку розуміння суті теплового ефекту хімічної реакції, уміння аналізувати графіки.
Унаслідок хімічних реакцій руйнуються зв’язки в речовинах-реагентах, утворюються нові зв’язки, і, як наслідок, – нові речовини. Ці процеси відбуваються з виділенням або поглинанням енергії.
Енергію, виділену або поглинуту системою під час перебігу в ній хімічної реакції, називають тепловим ефектом реакції. Це різниця між внутрішньою енергією продуктів реакції і реагентів.
На графіку тепловому ефекту хімічної реакції відповідає відрізок 2.
Відповідь: Б.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати хімічні рівняння і класифікувати хімічні реакції за різними ознаками.
Реакцію кальцію з водою описують таким хімічним рівнянням: $$ \mathrm{Ca+2H_2O=Ca(OH)_2+H_2\uparrow .} $$
І реагентами, і продуктами реакції є проста і складна речовини. Це реакція заміщення. Унаслідок реакції виділяється теплова енергія, реакція екзотермічна.
Відповідь: Б.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1 у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, під час екзотермічної реакції теплова енергія виділяється – Г
2 у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, під час ендотермічної реакції теплова енергія поглинається – B
3 у реакцію розкладання вступає одна складна речовина, утворюється кілька речовин, під час екзотермічної реакції теплова енергія виділяється – Д
4 у реакцію розкладання вступає одна складна речовина, утворюється кілька речовин, під час ендотермічної реакції теплова енергія поглинається – Б
Відповідь: 1Г, 2В, 3Д, 4Б.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1 \(\mathrm{K\overset{+5}{Cl}\overset{-2}{O}_3\rightarrow K\overset{-1}{Cl}+\overset{0}{O}_2}\) – у реакцію розкладання вступає одна складна речовина, утворюються дві речовини, змінюються ступені окиснення хімічних елементів – B.
2 \(\mathrm{\overset{+1}{Na}_2\overset{-2}{O}+\overset{+1}{H}_2\overset{-2}{O}\rightarrow \overset{+1}{Na}\overset{-2}{O}\overset{+1}{H}}\) – у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, ступені окиснення не змінюються – Д.
3 \(\mathrm{\overset{+4}{N}\overset{-2}{O}_2+\overset{0}{O}_2+\overset{+1}{H}_2\overset{-2}{O}\rightarrow \overset{+1}{H}\overset{+5}{N}\overset{-2}{O}_3}\) – у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, ступені окиснення змінюються – Г.
4 у реакцію розкладання вступає одна складна речовина, утворюються дві речовини, не змінюються ступені окиснення хімічних елементів – A.
Відповідь: 1В, 2Д, 3Г, 4А.
ТЕМА: Хімічні реакції. Хімічні властивості фосфору.
Завдання скеровано на перевірку вміння розпізнавати зовнішні ефекти реакцій за участі фосфору.
Білий фосфор легко окиснюється киснем повітря навіть за звичайної температури. Згоряє білий фосфор з виділенням світла й тепла.
Відповідь: B.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Хімічні властивості натрію.
Завдання скеровано на перевірку знання хімічних властивостей натрію, уміння класифікувати хімічні реакції за кількістю і хімічним складом реагентів і продуктів, а також за тепловим ефектом.
Реакцію натрію з водою можна описати хімічним рівнянням \(\mathrm{2\underline{Na}+2\underline{\underline{H_2O}}=2\underline{\underline{NaOH}}+\underline{H_2}\uparrow,\ }\triangle H\lt 0\).
У реакції як продуктами, так і реагентами є проста і складна речовини, це реакція заміщення, під час якої атоми Натрію заміщують атоми Гідрогену в молекулі води.
Натрій плавиться внаслідок того, що під час реакції виділяється теплова енергія, тобто реакція є екзотермічною.
Відповідь: Б.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Хімічні властивості й застосування кальцій оксиду.
Завдання скеровано на перевірку знання хімічних властивостей і застосування кальцій оксиду, уміння класифікувати хімічні реакції за кількістю і хімічним складом реагентів і продуктів, а також за тепловим ефектом.
Реакцію кальцій оксиду з водою можна описати хімічним рівнянням \(\mathrm{CaO+H_2O=Ca(OH)_2,\ }\triangle H\lt 0\).
У реакції реагентами є дві складні речовини, продуктом – одна складна, це реакція сполучення.
Частина води перетворюється на пару внаслідок того, що під час реакції виділяється теплова енергія, тобто реакція є екзотермічною.
Відповідь: A.
ТЕМА: Обчислення в хімії. Класифікація хімічних реакцій. Екзо- й ендотермічні реакції. Окисно-відновні реакції.
Завдання скеровано на перевірку вмінь класифікувати хімічні реакції та перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
До екзотермічних реакцій із-поміж тих, фрагменти схем яких наведено в умові, належить повне окиснення фосфіну:
$$ \mathrm{ 2\overset{-3}{P}\overset{+1}{H}_3+4\overset{0}{O}_2=\overset{+5}{P}_2\overset{-2}{O}_5+3\overset{+1}{H}_2\overset{-2}{O}} $$ \begin{gather*} \left. \begin{array}{ c c } \overset{0}{\mathrm{O}_2}+4\overline{e}\rightarrow 2\overset{-2}{\mathrm{O}}& \\ \overset{-3}{\mathrm{P}}-8\overline{e}\rightarrow \overset{+5}{\mathrm{P}}& \end{array}\right. \end{gather*}Загальна кількість прийнятих електронів в електронному балансі – \(4\).
Відповідь: 4.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основи. Лужні та лужноземельні метали.
Завдання перевіряє розуміння з опису досліду типів хімічних реакцій, дії лугів на індикатор, фізичних і хімічних властивостей лужних металів.
Речення «Він плавиться, перетворюючись на кульку, яка швидко рухається поверхнею води» говорить про те, що реакція є екзотермічною. Натрій – лужний метал, а лужні метали з водою утворюють луг і при цьому виділяється водень. Про утворення лугу свідчить те, що розчин поступово набуває малинового кольору. Отже, із наведених тверджень правильними є І і ІV.
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі неорганічних речовин, класифікувати хімічні реакції за різними ознаками.
Натрій бурхливо реагує з водою з виділенням великої кількості теплоти й утворенням водню і натрій гідроксиду. Тобто ця реакція є екзотермічною: $$ \mathrm{ 2Na+2H_2O=2NaOH+H_2\uparrow,\ }\triangle H\lt 0. $$
Як реагентами, так і продуктами в цій реакції є одна проста й одна складна речовини. Атоми Натрію заміщують атоми Гідрогену в молекулі води.
Відповідь: A.
ТЕМА: Карбон. Алотропія. Карбон(ІІ) оксид.
Завдання скеровано на перевірку знань про алотропні форми Карбону, хімічні властивості карбон(ІІ) оксиду, уміння розпізнавати екзо- й ендотермічні реакції.
В алмазу – алотропної модифікації Карбону – атомні, а не молекулярні кристалічні ґратки.
Ступінь окиснення атома Карбону в карбон(ІІ) оксиді дорівнює +2, а максимальний ступінь окиснення Карбону – елемента IVА групи – становить +4. Тому карбон(ІІ) оксид виявляє відновні властивості, зокрема й в екзотермічній реакції горіння:
\begin{gather*} \mathrm{2\overset{+2}{C}\overset{-2}{O}+\overset{0}{O}_2=2\overset{+4}{C}\overset{-2}{O}_2},\ \triangle H\lt 0\\[7pt] \mathrm{\overset{+2}{C}-2}\overline{e}\rightarrow\mathrm{\overset{+4}{C}}\ \ \text{відновник, окиснення}\\[7pt] \mathrm{2\overset{0}{O}-4}\overline{e}\rightarrow\mathrm{2\overset{-2}{O}}\ \ \text{окисник, відновлення} \end{gather*}
Відповідь: Б.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за якісним і кількісним складом реагентів і продуктів реакції та тепловим ефектом.
Під час реакції кальцій оксиду з водою частина її перетворилася на пару. Це свідчить про виділення теплоти. Отже, реакція є екзотермічною: $$ \mathrm{CaO+H_2O=Ca(OH)_2,}\ \triangle H\lt 0. $$
Реагентами в цій реакції є дві складні речовини, продуктом – одна складна речовина. Це реакція сполучення.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі неорганічних речовин, класифікувати хімічні реакції за різними ознаками.
Натрій бурхливо реагує з водою з виділенням великої кількості теплоти й утворенням водню і натрій гідроксиду. Тобто ця реакція є екзотермічною: \begin{gather*} \mathrm{2Na+2H_2O=2NaOH+H_2}\uparrow,\ \triangle H\lt 0. \end{gather*}
Атоми Натрію віддають електрони з утворенням катіонів: \begin{gather*} 2\overset{0}{\mathrm{Na}}+2\overset{+1}{\mathrm{H}}_2\mathrm{O}=2\overset{+1}{\mathrm{Na}}\mathrm{OH}+\overset{0}{\mathrm{H}}_2\uparrow ;\\[7pt] \mathrm{NaOH\rightleftarrows Na^+ +OH^-}. \end{gather*}
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення. Тому його можна використати, щоби дослідити середовище розчину, який утворився в посудині після реакції.
Для якісного виявлення водню – одного з продуктів реакції – використати вапняну воду не можна, бо реакція не відбувається. Вапняна вода – насичений розчин кальцій гідроксиду – є реактивом на вуглекислий газ – карбон(ІV) оксид.
Відповідь: A.
ТЕМА: Загальна хімія. Тепловий ефект хімічної реакції. Екзо- й ендотермічні реакції. Оборотні реакції. Хімічна рівновага й умови її зміщення. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за тепловим ефектом й застосовувати принцип Ле Шательє для прогнозування зміщення хімічної рівноваги.
Якщо система в стані рівноваги зазнає певної дії, то рівновага в системі зміститься так, щоби зменшити вплив цієї дії.
Екзотермічна реакція – хімiчне перетворення, за якого зменшується внутрiшня енергiя системи й видiляється тепло, \(\triangle H\lt 0\).
Ендотермічна реакція – хімiчне перетворення, за якого збільшується внутрiшня енергiя системи й поглинається тепло, \(\triangle H\gt 0\).
Оскільки в термохімічному рівнянні, наведеному в умові, зазначено, що \(\triangle H\gt 0\), відповідна хімічна реакція ендотермічна. Тож для визначення правильної відповіді потрібно зробити вибір між варіантами відповіді А і Б.
На зміну об’єму реакції, рівняння якої \(\mathrm{\overset{\text{1 об'єм}}{CO_2}\ (\text{г})+C\ (\text{т})\rightleftarrows \overset{\text{2 об'єми}}{2CO}\ (\text{г})}\), впливають речовини лише в газуватому стані – карбон(IV) оксид і карбон(ІІ) оксид, реакція відбувається зі збільшенням об’єму.
Відповідь: Б.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання класифікації хімічних реакцій за тепловим ефектом і переходом електронів під час їхнього перебігу.
Негашене вапно добувають прожарюванням вапняку. Реакція потребує постійного нагрівання, тобто відбувається із поглинанням теплової енергії. Тому ця реакція – ендотермічна.
Під час реакції ступені окиснення хімічних елементів не змінюються:
$$ \mathrm{\overset{+2}{Ca}\overset{+4}{C}\overset{-2}{O}_3\xrightarrow{\text{нагрівання}} \overset{+2}{Ca}\overset{-2}{O}+\overset{+4}{C}\overset{-2}{O}_2\uparrow,\ \triangle}H\gt 0. $$Відповідь: Б.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Як натрій, так і кальцій є активними металами, реагують iз водою з утворенням відповідного гідроксиду й виділенням газуватого водню. Обидві реакції є екзотермічними, унаслідок їхнього перебігу змінюються ступені окиснення хімічних елементів:
\begin{gather*} \mathrm{2\underline{\overset{0}{Na}}+2\underline{\underline{\overset{+1}{H}_2}}\overset{-2}{O}=2\underline{\overset{+1}{Na}}\overset{-2}{O}\overset{+1}{H}+\underline{\underline{\overset{0}{H}_2}}\uparrow,\ \triangle}H\lt 0;\\[7pt] \mathrm{\underline{\overset{0}{Ca}}+2\underline{\underline{\overset{+1}{H}_2}}\overset{-2}{O}=\underline{\overset{+2}{Ca}}(\overset{-2}{O}\overset{+1}{H})_2+\underline{\underline{\overset{0}{H}_2}}\uparrow,\ \triangle}H\lt 0. \end{gather*}Однак кальцій гідроксид на відміну від натрій гідроксиду є малорозчинним (рис. 1).
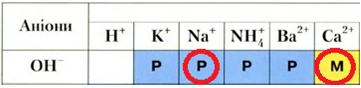
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна реакція. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння аналізувати перебіг і зовнішні ефекти хімічних реакцій, класифікувати реакції за різними ознаками.
Кальцій оксид (негашене вапно) реагує з водою з утворенням кальцій гідроксиду (гашеного вапна):
$$ \mathrm{CaO+H_2O=Ca(OH)_2.} $$З двох складних речовин утворюється одна складна. Це реакція сполучення.
Під час реакції виділяється теплова енергія, унаслідок чого частина води випаровується. Ця реакція екзотермічна.
Ступені окиснення хімічних елементів у цій реакції змін не зазнають.
Відповідь: B.





