Розділ: Будова атома і періодична система хімічних елементів
Тема: Валентність і ступінь окиснення
Кількість завдань: 46
ТЕМА: Окисно-відновні реакції. Ступінь окиснення. Визначення елемента-відновника.
Завдання скеровано на перевірку вміння визначати ступені окиснення елементів у складних речовинах, окисник і відновник у хімічних реакціях.
В амоній нітраті
перший у катіоні
Атом Нітрогену, що міститься в катіоні амонію і має ступінь окиснення
Відповідь: A.
ТЕМА: Окисно-відновні властивості хімічних елементів. Сульфур як окисник і відновник.
Завдання скеровано на перевірку розуміння змін ступенів окиснення Сульфуру в різних сполуках, уміння визначати, у яких речовинах Сульфур може проявляти й окисні, і відновні властивості.
| Формула речовини | Ступінь окиснення Сульфуру | Здатність бути | |
| окисником | відновником | ||
У сульфатній кислоті Сульфур виявляє найвищий ступінь окиснення
У сірці й сульфур(IV) оксиді Сульфур має проміжні ступені окиснення
Відповідь: A.
ТЕМА: Oкиснення і відновлення. Ступені окиснення хімічних елементів.
Завдання скеровано на перевірку знання правил визначення ступеня окиснення хімічних елементів у складних йонах, уміння застосовувати логіку й математичні обчислення для визначення ступенів окиснення.
| Формула йона | ||
| Ступінь окиснення Оксигену в йоні | ||
| Загальний заряд йона | ||
| Обчислення загального заряду складного йона, де |
||
| Обчислення числового значення ступеня окиснення Хлору в складному йоні | ||
| Ступінь окиснення Хлору в складному йоні |
Відповідь: Г.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Ступінь окиснення.
Завдання скеровано на перевірку вміння складати й аналізувати рівняння окисно-відновних реакцій.
Перетворення молекули амоніаку на йон амонію описують схемою:
Ступінь окиснення Нітрогену і в амоніаку, і в катіоні амонію становить
Натомість валентність (кількість спільних електронних пар) в амоніаку дорівнює трьом, а в катіоні амонію – чотирьом.
Тобто внаслідок утворення з амоніаку катіона амонію збільшується значення валентності Нітрогену, а ступінь окиснення цього хімічного елемента не змінюється.
Відповідь: B.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння використовувати знання про закономірності зміни властивостей хімічних елементів у періодичній системі й аналізувати склад і будову їхніх атомів.
А В атомах Флуору й Хлору різна загальна кількість електронів, бо в них різні порядкові номери і, відповідно, протонні числа.
Б Електронегативність Флуору більша, ніж електронегативність Хлору, оскільки в групах хімічних елементів електронегативність зменшується зі збільшенням протонних чисел атомів. Флуор – самий електронегативний елемент.
В Радіус атома Хлору більший, ніж радіус атома Флуору, оскільки в групах зі збільшенням кількості енергетичних рівнів в атомах хімічних елементів збільшується їхній радіус.
Г Окисні властивості хлору виражені слабше, ніж фтору, бо окисні властивості простих речовин галогенів зростають зі збільшенням електронегативності атомів відповідних хімічних елементів.
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати за формулою сполуки ступені окиснення атомів хімічних елементів у ній.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
У сполуках із неметалічними елементами Гідроген має ступінь окиснення +1, ступінь окиснення Оксигену зазвичай дорівнює -2.
Під час визначення ступенів окиснення атомів хімічних елементів в амоній нітраті потрібно взяти до уваги, що це сіль, утворена катіоном амонію і нітрат-аніоном. А катіон амонію – продукт приєднання протона до молекули амоніаку:
Відповідь: Г.
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати ступінь окиснення елементів у речовині.
Зазвичай як ступінь окиснення Натрію, так і Гідрогену в сполуках становить +1, а Оксигену – -2. Ураховуючи, що речовина електронейтральна, складаємо алгебраїчне рівняння і визначаємо ступінь окиснення елемента в сполуці
Відповідь: A.
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати ступінь окиснення елементів у речовині.
Зазвичай ступінь окиснення Натрію в сполуках дорівнює +1, а Оксигену – -2. Ураховуючи, що речовина електронейтральна, складаємо алгебраїчне рівняння й визначаємо ступінь окиснення Брому
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати й порівнювати ступені окиснення атомів за формулами речовин.
Ступінь окиснення елемента – це чисельна величина електричного заряду, приписуваного атому в молекулі, якщо припустити, що електронні пари, які забезпечують зв’язок, повністю зміщені в бік більш електронегативних атомів.
Ступені окиснення атомів Хлору в сполуках, формули яких наведено, такі:
Відповідь: Б Г А В.
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду:
Відповідь: Г А В Б.
ТЕМА: Неорганічна хімія. Ступінь окиснення. Хлор.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Cтупінь окиснення Хлору в калій хлораті становить
Відповідь: A.
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Порядковий номер хімічного елемента в періодичній системі дорівнює його протонному числу й, відповідно, заряду ядра атома. У цьому полягає фізичний зміст порядкового номера хімічного елемента в періодичній системі.
У завданні йдеться про бінарну сполуку Магнію
Умову завдання задовольняє магній оксид
Відповідь: Г.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності й окиснювальних властивостей хімічних елементів у періодах і групах (рис. 1).
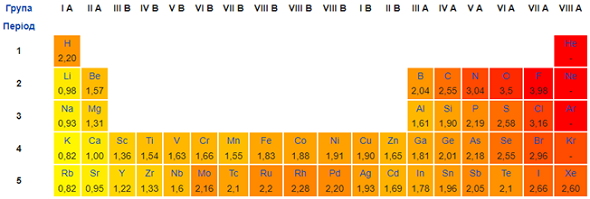
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: В А Г Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Нітрогену більша за електронегативність Гідрогену, Калію, Кальцію. Тому в бінарних сполуках із ними його ступінь окиснення негативний. Електронегативність Хлору більша за електронегативність Нітрогену, тому в бінарній сполуці з Хлором ступінь окиснення Нітрогену позитивний (рис. 1).
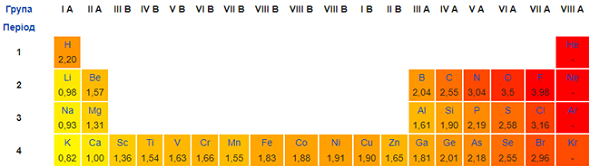
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів другого і третього періодів.
Завдання скеровано на перевірку вміння визначати за формулами речовин ступені окиснення атомів хімічних елементів, прогнозувати їхні окисно-відновні властивості.
A |
|
Б |
|
B |
|
Г |
|
Сульфур – елемент VІа групи, у його атомі на зовнішньому енергетичному рівні 6 електронів. Тобто максимальний ступінь окиснення атомів Сульфуру становить +6 (збігається з номером групи), а мінімальний дорівнює –2 (різниця між номером групи й числом 8).
Тобто атом Сульфуру зі ступенем окиснення +6 може лише приймати електрони й виявляти окисні властивості, а атом Сульфуру зі ступенем окиснення -2 може лише віддавати електрони й виявляти відновні властивості.
Атом Сульфуру зі ступенем окиснення +4 може як віддавати електрони, так і приймати їх:
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно. Ступінь окиснення Нітрогену в молекулі амоніаку й катіоні амонію дорівнює –3. З огляду на це можна визначити ступені окиснення Цирконію:
Вочевидь ступінь окиснення жодного хімічного елемента не змінився.
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі. Електронегативність. Радіус атома.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах зі збільшенням протонних чисел (зверху вниз) радіус атомів хімічних елементів збільшується (рис. 1, 1), а електронегативність (рис. 1, 2) і, відповідно, окисні властивості зменшуються.
Флуор і Хлор – елементи однієї групи, але різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів (рис. 1, 1).
Тобто помилковим є твердження, наведене в рядку A.
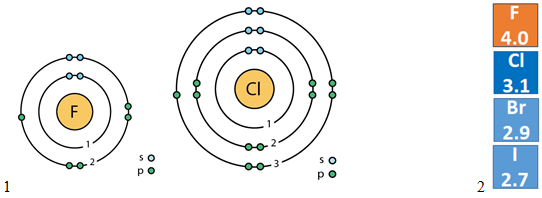
Рис. 1. 1. Будова атомів Флуору і Хлору. 2. Електронегативність галогенів
Відповідь: A.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє розуміння зміни електронегативності, радіуса атома елементів в групі та залежність властивостей елементів від радіуса атома. Зверніть увагу на виділення в умові «ПОМИЛКОВИМ»!
Необхідно розуміти, що в групі радіус атома збільшується, тому електронегативність і окисні властивості зменшується. Номер періоду показує число енергетичних рівнів в атомі. Оксиген (2 період) і Сульфур (3 період) – елементи різних періодів. Тому «ПОМИЛКОВИМ» є твердження Б.
Відповідь: Б.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у групах.
Завдання скеровано на перевірку вміння порівнювати властивості хімічних елементів у групах.
У завданні наведено електронні формули атомів лужних елементів Літію, Натрію, Калію та елемента побічної підгрупи Аргентуму. Відновні властивості – здатність віддавати електрони зовнішнього енергетичного рівня – посилюються зі збільшенням радіуса атома від Літію до Калію. Срібло малоактивний метал, відновні властивості Аргентуму виражені найслабше порівняно з іншими елементами, про які йдеться в завданні.
Відповідь: Г, Б, В, А.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Cолі. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступінь окиснення хімічного елемента за формулою бінарної сполуки.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Хлор у сполуках із металічними елементами виявляє ступінь окиснення -1, відповідно ступінь окиснення металічного елемента становить +3:
Умову завдання задовольняє Алюміній – елемент ІІІА групи, в атомі якого три електрони на зовнішньому енергетичному рівні.
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення Сульфуру однакові в сполуках, формули яких
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Ступінь окиснення.
Завдання скеровано на перевірку вміння складати електронні формули атомів і визначати ступені окиснення атомів хімічних елементів у сполуках.
Ступінь окиснення елемента – це чисельна величина електричного заряду, приписуваного атому в молекулі, якщо припустити, що електронні пари, які забезпечують зв’язок, повністю зміщені в бік більш електронегативних атомів.
В атомі Силіцію – елемента IVА (14) групи – чотири електрони на зовнішньому енергетичному рівні. Завершення зовнішнього енергетичного рівня можливе внаслідок приєднання або втрати чотирьох електронів. Унаслідок чого атом Силіцію набуде ступеня окиснення –4 або +4 відповідно:
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння поняття «валентні електрони» й уміння визначати валентні можливості атомів.
Валентний електрон – електрон, що може утворювати хімічні зв’язки, в атомі, а отже, визначає поведінку атома в хімічних реакціях.
Електронна конфігурація атома Сульфуру
Електронна конфігурація атома Хрому
Сульфур і Хром – елементи різних періодів, у їхніх атомах різна кількість енергетичних рівнів і валентних орбіталей.
У бінарних сполуках із Гідрогеном Сульфур(ІІ) і Хром(ІІ) мають різні ступені окиснення:
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисники й відновники.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, прогнозувати окисні й відновні властивості речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
У карбонат- і нітрат-аніонах атоми Карбону й Нітрогену перебувають у своїх максимальних ступенях окиснення (+4 і +5 відповідно). Тому вони не можуть бути відновниками.
Натомість у сульфіт-аніоні атом Сульфуру перебуває в ступені окиснення +4, тобто може як приймати, так і віддавати електрони, а в сульфід-аніоні ступінь окиснення атома Сульфуру мінімальний (–2), тому він не може приймати електрони, а здатен лише віддавати їх.
Тобто відновні властивості здатні виявляти лише сульфіт- і сульфід-аніони.
Відповідь: Г.
ТЕМА: Сполуки Сульфуру.
Завдання скеровано на перевірку знання властивостей сполук Сульфуру, уміння визначати ступені окиснення хімічних елементів за хімічними формулами.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Ступінь окиснення хімічного елемента в простій речовині дорівнює нулю.
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
A
Б
В
Г
Відповідь: Г, А, Б, В.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно.
Різні ступені окиснення Ферум виявляє у речовині, формула якої
А
Б
В
Г
Відповідь: B.
ТЕМА: Основні хімічні поняття. Валентність.
Завдання скеровано на перевірку вміння визначати валентність за хімічними формулами.
Ступінь окиснення +4 і валентність IV Сульфур виявляє в сульфітній кислоті, формула якої
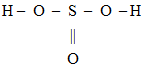
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
А
Б
В
Г
Відповідь: B.
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Відповідь: В.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| А | 2 | |
| Б | 1 | |
| В | 3 | |
| 4 | 4 |
Відповідь: 1Б, 2А, 3В, 4Г.
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками польового шпату є однозарядні катіони Калію, тризарядні катіони Алюмінію, атоми Силіцію зі ступенем окиснення +4, атоми Оксигену зі ступенем окиснення –2:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: A.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками фторапатиту є двозарядні катіони Кальцію, тризарядні фосфат-аніони, однозарядні флуорид-аніони:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Калій. Водень. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей водню і калію та вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| A | |
| Б | |
| B | |
| Г |
Відповідь: А Б В Г.
ТЕМА: Неорганічна хімія. Валентність.
Завдання скеровано на перевірку вміння визначати валентність хімічних елементів за формулами оксидів.
Валентність – властивість атомів. Одиниця валентності – це валентність атома Гідрогену. Найвище значення валентності хімічних елементів – VIII. Існують хімічні елементи зі сталою та змінною валентністю. Максимальне значення валентності елемента збігається з номером його групи в періодичній системі (коротка форма). Винятки – Нітроген, Оксиген, Флуор, Купрум тощо.
Значення валентності неметалічного елемента у сполуці з Гідрогеном або металічним елементом дорівнює різниці між числом VIII і номером відповідної групи. У формулах бінарних сполук першим записують символ металічного елемента. Символ Оксигену у формулах бінарних сполук записують другим, за винятком сполуки з Флуором.
У бінарній сполуці сумарна валентність усіх атомів одного елемента дорівнює сумарній валентності всіх атомів іншого елемента. Оксиген в оксидах двовалентний:
Відповідь: B.
ТЕМА: Неорганічна хімія. Ступінь окиснення. Нітроген.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Нітрогену менша за електронегативність Оксигену й Хлору (рис. 1).
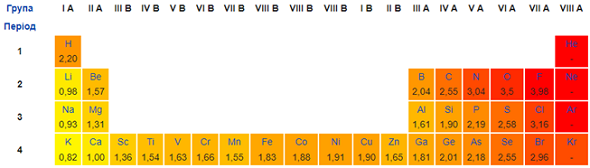
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Cтупені окиснення Нітрогену у зазначених сполуках такі:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Сульфур. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей вуглецю і вміння аналізувати з погляду окиснення-відновлення реакції за його участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Вищий ступінь окиснення +6 Сульфур виявляє в сульфатній кислоті. Тому в цій сполуці Сульфур виявляє лише окисні властивості:
Відповідь: Б.
ТЕМА: Загальна хімія. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння прогнозувати властивості хімічних елементів за їхнім місцем у періодичній системі.
Елемент із протонним числом
Умову завдання задовольняє речовина, формула якої
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Карбон – хімічний елемент IVА підгрупи, у його атомі на зовнішньому енергетичному рівні чотири електрони. Тож максимальний ступінь окиснення
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Нітрогену більша за електронегативність Гідрогену, Літію, Кальцію, Алюмінію (рис. 1).
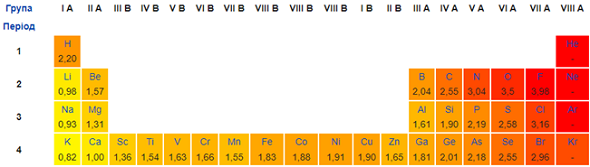
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тому в бінарних сполуках із ними його ступінь окиснення негативний. Найбільша кількість електронів на зовнішньому енергетичному рівні в атома Алюмінію. Тому ступінь окиснення в бінарній сполуці з Нітрогеном буде вищим порівняно з іншими елементами, про які йдеться в завданні:
Відповідь: B.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Брому більша за електронегативність Гідрогену, Літію, Кальцію, Алюмінію (рис. 1).
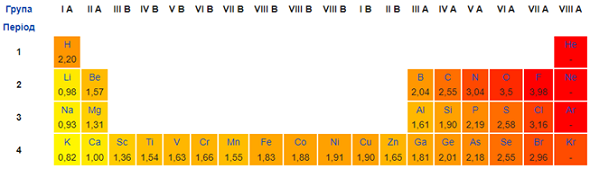
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тому в бінарних сполуках із ними його ступінь окиснення негативний. Найбільша кількість електронів на зовнішньому енергетичному рівні в атома Алюмінію. Тому ступінь окиснення в бінарній сполуці із Бромом буде вищим порівняно з іншими елементами, про які йдеться в завданні:
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
А
Б
B
Г
Відповідь: Г, Б, В, А.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно.
Однакові ступені окиснення Сульфуру в сульфур(IV) оксиді й сульфур(IV) флуориді:
A
Б
B
Г
Відповідь: Б.




