Розділ: Вираження кількісного складу розчину (суміші)
Тема: Вираження кількісного складу розчину (суміші)
Кількість завдань: 74
ТЕМА: Обчислення масової частки речовини в розчині.
Завдання скеровано на перевірку вміння обчислювати масову частку
Рівняння реакції натрій гідроксиду з натрій гідрогенсульфатом:
Маса натрій гідроксиду, який прореагував із натрій гідрогенсульфатом:
Відповідь: 5.
ТЕМА: Середня молярна маса газової суміші. Об’ємне співвідношення компонентів.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу суміші газів за об’ємним співвідношенням складників.
Відповідь: 12.
ТЕМА: Хімічні властивості гідроген пероксиду. Масова частка речовини в розчині.
Завдання скеровано на перевірку вміння обчислювати масу розчину за об’ємом газу, що утворився внаслідок розкладання гідроген пероксиду.
Рівняння реакції розкладання гідроген пероксиду:
За рівнянням:
Відповідь: 68.
ТЕМА: Розчини. Масова частка речовини. Стехіометрія газів.
Завдання скеровано на перевірку вміння обчислювати масу розчину за масовою часткою розчиненої речовини, масу газу за його об’ємом (н. у.).
Відповідь: 15.
ТЕМА: Розчини. Масова частка речовини. Властивості однорідних сумішей.
Завдання скеровано на перевірку розуміння поняття масової частки речовини в розчині.
| Маса води в посудині І | |
| Маса солі в посудині І | |
| Загальна маса розчину в посудині І | |
| Маса розчину, перенесеного в посудину ІІ |
Маса розчинів у посудинах І і ІІ різна (
Маса солі в розчинах І і ІІ різна, бо різна маса цих розчинів.
Маса води в розчинах І і ІІ різна, бо різна маса цих розчинів.
Масова частка солі (відношення маси розчиненої солі до маси розчину) у розчинах І та ІІ однакова, бо розчин ІІ є частиною розчину І.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Розчини. Обчислення масових часток складників розчину.
Завдання скеровано на перевірку вміння аналізувати кількісні дані щодо складу розчину, обчислювати масові частки його складників.
Щоб знайти масову частку натрій гідроксиду в новому розчині після змішування двох розчинів у масовому співвідношенні
За умовою відношення маси першого розчину до другого
Позначмо масу другого розчину
Отже, масова частка натрій гідроксиду в розчині, що утворився, становить
Відповідь: 25.
ТЕМА: Обчислення в хімії. Розчини. Обчислення маси складників розчину.
Завдання скеровано на перевірку вміння аналізувати кількісні дані щодо складу розчину, обчислювати маси його складників.
Загальне співвідношення компонентів у розчині:
маса пропан-2-олу:
маса води:
Разом
Відповідь: 70.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Відповідь: 20.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння аналізувати криві розчинності солей у воді й обчислювати масу розчину за даними щодо його складників.
За кривою розчинності рубідій нітрату за
Маса розчину дорівнює сумі мас розчинника й розчиненої речовини й становить
Відповідь: 270.
ТЕМА: Обчислення в хімії. Обчислення масової частки складника в суміші.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі, застосовувати закон Авогадро й наслідки з нього.
Дано:
Знайти:
Розв’язання
Відповідь: 20.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння аналізувати й обчислювати кількісний склад розчинів.
Дано:
Знайти:
Розв’язання:
Густина води становить 1 г/мл, тобто маса води об'ємом 640 мл дорівнює 640 г.
Позначивши x масу етанолу в розчині, що утворився, маємо:
Маса етанолу об'ємом 200 мл дорівнює 160 г.
Відповідно маса етанолу об'ємом 100 мл удвічі менша:
Відповідь: 80.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння аналізувати й обчислювати кількісний склад розчинів.
Дано:
Знайти:
Розв’язання
Відповідь: 153.
ТЕМА: Обчислення в хімії. Обчислення маси розчинника за відомими масою і масовою часткою в розчині розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу складника розчину.
Дано:
Знайти:
Розв’язання
Відповідь: 340.
ТЕМА: Обчислення в хімії. Розчини.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Знайти:
120 г становить 25 частин, 1 частина – маса другого розчину – 4,8 г
24 частини – маса першого розчину, яка становить 115,2 г.
Відповідь: 8.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку складника суміші газів за його об’ємною часткою.
Дано:
Знайти:
Відповідь: 68.
ТЕМА: Обчислення в хімії. Розчини.
Завдання скеровано на перевірку вміння аналізувати інформацію щодо розчинності солей, подану в графічній формі.
Залежність розчинності речовин від температури виражають за допомогою кривих розчинності. Їх будують за експериментально здобутими даними. Для побудови кривої розчинності відкладають на горизонтальній осі температуру, а на вертикальній – розчинність речовини за відповідної температури.
За результатами аналізування кривої розчинності (рис. 1), наведеної в умові завдання, можна дійти висновку, що за температури 60 °С у воді масою 100 г розчинена сіль масою 200 г.
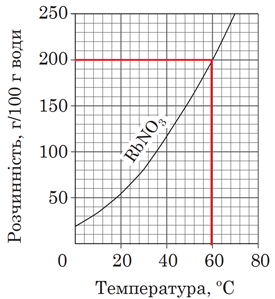
Рис. 1. Крива розчинності рубідій нітрату
Відповідно у воді масою 90 г розчинена сіль масою 180 г. А маса розчину дорівнює сумі мас солі й води. Вона становить 270 г.
Відповідь: 270.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 12.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 28.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількісний склад суміші.
Дано:
Знайти:
Відповідь: 128.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількісний склад суміші.
Дано:
Знайти:
Нехай
Тоді
Відповідь: 150.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількісний склад розчинів.
Дано:
Знайти:
Якщо
Відповідь: 120.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння аналізувати хімічні формули речовин, визначати масові частки речовин у суміші.
Дано:
Знайти:
Кількість речовини атомів Карбону й Оксигену:
Відповідь: 56.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газуватої суміші за об’ємними частками її складників.
Об’ємна частка метану в суміші становить 25 %, відповідно об’ємна частка кисню в ній дорівнює 75 %.
Середню молярну масу
у якій
Дано:
Знайти:
Відповідь: 28.
ТЕМА: Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння обчислювати масову частку речовини в розчині.
Для виконання завдання необхідно знати формулу для обчислення масової частки речовини в розчині.
Відповідь: 15.
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати відносну густину газової суміші за її об’ємним складом.
Для виконання завдання необхідно знати, що таке відносна густина й розуміти, що об’ємна й мольна частка газуватих речовин рівні між собою.
1) нехай
2) обчислюємо масу кожної речовини й масу всієї суміші:
3) обчислюємо відносну густину суміші:
Відповідь: 12.
ТЕМА: Обчислення в хімії. Розчини. Масова частка й маса розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку й масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 100.
ТЕМА: Загальна хімія. Солі. Розчини. Кристалогідрати.
Завдання скеровано на перевірку розуміння поняття масової частки й уміння аналізувати формули кристалогідратів.
Що більша кількість молекул води у формулі кристалогідрату, то менша масова частка розчиненої солі за інших однакових умов.
Відповідь: Б В Г А.
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 30
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 14.
ТЕМА: Розчини. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалогідрату, використаного для приготування розчину.
Дано:
Знайти:
Відповідь: 64.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 126.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші). Масова частка розчиненої речовини
Завдання перевіряє вміння проводити розрахунки для приготування розчинів з певною масовою часткою речовини з концентрованих розчинів.
Під час розбавляння маса розчиненої речовини не змінюється.
1) обчислимо масу лугу в 250 г розчину з масовою часткою лугу 12%:
2) обчислимо масу вихідного розчину (40%), із якого готують 12% розчин:
Відповідь: 75.
ТЕМА: Обчислення в хімії.
Завдання перевіряє вміння обчислювати середню молярну масу суміші газів.
Для розв’язання завдання необхідно розуміти, що середня молярна маса суміші газів – це маса 1 моль суміші газів.
Нехай кількість суміші газів дорівнює 1 моль:
Кількість речовини суміші 1 моль, тому маса, яку ми обчислили, і є молярною масою.
Відповідь: 17.
ТЕМА: Обчислення в хімії.
Завдання перевіряє вміння розраховувати кількісний склад суміші.
Для виконання завдання необхідно розуміти, як визначити масу речовини за кількістю цієї ж речовини, уміти розв’язувати елементарні математичні рівняння.
Нехай
тоді
Відповідь: 14.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші). Масова частка розчиненої речовини.
Завдання перевіряє вміння обчислювати масу води, яку потрібно добавити до розчину певної маси з певною масовою часткою розчиненої речовини для приготування розчину із заданою масовою часткою речовини.
Для виконання завдання необхідно знати, що масова частка розчиненої речовини – це відношення маси речовини до маси розчину і розуміти, що під час розбавлення маса розчиненої речовини не змінюється.
Відповідь: 200.
ТЕМА: Обчислення в хімії. Середня молярна маса суміші газів.
Завдання перевіряє вміння обчислювати середню молярну масу суміші газів.
Для виконання завдання необхідно розуміти, що середня молярна маса суміші газів – це відношення маси газів до кількості речовини газів.
Відповідь: 11.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 90.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’ємну частку складника в газовій суміші.
Дано:
Знайти:
Відповідь: 60.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання перевіряє вміння виконувати обчислення для добування розчину певної масової частки розчиненої речовини.
Для розв’язання завдання необхідно розуміти, що при змішуванні розчину і води маса розчиненої речовини не змінюється, тобто маса речовини в концентрованому і розбавленому розчинах однакова.
1) обчислюємо масу розчиненої речовини (сульфатної кислоти) в розчині, який необхідно добути:
2) обчислюємо масу першого розчину:
Відповідь: 60.
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки.
Завдання перевіряє вміння обчислювати середню молярну масу суміші газів.
Для розв’язання завдання необхідно знати, що молярна маса суміші – це відношення маси суміші до кількості речовин у суміші:
Якщо об’ємне співвідношення 3:1, то і мольне співвідношення таке саме 3:1.
Нехай кількість речовини кисню становить 3 моль
1) обчислюємо загальну кількість речовин у суміші:
2) обчислюємо маси речовин кисню і азоту і масу суміші:
3) обчислюємо молярну масу суміші:
Відповідь: 31.
ТЕМА: Обчислення в хімії. Суміші. Розчини. Визначення кількісного складу розчину.
Завдання скеровано на перевірку вміння визначати кількісний склад розчину.
Дано:
Знайти:
Відповідь: 100.
ТЕМА: Загальна хімія. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку розуміння поняття масової частки розчиненої речовини й розчинника.
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину:
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку розуміння поняття масової частки розчиненої речовини й розчинника.
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину. У завданні ідеться про розчин із масовою часткою йоду
Відповідь: Б.
ТЕМА: Обчислення в хімії. Розчини. Масова частка й маса розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку й масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 200.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 340.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносну густину газу.
Дано:
Знайти:
Відповідь: 10.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 40.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати кількісний склад газової суміші за її масою й об’ємом.
Дано:
Знайти:
Відповідь: 20.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 175.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 80.
ТЕМА: Обчислення в хімії. Обчислення маси розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 161.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 25.
ТЕМА: Обчислення в хімії. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу складника розчину за його масовою часткою.
Дано:
Знайти:
Відповідь: 640.
ТЕМА: Обчислення в хімії. Обчислення об’ємної частки газу в суміші.
Завдання скеровано на перевірку вміння обчислювати об’ємну частку газу в суміші.
Дано:
Знайти:
Відповідь: 25.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 18
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 20.
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини за її масою і масою води.
Дано:
Знайти:
Відповідь: 10.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 118.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші й відносної густини.
Дано:
Знайти:
Відповідь: 15.
ТЕМА: Обчислення в хімії. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку складника розчину за його кількістю речовини й масою води.
Дано:
Знайти:
Відповідь: 20.
ТЕМА: Обчислення в хімії. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу складника розчину за його масовою часткою.
Дано:
Знайти:
Відповідь: 81.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 11.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 37.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 6.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її формулою.
Дано:
Знайти:
Відповідь: 45.
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 5.
ТЕМА: Розчини. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалогідрату, використаного для приготування розчину.
Дано:
Знайти:
Відповідь: 143.
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 150.
ТЕМА: Обчислення в хімії. Суміші. Обчислення кількісного складу суміші.
Завдання скеровано на перевірку вміння обчислювати кількісний склад суміші газів.
Дано:
Знайти:
Відповідь: 25.
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 10.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 8.




