Розділ: Молекулярна фізика і термодинаміка
Тема: Основи молекулярно-кінетичної теорії
Кількість завдань: 83
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Середня квадратична швидкість теплового руху молекул. Ізопроцеси в газах.
Завдання скеровано на перевірку знання і розуміння ізопроцесів у газі, а також уміння визначати зміну характеристик ідеального газу під час переходу його з одного стану в інший.
Відповідно до графіка абсолютна температура
Як випливає із закону Ґей-Люссака, за незмінного тиску об’єм
Отже, якщо за умовою абсолютна температура газу знизиться, то і його об’єм зменшиться.
Щодо середньої квадратичної швидкості теплового руху молекул.
Квадратний корінь із середнього квадрата швидкості називають середньою квадратичною швидкістю руху молекул
Середній квадрат швидкості
Залежність середньої кінетичної енергії поступального руху молекул ідеального газу від абсолютної температури
Прирівняймо обидва вирази для визначення середньої кінетичної енергії поступального руху молекул ідеального газу:
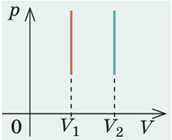
Проаналізуймо зміну
середня квадратична швидкість
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основні положення молекулярно-кінетичної теорії. Маса і розмір молекул.
Завдання скеровано на перевірку знання і розуміння основних положень молекулярно-кінетичної теорії.
Скраплення газу ‒ це перетворення газу на рідину, тобто зміна агрегатного стану.
Отже, під час скраплення хімічний склад газу не змінюється, тому молекули не можуть об’єднуватися, утворюючи молекули іншої речовини.
Також молекули не можуть ні зменшуватися, ні збільшуватися, оскільки за одним із основних положень молекулярно-кінетичної теорії частинки речовини взаємодіють одна з одною. Основна причина міжмолекулярної взаємодії ‒ електричне притягання і відштовхування заряджених частинок, що утворюють атом.
На відстанях, які більші за розміри молекул, молекули притягуються одна до одної; на відстанях, які трохи менші за розміри молекул, ‒ відштовхуються. Ці сили не впливають на розміри молекул, змінюються лише проміжки між молекулами.
Отже, під час скраплення молекули газової суміші не змінюються.
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Температура. Рівняння стану ідеального газу. Ізопроцеси.
Завдання скеровано на перевірку розуміння поняття середньої кінетичної енергії хаотичного руху молекул, а також розуміння процесів, що відбуваються з газом.
Середня кінетична енергія
Також середня кінетична енергія поступального руху молекул ідеального газу прямо пропорційна абсолютній температурі
Під час ізохорного охолодження температура зменшуватиметься, відповідно середня кінетична енергія хаотичного руху молекул газу теж зменшуватиметься.
Ізотермічне стискання відбувається за сталої температури. Отже, середня кінетична енергія хаотичного руху молекул газу не зростатиме.
У ході адіабатного розширення, відповідно до першого закону термодинаміки, газ виконує додатну роботу внаслідок зменшення внутрішньої енергії, а температура газу зменшується. Тобто середня кінетична енергія хаотичного руху молекул газу зменшуватиметься.
Під час ізобарного розширення передана газу кількість теплоти витрачається і на збільшення внутрішньої енергії газу, і на виконання механічної роботи. Якщо збільшується внутрішня енергія, то й температура збільшуватиметься. Тому середня кінетична енергія хаотичного руху молекул газу зростатиме.
Відповідь: Г.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основні положення молекулярно-кінетичної теорії та дослідне обґрунтування їх.
Завдання скеровано на перевірку знання і розуміння означення теплового руху.
Будь-яке тіло складається зі структурних одиниць (атомів, молекул, йонів), які невпинно хаотично (безладно) рухаються. Цей рух називають тепловим.
А Зміна із часом положення тіла в просторі відносно інших тіл ‒ це механічний рух.
Б Рух, який виникає внаслідок зміни температури тіла ‒ це може бути зміна об’єму тіла внаслідок нагрівання чи охолодження (як наприклад, рух рідини у довгій тонкій трубці термометра чи секції мосту змикаються під час спеки й розходяться під час морозів).
В Безперервний, хаотичний рух частинок, із яких складається тіло ‒ тепловий рух.
Г Упорядкований рух частинок, з яких складається тіло ‒ це може бути частково правильне визначення електричного струму, якщо частинки будуть зарядженими й будуть упорядковано рухатися під дією електричного поля.
Отже, правильна відповідь ‒ В.
Відповідь: B.
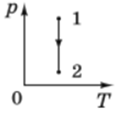
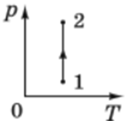
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку розуміння макроскопічних параметрів, якими описують стан ідеального газу, і вміння інтерпретувати їх графічно.
Зміну станів газу описують рівнянням Клапейрона:
Графік 1 відповідає ізохорному охолодженню (
Графік 3 відповідає ізотермічному стисканню (
Під час процесів 2 і 4 змінюються і об’єм, і температура. Під час процесу 4 хоча температура й знижується, але об’єм збільшується, тому тиск також знижуватиметься. Отже, цей процес не може бути ізобарним.
Графік 2 відповідає ізобарному охолодженню (об’єм зменшується пропорційно до зниження температури, отже,
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Квантова фізика.
Завдання скеровано на перевірку розуміння фізичного змісту фізичних сталих.
Розв’язання завдання потребує знання визначень фізичних величин і вміння аналізувати розмірності.
Розмірність сталої Авогадро –
Стала Авогадро – це число, що відповідає кількості атомів (молекул) у будь-якій речовині кількістю
Розмірність сталої Больцмана
Сталу Больцмана використовують для встановлення зв’язку між середньою кінетичною енергією руху молекул і температурою ідеального газу:
Якщо температура змінюється, то змінюється і середня кінетична енергія молекул:
Звідси можна виразити сталу Больцмана:
Розмірність сталої Планка –
За гіпотезою Планка молекули випромінюють енергію порційно, і кількість цієї енергії пропорційна до частоти випромінювання:
Відповідно стала Планка
Гравітаційна стала фігурує в законі Всесвітнього тяжіння:
Якщо маса обох тіл становить 1 кг, відстань між ними – 1 м, то
Тож сила взаємодії таких тіл за модулем дорівнює гравітаційній сталій.
До того ж сила має розмірність
Відповідь: 1Б, 2А, 3Г, 4В.
ТЕМА: Молекулярна фізика і термодинаміка. Ізопроцеси.
Завдання скеровано на перевірку розуміння зв’язку між макроскопічними й мікроскопічними параметрами ідеального газу.
Концентрацію визначають за формулою
Тоді, якщо за сталої маси концентрація залишається незмінною, то й об’єм у такому процесі не змінюється.
Середню кінетичну енергію молекул можна визначити за формулою
Що вища температура, то вищий середній квадрат швидкості молекул. Тож, щоб у газі певної маси концентрація молекул залишалася сталою, а їхня середня кінетична енергія зростала, газ потрібно ізохорно нагрівати.
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Основи термодинаміки. Рівняння стану ідеального газу.
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі з використання рівняння стану ідеального газу.
Об’єм, температура й тиск газу пов’язані між собою рівнянням стану ідеального газу:
З рівняння стану ідеального газу можна виразити тиск
За графіком (рис. 1) можна визначити тиск та об’єм у точках 1 і 2. На графіку не вказано одиниці вимірювання, тож вважатимемо, що 1 клітинка вздовж осі
Тоді для точок 1 і 2 об’єм і температура дорівнюють:
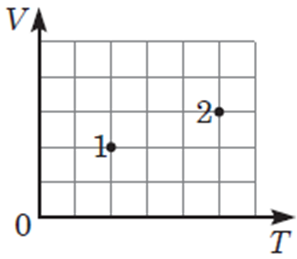
Рис. 1. Графік у координатах
Можна визначити тиск у точках 1 і 2 в умовних одиницях тиску (у. о. тиску):
Відповідь: B.
ТЕМА: Основи термодинаміки. Тепловий рух.
Завдання скеровано на перевірку розуміння поняття броунівського руху.
Броунівський рух – хаотичний рух видимих у мікроскоп малих макрочастинок, завислих у рідині або газі, який відбувається під дією ударів молекул рідини або газу.
Тобто рух броунівської частинки (як наприклад частинка пилу чи квіткового пилку) залежить від руху молекул рідини чи газу, у яких вони перебувають. Молекули зіштовхуються з броунівською частинкою під час теплового руху і передають їй частину свого імпульсу.
Імпульс визначають за формулою
Тоді швидкість частинки можна визначити за формулою
Що швидше рухаються молекули, то частіше вони зіштовхуються з броунівською частинкою, і тим більший імпульс вона отримує, а отже більшою буде її швидкість.
Окрім того, що менша маса частинка, то більшою буде її швидкість за однакового переданого імпульсу.
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Ізопроцеси.
Завдання скеровано на перевірку вміння застосовувати закон Бойля – Маріотта.
Дано:
Знайти:
Для того, щоби правильно аналізувати зміни всіх фізичних величин, потрібно використати рівняння Клапейрона:
Згідно нього добуток тиску на об’єм, поділений на температуру, залишається сталим під час переходу зі стану 1 у стан 2.
Для ізотермічного процесу рівняння Клапейрона спрощують і перетворюють на рівняння, яким описують закон Бойля – Маріотта:
Якщо
Після переведення всіх одиниць в одиниці системи СІ:
Відповідно
Відповідь: 12.
ТЕМА: Молекулярна фізика і термодинаміка. Рівняння стану ідеального газу.
Завдання скеровано на перевірку вміння застосовувати рівняння стану ідеального газу.
1. Дано:
1. Знайти:
Температура
Для початкового стану можна записати рівняння
Тобто
2. Знайти:
Кількість речовини пов’язана з її масою формулою
Після обчислення різниці в кількості речовини у двох станах можна обчислити й різницю мас газу. Аналогічно до
Тоді
Відповідь: 1. 40. 2. 0,8.
ТЕМА: Властивості газів, рідин і твердих тіл. Насичена й ненасичена пара.
Завдання скеровано на перевірку розуміння механізмів переходу від ненасиченої до насиченої пари.
Насичена пара – це пара, яка перебуває в динамічній рівновазі зі своєю рідиною.
Тобто об’єм випаруваної за певний проміжок часу рідини дорівнюватиме об’єму сконденсованої пари. У насиченій парі найвища можлива за певної температури концентрація молекул.
Що вища температура, то вища й концентрація молекул рідини в повітрі, за якої пара є насиченою.
Щоби перетворити водяну пару в повітрі під поршнем на насичену, потрібно або збільшити концентрацію молекул води в повітрі, або знизити температуру.
Концентрацію визначають за формулою
Якщо не додавати нової води в повітря, концентрацію можна збільшити лише якщо зменшити об’єм посудини.
А під час ізотермічного розширення температура повітря залишається сталою, а його об’єм збільшується, отже концентрація молекул води в повітрі зменшується – пара не може стати насиченою
Б під час ізохорного охолодження об’єм повітря залишається незмінним, а температура знижується. У такому разі концентрація молекул у повітрі не змінюється, але концентрація молекул, що відповідає насиченій парі – зменшується, отже за достатнього охолодження пара може стати насиченою
В під час ізобарного нагрівання і об’єм повітря, і температура збільшуються, отже концентрація молекул зменшується і збільшується концентрація, необхідна для того, щоби пара стала насиченою. За таких умов пара не може стати насиченою
Г під час ізохорного нагрівання об’єм повітря, а отже й концентрація молекул залишається сталою, а температура знижується. У такому разі концентрація молекул, що відповідає насиченій парі, збільшується, тож пара насиченою стати не може
Відповідь: Б.
ТЕМА: Основи термодинаміки. Внутрішня енергія і способи її змінення. Способи теплопередачі.
Завдання скеровано на перевірку розуміння механізмів конвекції.
Конвекція – це вид теплопередачі, за якого тепло переносять потоки рідини або газу.
Речовини у твердому стані не мають потоків, тому конвекція в них неможлива.
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Рівняння стану ідеального газу.
Завдання скеровано на перевірку вміння використовувати рівняння стану ідеального газу в розрахункових задачах.
Дано:
Знайти:
Якщо вважати повітря ідеальним газом, то тиск, температуру й об’єм повітря пов’язує рівняння стану ідеального газу
Об’єм м’яча і його температура залишаються незмінними, але змінюються тиск і маса газу всередині:
Тоді можна визначити відношення кінцевого й початкового тисків:
Масу й об’єм пов’язує густина
За 11 циклів накачування всередину потрапило
Тоді
Відповідь: 120
ТЕМА: Молекулярна фізика і термодинаміка. Рівняння стану ідеального газу.
Завдання скеровано на перевірку вміння користуватися графіками для визначення макроскопічних параметрів газу й використовувати це для розв’язування розрахункових задач.
Температура
Тож тиск можна визначити за значеннями об’єму й температури. Оскільки кількість речовини
Масштаб на графіках невідомий, тому точно тиск визначити неможливо, але можна порівняти його в різних варіантах, прийнявши, що клітинка вздовж осі
Можна визначити об’єм і температуру для варіантів відповіді, поданих у завданні:
A |
2 | 1 |
Б |
5 | 2 |
B |
2 | 4 |
Г |
5 | 5 |
Після цього можна розрахувати тиск:
Тож найвищий тиск у точці B.
Відповідь: B.
ТЕМА: Основи молекулярно-кінетичної теорії. Маса й розмір молекул.
Завдання скеровано на оцінку розуміння відмінності між фізичними й хімічними явищами в молекулярній фізиці.
Під час зміни макроскопічних параметрів (температури, об’єму чи тиску) хімічний склад речовини не змінюється. Молекули – це найменші частинки речовини, носії її хімічних властивостей.
Тому, якщо хімічний склад речовини не змінюється, то й самі молекули також не змінюються.
Відповідь: Б.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси
Завдання скеровано на оцінювання вміння аналізувати графіки ізопроцесів і будувати їх у різних системах координат.
Процес 1–2 є ізохорним (тиск
об’єму
Процес 2–3 – ізобарним (температура
Відповідно в координатах
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Ізопроцеси в газах. Робота в термодинаміці.
Завдання скеровано на оцінювання вміння аналізувати графіки ізопроцесів.
1. Знайти:
За графіком на рисунку можна визначити типи процесів:
1–2 – ізобарне охолодження;
2–3 – ізохорне нагрівання.
Робота у довільному термодинамічному процесі можна обчислити як площу криволінійної трапеції під графіком залежності
Оскільки процес 2–3 – ізохорний, то
2. Дано:
Знайти:
Оскільки процес 2–3 ізохорний, то
Для процесу 1–2 за законом Гей-Люссака
За графіком можна визначити, що
Тоді
Відповідь: 1. 0. 2. 48.
ТЕМА: Вимірювальні пристрої.
Завдання скеровано на оцінювання вміння добирати вимірювальні прилади для проведення експериментів.
A. Оскільки період – це час, за який тіло робить одне повне коливання, то для його вимірювання використовують секундомір.
Б. Для визначення електрорушійної сили (ЕРС) і внутрішнього опору джерела потрібно скористатися законом Ома для повного кола. ЕРС в цьому разі є еквівалентом напруги в законі Ома для ділянки кола, тому її також вимірюють вольтметром.
В. Для визначення фокусної відстані й оптичної сили лінзи потрібно виміряти відстань від предмета до лінзи й від лінзи до зображення. Для цього використовують лінійку.
Г. Для визначення коефіцієнта корисної дії (ККД) похилої площини необхідно обчислити корисну роботу, яку розраховують як зміну потенціальної енергії початкового й кінцевого стану й витрачену роботу, що робчислюють за формулою
Д. Для вивчення теплового балансу під час змішування води різної температури потрібно зафіксувати початкові й кінцеву температури. Для цього використовують термометр.
Відповідь: 1Г, 2Б, 3А, 4Д.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси.
Завдання скеровано на оцінювання вміння аналізувати графіки ізопроцесів і будувати їх у різних системах координат.
Рівняння стану ідеального газу
З огляду на це рівняння за результатами аналізування графіків, поданих у завданні, можна дійти висновків, що процес 1–2 є ізобарним (сталий тиск, температура підвищується), 2–3 є ізохорним (сталий об’єм, температура знижується), 3–4 є ізобарним (сталий тиск, температура знижується), 4–1 є ізотермічним (стала температура).
Наступним кроком є аналіз процесів, зображених у координатах
Найбільших змін зазнав графік процесу 4–1, адже в координатах
Такому опису відповідає лише графік на рисунку A.
Відповідь: A.
ТЕМА: Молекулярна фізика й термодинаміка. Основи термодинаміки. Рівняння стану ідеального газу.
Завдання скеровано на оцінювання вміння розв’язувати розрахункові задачі на використання рівняння стану ідеального газу.
Дано:
Знайти:
Температура, тиск і об’єм газу пов’язані між собою рівнянням стану ідеального газу:
Об’єм кімнати не змінився після підключення опалення, тож можна записати рівняння стану ідеального газу для стану до нагрівання і після:
Зважаючи на те, що
Тоді
Після цього можна обчислити, на скільки змінилася кількість молекул:
Відповідь: 3.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси.
Завдання скеровано на оцінювання вміння розв’язувати задачі на аналіз графіків ізопроцесів і побудову їх у різних системах координат.
Для правильного розв’язання задачі передовсім потрібно пригадати графіки ізопроцесів (рис. 1):
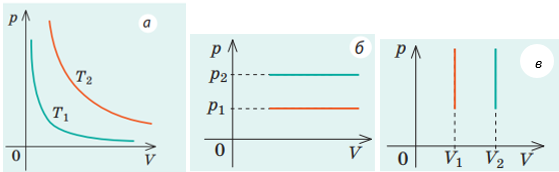
Рис. 1. Графіки ізопроцесів у координатах
Важливо пам’ятати, що ізотерма може мати лише таку орієнтацію! Далі потрібно розглянути кожну послідовність із завдання і нарисувати графіки процесів.
Для правильного аналізування змін усіх фізичних величин потрібно пригадати рівняння Клапейрона:
Із цього випливає, що добуток тиску на об’єм, поділений на температуру залишається сталим під час переходу зі стану 1 у стан 2.
Під час ізохорного нагрівання за рівнянням Клапейрона
За умовою
Ізобарне стискання можна зобразити прямою 2 на рисунку 2
З останньої точки попереднього процесу до початкової точки можна провести ізотерму (крива 3), отже газ можна повернути в початковий стан такою послідовністю процесів.
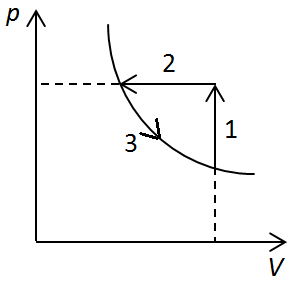
Рис. 2. Графік процесів із перебігу 1
Під час ізохорного нагрівання за рівнянням Клапейрона
За умовою
Ізобарне збільшення об’єму можемо зобразити прямою 2 на рисунку 3.
З останньої точки попереднього процесу до початкової точки не можна провести ізотерму (крива 3 не перетинає початкову точку), отже газ не можна повернути в початковий стан такою послідовністю процесів.
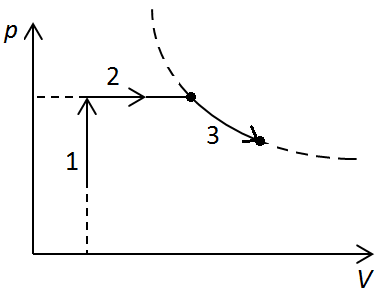
Рис. 3. Графік процесів із перебігу 2
Ізобарне стискання можна зобразити прямою 1 на рисунку 4.
Під час ізохорного охолодження за рівнянням Клапейрона
За умовою
З останньої точки попереднього процесу до початкової точки не можна провести ізотерму (крива 3 не перетинає початкову точку), отже газ не можна повернути в початковий стан такою послідовністю процесів.
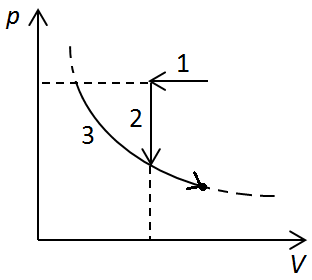
Рис. 4. Графік процесів із перебігу 3
Ізобарне збільшення об’єму можемо зобразити прямою 1 на рисунку 5.
Під час ізохорного охолодження за рівнянням Клапейрона:
За умовою
З останньої точки попереднього процесу до початкової точки можна провести ізотерму (крива 3), отже газ можна повернути в початковий стан такою послідовністю процесів.
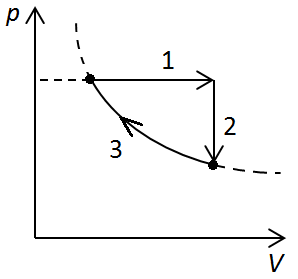
Рис. 5. Графік процесів із перебігу 4
Відповідь: B.
ТЕМА: Молекулярна фізика й термодинаміка. Рівняння стану ідеального газу. Ізопроцеси в газах.
Завдання скеровано на оцінювання розуміння закономірностей зміни тиску, об’єму й температури на основі аналізу результатів експерименту, зображених на рисунку.
За рисунком легко визначити, що об’єм кульки збільшився після того, як вона опинилася під ковпаком, до якого підключено насос. Ні охолоджувальних, ні нагрівальних пристроїв немає, тому температура газу всередині кульки залишається сталою. До того ж, оскільки кулька зав’язана, можна вважати, що кількість речовини всередині неї стала. За законом Бойля – Маріотта добуток тиску на об’єм до поміщення кульки під ковпак і після має бути однаковим:
Оболонка кульки еластична, тож унаслідок наповнювання повітрям вона змінюватиме свій об’єм доти, доки тиск усередині кульки не дорівнюватиме тиску ззовні.
Тому, якщо об’єм кульки збільшився, то тиск усередині – зменшився, а отже зменшився і тиск навколо (під ковпаком).
Відповідь: A.
ТЕМА: Вимірювальні пристрої.
Завдання скеровано на оцінювання розуміння фізичних принципів роботи вимірювальних пристроїв.
Термометр – це прилад для вимірювання температури. Він працює завдяки тому, що деякі речовини за сталого тиску суттєво змінюють свій об’єм за зміни температури (ртуть чи спирт розширюються за збільшення температури і звужуються за її зменшення).
Психрометр – це прилад для вимірювання відносної вологості. Принцип його роботи такий: у корпусі приладу є два термометри. Кінець одного з них зазвичай обгорнутий вологою тканиною. Вода з тканини завжди випаровується, і швидкість випаровування залежить від вологості повітря навколо. Відповідно, для вимірювання відносної вологості фіксують покази сухого й вологого термометрів і за допомогою спеціальних таблиць виконують необхідні розрахунки.
Барометр – це прилад для вимірювання атмосферного тиску. У завданні зображено безводний барометр (анероїд). На рисунку 1 зображено конструкцію такого приладу. Усередині анероїда є камера з гофрованою поверхнею (1), із якої відкачано повітря. За високого атмосферного тиску кришка коробки сильно опускається, а за низького – піднімається. До кришки за допомогою пружини кріпиться стрілка (2). Тому, коли кришка камери піднімається чи опускається, пружина деформується, і стрілка починає рухатись по шкалі (3).
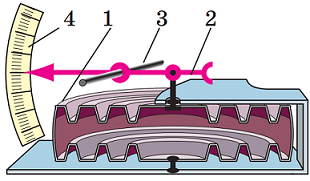
Рис. 1. Конструкція барометра-анероїда
Динамометр – це прилад для вимірювання сили. Зазвичай динамометр складається із пружини і шкали. Коли на кінець пружини діє сила, то за законом Гука пружина розтягується:
Тому, якщо відомий коефіцієнт жорсткості k пружини, то за значенням її видовження x можна визначити й силу, що його спричиняє.
Відповідь: B.
ТЕМА: Молекулярна фізика і термодинаміка. Основи МКТ. Ідеальний газ. Ізопроцеси в газах.
Завдання скеровано на перевірку вміння розв'язувати задачі на аналіз графіків ізопроцесів і побудову їх у різних системах координат.
Графік на рисунку відповідає ізобарному процесу бо тиск
Відповідь: B.
ТЕМА: Молекулярна фізика і термодинаміка. Основні положення МКТ.
Завдання скеровано на перевірку вміння розрізняти різні агрегатні стани речовини й робити узагальнення щодо властивостей речовин у різних агрегатних станах.
Швидкість дифузії залежить тільки від агрегатного стану за інших однакових умов, тому найбільша швидкість дифузії в газах між парою ефіру й повітрям.
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи МКТ. Основне рівняння МКТ.
Завдання скеровано на перевірку вміння розв'язувати розрахункові задачі, застосовуючи функціональні залежності між основними фізичними величинами.
У герметично закритому балоні
За законом Шарля:
Відповідь: B.
ТЕМА: Молекулярна фізика та термодинаміка. Основи термодинаміки. Рівняння стану ідеального газу.
Завдання скеровано на оцінювання вміння розв’язувати розрахункові задачі з використанням рівняння стану ідеального газу.
Дано:
Знайти:
Рівняння стану ідеального газу таке:
Тоді, після переведення всіх фізичних величин в одиниці СІ,
Відповідь: 5.
ТЕМА: Молекулярна фізика і термодинаміка. Основи термодинаміки.
Завдання скеровано на розуміння суті адіабатного процесу.
Оскільки зміна внутрішньої енергії відбувається без передавання теплоти ззовні, то описаний процес – адіабатний.
Відповідь: Г.
ТЕМА: Вимірювальні пристрої.
Завдання скеровано на оцінювання розуміння фізичних принципів роботи вимірювальних пристроїв.
Термометр – це прилад для вимірювання температури. Він працює завдяки тому, що деякі речовини за сталого тиску суттєво змінюють свій об’єм за зміни температури (ртуть чи спирт розширюються за підвищення температури та звужуються за її зниження).
Динамометр – це прилад для вимірювання сили. Зазвичай складники динамометра – пружина та шкала. Коли на кінець пружини діє сила, то, за законом Гука, пружина розтягується.
Барометр – це прилад для вимірювання атмосферного тиску. У завданні зображено безводний барометр (анероїд), усередині якого є вакуумна камера з гофрованою поверхнею. За високого атмосферного тиску кришка коробки сильно опускається, а за низького – піднімається. До кришки за допомогою пружини прикріплена стрілка. Тому, коли кришка камери піднімається чи опускається, пружина деформується і стрілка починає рухатися по шкалі.
Електрометр – це прилад для виявлення та вимірювання заряду. Його складники – металева куля, стержень і стрілки. Під дією електричного поля в стержні, стрілці й кулі відбувається перерозподіл зарядів. Оскільки вони з’єднані, то заряджаються однаково. Однойменно заряджені стрілка та стержень відштовхуються, тому рухома стрілка відхиляється.
Відповідь: A.
ТЕМА: Кількість речовини.
Завдання скеровано на перевірку розуміння поняття кількості речовини.
Кількість речовини можна визначити за формулою
Нехай кількість речовини озону становить
Відповідь: B.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси.
Завдання скеровано на оцінювання вміння аналізувати графіки ізопроцесів і будувати їх у різних системах координат.
Ізотермічний процес – процес змінювання за незмінної температури стану газу деякої маси.
На графіках у завданні процеси зображено в координатах
Відповідь: A.
ТЕМА: Молекулярна фізика й термодинаміка. Середня квадратична швидкість теплового руху молекул.
Завдання скеровано на оцінювання вміння розв’язувати розрахункові задачі, пов’язані із середньою квадратичною швидкістю молекул.
Кількість зіткнень залежить від середньоквадратичної швидкості руху молекул: що більша швидкість їхнього руху, то частіше вони стикаються одні з одними й зі стінками.
За основним рівнянням молекулярно-кінетичної теорії існує зв’язок між макроскопічними параметри (тиском, об’ємом і температурами) і середньою швидкістю руху молекул у квадраті:
Тоді основне рівняння молекулярно-кінетичної можна переписати:
З огляду на рівняння стану
Тому
Середньоквадратичну швидкість можна обчислити з виразу
Кількість речовини
Зважаючи на те, що добуток маси однієї молекули на їхню кількість становить масу всього тіла,
Тому
Тобто
Аби дізнатися, у скільки разів збільшиться кількість зіткнень зі стінкою за 1 с, необхідно обчислити, чому дорівнює відношення середньоквадратичної швидкості молекул за температури 1 000 К до середньоквадратичної швидкості молекул за температури 250 К:
Відповідь: A.
ТЕМА: Молекулярна фізика та термодинаміка. Рівняння стану ідеального газу. Відносна вологість.
Завдання скеровано на оцінювання вміння розв’язувати комбіновані задачі з використанням рівняння стану ідеального газу й формул, що стосуються вологості повітря.
Дано:
1. Знайти:
У рівняння стану ідеального газу треба підставити температуру в кельвінах (К):
Тоді з рівняння стану ідеального газу можна виразити масу газу:
2. Знайти:
Відносну вологість повітря можна визначити за формулою:
За умовою тиск насиченої пари води
Тож
Відповідь: 1. 0,48. 2. 100.
ТЕМА: Основи молекулярно-кінетичної теорії.
Завдання скеровано на перевірку розуміння формул, що стосуються молекулярно-кінетичної теорії (МКТ).
A
Б
B
Г
Д
Відповідь: 1А, 2Д, 3В, 4Б.
ТЕМА: Молекулярна фізика й термодинаміка. Рівняння стану ідеального газу.
Завдання скеровано на перевірку розуміння особливостей ізопроцесів.
За графіком, наведеним в умові завдання, можна зробити висновок, що процес переводить газ зі стану з низьким тиском і малим об’ємом у стан із більшими тиском й об’ємом.
Тиск
Тож температуру можна виразити з рівняння стану:
Тобто внаслідок підвищення тиску й об’єму температура підвищується.
Відповідь: A.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси.
Завдання скеровано на перевірку розуміння особливостей ізопроцесів.
Тиск
У герметично закритій кімнаті кількість речовини й об’єм сталі.
Унаслідок роботи обігрівача температура повітря в кімнаті зростатиме.
Із рівняння стану можна виразити тиск:
Тож, якщо температура зростає, а об’єм залишається незмінним, то тиск також зростатиме.
Тобто йдеться про ізохорний процес.
Відповідь: B.
ТЕМА: Молекулярна фізика й термодинаміка. Ізопроцеси.
Завдання скеровано на перевірку вміння аналізувати графіки ізопроцесів.
Тиск
Зміну температури можна визначити з рівняння стану:
На графіку, наведеному в умові, зображено цикл у координатах
1–2: ізобарне розширення (
Тож, якщо об’єм збільшується, а тиск залишається незмінним, то й температура збільшується.
2–3: ізотермічне стискання зі збільшенням тиску (
3–4: ізохорний процес зі зменшенням тиску (
Тож, якщо тиск зменшується, а об’єм залишається постійним, то й температура зменшується.
4–1: ізотермічне стискання зі збільшенням тиску (
А У процесі 2–3 температура зменшується, а повинна зростати.
Б У процесі 4–1 тиск зменшується, а має зростати.
В Цей графік є зображенням циклу в координатах
Г Процес 1–2 є ізотермічним, а повинен бути ізобарним.
Відповідь: B.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основні положення молекулярно-кінетичної теорії та експериментальне обґрунтування їх.
Завдання скеровано на перевірку розуміння будови речовини в різних фазових (агрегатних) станах.
Кристал солі – це тверда йонна речовина. У ній йони розташовані в певному порядку (утворюють кристалічні ґратки) на відстанях, порівнюваних із розмірами йонів. Тому електростатичні сили втримують йони, що здійснюють малі коливання навколо положень рівноваги.
Вода в басейні – рідина. Молекули рідини розташовані хаотично. Середня відстань між молекулами порівняна з їхніми розмірами. Тому міжмолекулярні сили втримують молекули біля положення рівноваги. Кожна молекула рідини певний час (бл. 10–11 с) здійснює рух, подібний до коливального, потім перескакує в інше місце та знову коливається біля нового положення рівноваги. Час «осідлого життя» молекули в сотні разів більший за час «переходу».
Атмосферний кисень – газ. Молекули газів розташовані безладно й на відстанях, які в десятки разів більші за розміри самих молекул. На таких відстанях молекули майже не взаємодіють одна з одною. Тому, безперервно зіштовхуючись, молекули газів розлітаються на всі боки доти, доки не зустрінуть якусь перешкоду, наприклад, стінки посудини.
Йонізований газ – це плазма, так званий четвертий агрегатний стан речовини. Слово «йонізований» означає, що від значної частини атомів або молекул відокремлений принаймні один електрон. Плазма має властивості, схожі на газоподібний стан речовини (частинки рухаються вільно й відстань між частинками значно більша за розмір частинок). На відміну від газу в плазмі є далекосяжна кулонівська взаємодія між частинками, тобто вони взаємодіють навіть на великих відстанях.
Відповідь: 1В, 2Б, 3А, 4Д.
ТЕМА: Властивості газів, рідин і твердих тіл. Насичена й ненасичена пара.
Завдання скеровано на перевірку розуміння особливостей температурних залежностей насиченої пари.
Тиск, об’єм і температура газу, який можна вважати ідеальним, пов’язані формулою
Формула залежності тиску
Оскільки об’єм посудини незмінний, то ця формула описує пряму. Графік залежності в початковому стані не є графіком прямої, тож в посудині не може бути просто газ.
Насичена пара – це пара, яка перебуває в стані динамічної рівноваги зі своєю рідиною. Тож насичена пара не може існувати без рідини в тій самій посудині.
Під час підвищення температури посудини, у якій перебуває рідина й насичена пара, підвищується інтенсивність випаровування. Відповідно концентрація молекул рідини в повітрі збільшується. Тиск насиченої пари в такому разі зростає і внаслідок підвищення температури (за тим же принципом, що й тиск ідеального газу), і завдяки збільшенню концентрації молекул. Тобто тиск зростає швидше, ніж для ідеального газу. Коли рідина повністю випаровується, концентрація молекул рідини в повітрі не може збільшуватися, далі тиск зростає з тою самою залежністю, що й для ідеального газу.
Відповідь: В.
ТЕМА: Молекулярна фізика і термодинаміка.
Завдання скеровано на перевірку розуміння поняття теплової рівноваги.
Стан теплової рівноваги – це такий стан макроскопічної системи, коли всі її макроскопічні параметри залишаються незмінними як завгодно довго.
Відповідь: Б.
ТЕМА: Молекулярна фізика та термодинаміка. Основи термодинаміки. Рівняння стану ідеального газу.
Завдання скеровано на оцінювання вміння розв’язувати розрахункові задачі з використанням рівняння стану ідеального газу.
Тиск, об’єм і температура ідеального газу пов’язані рівнянням стану ідеального газу
Температуру газу можна визначити за формулою
Значення тиску й об’єму для всіх станів, зображених на графіку такі (в умовних одиницях):
| 1 | 2 | 1 |
| 2 | 6 | 2 |
| 3 | 1 | 3 |
| 4 | 4 | 4 |
| 5 | 2 | 6 |
Тоді температури в кожному стані в умовних одиницях дорівнюватимуть:
З-поміж них вибираємо
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси.
Завдання скеровано на перевірку розуміння ізопроцесів та їхньої графічної інтерпретації.
Розгляньмо ізохорний процес 1–2
Розгляньмо ізобарний процес 2‒3
Розгляньмо ізотермічний процес 3‒4
Розгляньмо ізобарний процес 4‒1
Відповідь: 1Б, 2А, 3Г, 4Д.
ТЕМА: Молекулярна фізика та термодинаміка. Основи молекулярно-кінетичної теорії.
Завдання скеровано на перевірку розуміння макроскопічних параметрів, якими описують стан ідеального газу, і вміння інтерпретувати їх графічно.
Зміну станів газу описують рівнянням Клапейрона:
Розгляньмо кожен зі станів 1‒4 ідеального газу. Одну клітинку вважатимемо одиничним відрізком для обох величин:
Отже, найменшим є числовий коефіцієнт у стані
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Властивості газів, рідин і твердих тіл.
Завдання скеровано на знання і розуміння явищ молекулярної фізики і термодинаміки.
Молекули рідини безперервно рухаються (коливаються біля положень рівноваги, час від часу перестрибують із місця на місце), але сили притягання не дають їм розлетітися.
Проте в рідині завжди є молекули, кінетична енергія яких у кілька разів перевищує її середнє значення. Коли ці швидкі молекули опиняються на поверхні рідини, їхньої енергії вистачає для того, щоб, подолавши притягання сусідніх молекул, залишити рідину.
З погляду молекулярно-кінетичної теорії (МКТ) під час пароутворення з поверхні рідини вилітають найшвидші молекули. І саме пароутворення з поверхні рідини називають випаровуванням.
Отже, явищу 1 відповідає опис Д.
Середня кінетична енергія
Також середня кінетична енергія поступального руху молекул ідеального газу прямо пропорційна абсолютній температурі
Отже, середня швидкість хаотичного руху молекул (середня квадратична швидкість руху молекул
Отже, під час охолодження (зниження температури) газу (2) середня швидкість хаотичного руху молекул також зменшується (Г).
Відповідно під час нагрівання (підвищення температури) газу (4) середня швидкість хаотичного руху молекул збільшуватиметься (А).
Плавлення ‒ це процес переходу речовини з твердого стану в рідкий.
Після досягнення температури плавлення тверде кристалічне тіло починає плавитися, а його температура не змінюється незважаючи на те, що нагрівник продовжує працювати й передавати тілу певну кількість теплоти. Уся енергія, що надходить від нагрівника, іде на руйнування кристалічної ґратки тіла. У цей інтервал часу внутрішня енергія твердого тіла продовжує збільшуватися. Отже, процесу 3 відповідає опис B.
Відповідь: 1Д, 2Г, 3В, 4А.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку розуміння макроскопічних параметрів, якими описують стан ідеального газу, і вміння інтерпретувати їх графічно.
Зміну станів газу описують рівнянням Клапейрона:
Графік 1 відповідає ізохорному охолодженню (
Графік 3 відповідає ізотермічному стисканню (
Під час процесів 2 і 4 змінюються і об’єм, і температура. Під час процесу 4 хоча температура й знижується, але об’єм збільшується, тому тиск також знижуватиметься. Отже, цей процес не може бути ізобарним.
Графік 2 відповідає ізобарному охолодженню (об’єм зменшується пропорційно до зниження температури, отже,
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу.
Завдання скеровано на перевірку вміння описати стан газів рівнянням Менделєєва ‒ Клапейрона й обчислити необхідну величину.
Запишімо рівняння стану для гелію
Поршень встановиться нерухомо на певній висоті за однакового тиску на поршень зверху й знизу:
За умовою і температура, і маса газів однакові в обох частинах посудини. Поділімо ліві і праві частини рівнянь, щоб скоротити однакові величини:
Відношення висот тих частин циліндричної посудини, які займає кожен газ, становить
За умовою в нижній частині посудини міститься азот,
Відповідь: 0,15.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Кількість речовини.
Завдання скеровано на перевірку розуміння основних понять молекулярно-кінетичної теорії (кількість речовини, стала Авогадро, а також на перевірку вміння обчислювати кількість молекул газу).
Кількість структурних частинок у макроскопічних тілах величезна. Структурними частинками можуть бути атоми, молекули, йони, електрони або інші частинки чи певні групи частинок.
Для зручності обчислень використовують одиницю кількості речовини – моль. Будь-яка речовина кількістю
Стала Авогадро
Відповідно
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії (рівняння стану ідеального газу). Властивості газів, рідин і твердих тіл (теплота згоряння палива).
Завдання скеровано на перевірку вміння описувати стан газу за допомогою рівняння стану ідеального газу, визначати кількість теплоти згоряння палива.
Кількість теплоти
Визначімо масу метану в балоні. Для цього опишімо за допомогою рівняння стану ідеального газу (рівняння Менделєєва ‒ Клапейрона) стан метану в балоні:
Виразімо з рівняння стану масу:
Переведімо значення всіх величин у систему SI:
Підставимо ці значення у формулу для обчислення маси:
Підставимо значення маси у формулу для визначення кількості теплоти згоряння метану:
Відповідь: 400.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу.
Завдання скеровано на перевірку знання рівняння стану ідеального газу і вміння за допомогою його описувати стан газу.
1. За умовою випарувалася половина зрідженого гелію, тобто
Відповідно можна обчислити кількість речовини
Попередньо виразімо значення густини
Обчислімо кількість речовини
Опишімо рівнянням стану ідеального газу (рівняння Менделєєва ‒ Клапейрона) стан гелію в резервуарі до того, як туди закачали гелій, що випарувався:
Знайдімо із цього рівняння, початкову кількість речовини
Тепер можна визначити кількість речовини газу в резервуарі після того, як у нього закачали гелій, зібраний після випаровування:
Відповідь: 1062,5.
2. Опишімо стан газу в резервуарі після закачування гелію ‒ зміниться кількість речовини
Обчислімо тиск, який установиться в резервуарі:
Щоб визначити зміну тиску в резервуарі у відсотках, складімо пропорцію:
Отже,
Відповідь: 6,25.
Відповідь: 1. 1062,5. 2. 6,25.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу.
Завдання скеровано на перевірку розуміння і вміння застосовувати рівняння стану газу.
Запишімо рівняння стану газу до накачування і після:
Запишімо формули для маси повітря як добуток густини
Підставімо в рівняння стану газу замість мас відповідні вирази й поділімо ліві і праві частини цих рівнянь:
Обчислімо шукану величину ‒ кількість накачувань:
Відповідь: 10.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Середня квадратична швидкість теплового руху молекул.
Завдання скеровано на перевірку знання і розуміння поняття середньої квадратичної швидкості руху молекул.
Запишімо основне рівняння молекулярно-кінетичної теорії, яке показує залежність тиску
Зауважмо, що
Отже,
Середня квадратична швидкість пов’язана із середнім квадратом швидкості таким співвідношенням:
Звідси
Підставімо цей вираз для середнього квадрату швидкості в основне рівняння молекулярно-кінетичної теорії і визначімо середню квадратичну швидкість:
Відповідь: Г.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку вміння описати стан газу за допомогою рівняння стану газу (Менделєєва ‒ Клапейрона).
Запишімо рівняння Менделєєва ‒ Клапейрона для стану
Права частина однакова, оскільки записуємо рівняння для того самого ідеального газу масою
Уважатимемо сторону клітинки за одиничний відрізок:
Запишімо рівняння Клапейрона:
Рівність виконуватиметься, якщо
Процес змінювання стану даного газу деякої маси, що відбувається за незмінного об’єму, називають ізохорним процесом:
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основні положення молекулярно-кінетичної теорії. Основи термодинаміки. Внутрішня енергія.
Завдання скеровано на перевірку знання і розуміння основних понять молекулярно-кінетичної теорії та їхнього зв’язку між собою.
1. Гелій – одноатомний газ. Атоми такого газу рухаються лише поступально, тому, щоб визначити його внутрішню енергію
Тобто
Відповідь: 18.
2. Середню кінетичну енергію поступального руху молекул ідеального газу (кінетична енергія поступального руху, що в середньому припадає на одну молекулу) обчислюють за формулою
З іншого боку середня кінетична енергія поступального руху молекул ідеального газу прямо пропорційна абсолютній температурі
Прирівняймо праві частини цих формул:
Перетворімо отриману рівність так, щоб можна було визначити температуру газу, використовуючи фізичні величини з умови завдання:
Відповідь: 1500.
Відповідь: 1. 18. 2. 1500.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу.
Завдання скеровано на перевірку знання і застосування рівняння стану ідеального газу.
Запишімо рівняння стану ідеального газу (рівняння Менделєєва – Клапейрона):
Перетворімо це рівняння, щоб можна було визначити густину
Запишімо температуру в градусах Кельвіна й обчислімо густину газу:
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Стала Авогадро.
Завдання скеровано на перевірку знання і розуміння кількості речовини й числа Авогадро.
У будь-якій речовині кількістю один моль міститься та сама кількість
За умовою завдання кількість речовини обох металів однакова –
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Середня квадратична швидкість теплового руху молекул.
Завдання скеровано на перевірку знання і розуміння зв’язку фізичних величин, що характеризують рух молекул ‒ середня квадратична швидкість руху молекул, середній квадрат швидкості, середня кінетична енергія поступального руху молекул ідеального газу.
Квадратний корінь із середнього квадрата швидкості називають середньою квадратичною швидкістю руху молекул
(Середній квадрат швидкості
Середній квадрат швидкості
Залежність середньої кінетичної енергії поступального руху молекул ідеального газу від абсолютної температури
Прирівняймо обидва вирази для визначення середньої кінетичної енергії поступального руху молекул ідеального газу:
Отже, коли склянку заповнили снігом (див. рисунок 1), то температура становила
Коли сніг у склянці розтанув, а вода нагрілася (див. рисунок 2), то температура
Тепер визначимо, у скільки разів збільшилася середня квадратична швидкість руху молекул гелію в кульці:
Отже, середня квадратична швидкість руху молекул гелію в кульці збільшилася в
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку знання і розуміння ізопроцесів, а саме ізохорного.
Ізохорний процес ‒ це процес змінювання стану даного газу деякої маси, що відбувається за незмінного об’єму

Що більшим є об’єм газу
Ділянки графіка
Відповідь: Б.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Стала Авогадро.
У будь-якій речовині кількістю
Фізичну величину, яка дорівнює частці від ділення кількості структурних частинок речовини
Отже, щоб визначити кількість молекул
Відповідь: B.
Тема: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основне рівняння молекулярно-кінетичної теорії ідеального газу. Концентрація молекул газу.
Завдання скеровано на перевірку знання і розуміння поняття концентрації молекул газу й уміння аналізувати різні практичні ситуації, пов’язані з концентрацією газу.
Концентрація
Отже, якщо не змінюватимуться кількість молекул й об’єм, у якому ці молекули містяться, то концентрація залишиться тією самою. Проаналізуймо наведені ситуації.
Коли людина набирає повітря в легені, то об’єм легень збільшується, і кількість молекул повітря також збільшується. Тобто концентрація молекул у цьому разі змінюватиметься.
Об’єм пробитої шини, можливо, і не буде зменшуватися, а кількість молекул повітря, яке заповнювало шину, зменшуватиметься. Тому концентрація молекул у цій ситуації змінюватиметься.
Насиченою називають пару, яка перебуває в стані динамічної рівноваги зі своєю рідиною. Динамічна рівновага встановлюється між процесами конденсації і випаровування ‒ кількість молекул, які повертаються в рідину, дорівнюватиме кількості молекул, які за той самий час залишають рідину. Це можливо в закритій посудині, тобто об’єм пари між поверхнею рідини й кришкою посудини, залишатиметься сталим. Концентрація молекул насиченої пари ‒ найбільша можлива концентрація молекул пари за даної температури. Якщо ж насичену пару охолоджувати, то кількість молекул, що вилітатимуть з поверхні рідини, зменшуватиметься, а значить, концентрація вже ненасиченої пари теж стане меншою.
Говорячи про закритий балон, розуміємо, що об’єм, який займає кисень, залишається незмінним. Оскільки балон не відкривають, то кількість молекул кисню в ньому теж не змінюється, а отже, концентрація молекул не може змінитися. У результаті остигання кисню зменшиться швидкість руху молекул і, відповідно, тиск кисню в балоні.
Відповідь: Г.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку знання і розуміння ізопроцесів в газах і вміння будувати й читати графіки відповідних ізопроцесів.
В умові завдання є графік ізобарного процесу ‒ для газу деякої маси відношення об’єму газу до температури є незмінним, якщо тиск газу не змінюється
Збільшуючи чисельник (об’єм), треба в стільки ж разів збільшувати знаменник (абсолютну температуру), щоб значення дробу було незмінним.
Графік ізобарного процесу називають ізобарою. Як випливає із закону Ґей-Люссака, за незмінного тиску об’єм газу даної маси прямо пропорційний його температурі:
Графіком цієї залежності в координатах
У координатах

Відповідь: B.
ТЕМА: Молекулярна фізика й термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку знання і розуміння ізопроцесів у газах і їхніх графіків.
Процес змінювання стану газу незмінної маси, що відбувається за сталого тиску
Графіки ізобарних процесів називають ізобарами. У координатах
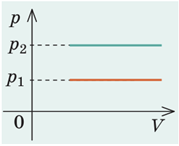
Отже, процесу за сталого тиску
Графік А відповідає процесу за сталого об’єму
Графік Б ‒ це ізотерма, графік ізотермічного процесу
Проаналізувавши графік В, бачимо, що зростає й об’єм, і тиск, тож відповідно до рівняння Клапейрона підвищуватиметься температура:
Відповідь: Г.
ТЕМА: Молекулярна фізика й термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу.
Завдання скеровано на перевірку знання і розуміння зміни стану ідеального газу, а також вміння скласти рівність тисків.
Гелій до нагрівання мав певну температуру
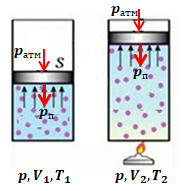
Отже, можемо прирівняти тиск, який створює гелій, і суму тисків атмосферного і поршня, оскільки поршень не рухається:
Розпишімо, чому дорівнює тиск гелію і тиск поршня. Відповідно до рівняння стану ідеального газу (рівняння Менделєєва ‒ Клапейрона)
Тиск, який створює поршень, визначатимемо за формулою
Потім за умовою гелій нагріли до температури
Запишімо загальне рівняння зміни стану газу після зміни абсолютної температури на
Підставімо всі вирази для відповідних величин у рівність тисків:
Обчислімо значення правої частини рівності, щоб математично легше було визначити зміну об’єму
Отже, визначмо, на скільки збільшиться об’єм гелію:
Відповідь: Г.
ТЕМА: Молекулярна фізика й термодинаміка. Основи молекулярно-кінетичної теорії. Маса і розмір молекул. Концентрація.
Завдання скеровано на перевірку знання і розуміння графічної інтерпретації залежності фізичних величин, а саме, концентрації молекул газу від об’єму.
Концентрація
Як бачимо з формули, концентрація обернено залежить від об’єму:
За умовою газ стискають в посудині, отже, об’єм зменшується (знаменник зменшується), значить, концентрація збільшується. При цьому кількість молекул газу не змінюється ‒ газ міститься в посудині, його стискають рухомим поршнем, про витік газу мова не йде, отже, зміна концентрації залежатиме тільки від зміни об’єму.
Така обернена залежність величин відповідає математичній функції
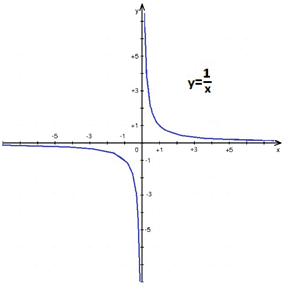
Відповідно, графіком залежності концентрації молекул газу від об’єму буде вітка гіперболи з додатними значеннями (об’єм і концентрація не можуть бути від’ємними).
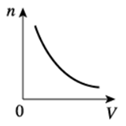
Графіки Б й В, які відображають лінійну залежність величин, не відповідають шуканій оберненій залежності. А за графіком Г зі збільшенням об’єму концентрація збільшується, що є неправильним у визначеній математичній залежності концентрації від об’єму.
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси в газах.
Завдання скеровано на перевірку розуміння ізопроцесів і їхньої графічної інтерпретації.
Розгляньмо кожну ділянку графіка на рисунку з умови.
Ділянка 1‒2: тиск сталий
Отже, ділянка 1‒2 графіка відповідає ізобарному нагріванню.
Ділянки 2‒3 й 4‒1 відповідають ізотермічному процесу, коли
Отже, ділянки 2‒3 й 4‒1 графіка відповідають ізотермічному стисканню.
Ділянка 3‒4: якщо зафіксувати об’єм й охолоджувати газ, то тиск повинен зменшуватися. Отже, відповідно до рівняння Клапейрона для ізохорного процесу якщо температура
Отже, ділянка 3‒4 графіка відповідає ізохорному охолодженню.
Тепер за визначеними процесами знайдімо відповідний графік у системі координат
За першим процесом ‒ ізобарне нагрівання ‒ можемо виключити рисунок Г: на його ділянці 1‒2 температура знижується.
Процес 2‒3 ‒ це ізотермічне стискання. Виключаємо рисунок Б: на ньому ділянка графіка 2‒3 відповідає ізотермічному розширенню.
Процес 3‒4 (ізохорне охолодження) на рисунках А і В збігається.
А от за процесом 4‒1 ‒ ізотермічне стискання ‒ правильним буде лише рисунок А. На рисунку Б ділянка графіка 4‒1 відповідає ізотермічному розширенню.
Відповідь: A.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Основне рівняння молекулярно-кінетичної теорії.
Завдання скеровано на перевірку знання і розуміння формули-наслідку з основного рівняння молекулярно-кінетичної теорії і формули, що виражає зв’язок середньої кінетичної енергії поступального руху молекул і температури.
Тиск
Запишімо це рівняння до підвищення температури й після:
За умовою абсолютна температура підвищилася втричі:
Також за умовою змінилася концентрація ‒ фізична величина, яка дорівнює кількості структурних одиниць речовини
Відповідно до умови кожна друга молекула розпалася на два атоми. Отже,
Тепер визначімо, у скільки разів збільшився тиск газу:
Отже, тиск газу в балоні збільшиться в 4,5 раза.
Відповідь: B.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Рівняння стану ідеального газу. Механіка. Елементи механіки рідин і газів. Тиск нерухомої рідини на дно й стінки посудини.
Завдання скеровано на перевірку знання і розуміння зв’язку між макроскопічними параметрами газу, а також на розуміння атмосферного й гідростатичного тиску.
Виразімо зв’язок між макроскопічними параметрами повітря (тиском
За умовою температура стала, отже,
Тиск
А тиск біля поверхні дорівнює атмосферному тиску:
Запишімо відношення об’ємів, підставивши вирази для тисків:
Отже, об’єм бульбашки збільшиться у 2,5 раза.
Відповідь: B.
ТЕМА: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Ізопроцеси.
Завдання скеровано на перевірку розуміння ізопроцесів і їхньої графічної інтерпретації.
1. Розгляньмо, які з графіків відповідають ізотермічному процесу ‒
Отже, процесу ізотермічного розширення відповідає графік на рисунку А.
2. Відповідно розглянемо одразу ізотермічне стискання ‒ графік на рисунку Б.
Процес стискання означає, що об’єм
Отже, процесу ізотермічного стискання відповідає графік на рисунку Б.
3. Розгляньмо ізобарний процес ‒
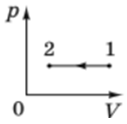
Під час цього об’єм
Тобто на рисунку Д зображений графік ізобарного охолодження.
На рисунку Г тиск змінюється, це не відповідає ізобарному процесу. Тоді розгляньмо рисунок В, на якому зображено графік залежності об’єму від абсолютної температури:
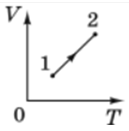
Якщо зафіксувати тиск і нагрівати газ, то об’єм повинен збільшуватися. Отже, відповідно до рівняння Клапейрона для ізобарного процесу якщо температура
Отже, на рисунку В зображено графік ізобарного нагрівання.
4. І нарешті розгляньмо рисунок Г, що залишився. Як бачимо, графік на ньому відповідає сталому об’єму ‒ ізохорний процес
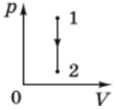
З’ясуймо, чи буде це процес охолодження. З графіка видно, що тиск
Отже, графік на рисунку Г відповідає ізохорному охолодженню.
Відповідь: 1А, 2В, 3Г, 4Б.
Тема: Молекулярна фізика і термодинаміка. Основи молекулярно-кінетичної теорії. Стала Авогадро.
Завдання скеровано на перевірку знання і розуміння сталої Авогадро й кількості речовини.
У будь-якій речовині кількістю
Фізичну величину, яка дорівнює частці від ділення кількості структурних частинок речовини
Отже, щоб визначити кількість молекул
Відповідь: Б.