Розділ: Речовина
Тема: Електролітична дисоціація
Кількість завдань: 46
ТЕМА: Йонний склад розчинів. Реакції обміну. Осадження малорозчинних сполук.
Завдання скеровано на перевірку знання умов утворення осаду в реакціях обміну між солями у водних розчинах, уміння аналізувати йонний склад розчинів.
Після зливання розчинів хлорид-іони утворюються внаслідок електролітичної дисоціації двох солей, бо відбулася реакція обміну:
Рівняння електролітичної дисоціації розчинених у воді солей.
Загальна кількість йонів
Кількість речовини (моль) катіонів
Унаслідок реакції обміну між барій хлоридом і цинк сульфатом утворюється нерозчинний у воді барій сульфат.
Відповідь: Б.
ТЕМА: Кислоти. Луги. Реакція нейтралізації. Кількісні відношення речовин у хімічних реакціях.
Завдання скеровано на перевірку розуміння процесу нейтралізації між кислотою та основою, уміння зіставляти відношення об’ємів розчинів із відношеннями кількостей речовини в них, застосовувати поняття pH як показника рівноваги між йонами
| Варіант відповіді | Запис | Аналіз запису | Висновок |
| А | Це означало б, що кількість йонів |
Неправильно | |
| Б | Маси кислоти й лугу можуть бути рівні, але це не є достатньою умовою рівності кількості йонів |
Неправильно | |
| B | Це і є умова повної нейтралізації, унаслідок якої |
Правильно | |
| Г | Рівність мас йонів не означає рівності їхньої кількості, бо молярні маси цих йонів різні | Неправильно |
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й аналізувати формулу солі й аналізувати рівняння електролітичної дисоціації.
Формула кальцій хлориду
Рівняння електролітичної дисоціації кальцій хлориду
Унаслідок дисоціації кальцій хлориду кількістю речовини
Відповідь: Г.
ТЕМА: Речовина. Реакції йонного обміну.
Завдання скеровано на перевірку розуміння суті електролітичної дисоціації та умов необоротності реакцій йонного обміну між електролітами у водних розчинах, уміння прогнозувати перебіг цих реакцій за допомогою таблиці «Poзчинність ocнов, амфотерних гідроксидів, кислот і солей у воді за
Умову завдання задовольняє пара йонів
Тому кількості цих йонів, а відповідно й кількості речовин цих йонів, зменшаться, бо йони з розчину перейдуть до складу нерозчинної солі.
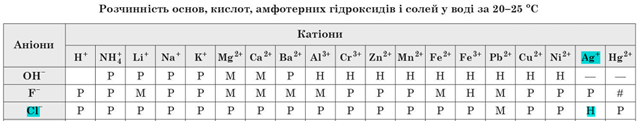
Відповідь: Б.
ТЕМА: Неорганічна хімія. Властивості кислот і лугів. Реакція нейтралізації. Водневий показник pH розчину.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації, уміння тлумачити водневий показник pH розчину, графіки.
Унаслідок нейтралізації лугу сильною кислотою в розчині поступово зменшуватиметься вміст гідроксид-аніонів, тобто його водневий показник pH також поступово зменшуватиметься. Умову завдання задовольняє графік Б.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Хімічні властивості неорганічних сполук. Гідроліз.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і летких сполук неметалічних елементів із Гідрогеном.
Середовище водного розчину амоніаку лужне. Він реагує з водою з утворенням катіона амонію й гідроксид-аніона:
Середовище водного розчину гідроген хлориду кисле:
Середовище водних розчинів амоній хлориду й алюміній хлориду кисле, бо це солі слабких основ і сильної хлоридної кислоти.
Середовище водного розчину натрій сульфіду лужне, бо це сіль сильної основи і слабкої сульфідної кислоти.
Середовище водних розчинів натрій сульфату і натрій хлориду нейтральне, бо це солі сильної основи і сильних кислот – сульфатної і хлоридної.
Відповідь: 1Б; 2Г; 3Д.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку знання хімічних властивостей летких сполук неметалічних елементів із Гідрогеном, уміння прогнозувати середовище їхніх водних розчинів.
Фенолфталеїн набуває малинового забарвлення у лужному середовищі, у якому метилоранж змінює оранжевий колір на жовтий. Умову завдання задовольняє амоніак
Відповідь: A.
ТЕМА: Загальна хімія. Електролітична дисоціація кислот, лугів, солей у водних розчинах. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати тип середовища водних розчинів електролітів.
1. Кисле середовище у водних розчинах хлоридної кислоти та алюміній хлориду – солі сильної кислоти та слабкої основи (А).
2. Нейтральне середовище у водних розчинах натрій хлориду та натрій сульфату – солей сильної основи й сильних кислот (Г).
3. Лужне середовище у водних розчинах натрій гідроксиду й натрій сульфіду – солі сильної основи та слабкої кислоти (В).
Відповідь: 1А, 2Г, 3В.
ТЕМА: Електролітична дисоціація кислот. Водневий показник рН.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння електролітичної дисоціації кислот.
Проаналізувавши природу кислот, про які йдеться в завданні, і рівняння їхньої електролітичної дисоціації, можна дійти висновку, що:
1) сульфатна й нітратна кислоти як сильні електроліти в розведених розчинах майже повністю дисоціюють на йони, кількість катіонів Гідрогену в їхніх розчинах із зазначеними кількістями кислот однакова, тому значення показника рН цих розчинів однакові;
2) етанова кислота – слабкий електроліт, навіть у розведених розчинах дисоціює лише частково, тобто кількість катіонів Гідрогену в її розчині менша за зазначену кількість кислоти. Що менша концентрація катіонів Гідрогену, то більше значення водневого показника рН розчину.
Відповідно значення водневого показника рН розчину етанової кислоти більше порівняно з розчинами сульфатної і нітратної кислот:
| Рівняння електролітичної дисоціації кислоти | Кількість речовини (моль) у водному розчині об’ємом 1 л | |
| кислота | катіони Гідрогену | |
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Електроліти й неелектроліти.
Завдання скеровано на перевірку вміння аналізувати склад речовин, визначати типи хімічних зв’язків у них і розпізнавати електроліти.
Електричний струм проводять розчини й розплави електролітів – речовин із йонним або ковалентним сильно полярним типами хімічного зв’язку.
Гідроген хлорид у водному розчині, натрій гідроксид і калій сульфат у розплавах дисоціюють на йони, тому є електролітами.
Етанол у водному розчині на йони не дисоціює, тому цей розчин не проводить електричний струм.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах.
Завдання скеровано на перевірку знання властивостей речовин, уміння прогнозувати їхню здатність реагувати з водою, забарвлення індикатора в розчині.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Середовище водного розчину амоніаку лужне внаслідок перебігу реакції за схемою
Гідроксид-аніони у водному розчині амоніаку зумовлюють лужну реакцію середовища в ньому.
Натрій хлорид – сіль сильної основи й сильної кислоти – не зазнає гідролізу, тож середовище його водного розчину нейтральне.
Водний розчин гідроген сульфіду – слабка сульфідна кислота.
Сульфур(IV) оксид – кислотний, унаслідок його змішування з водою утворюється слабка сульфітна кислота.
Відповідь: A.
ТЕМА: Загальна хімія. Електролітична дисоціація. Солі як електроліти.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації солей.
Солі – електроліти, які в розтопі або у водному розчині дисоціюють на катіони металічного елемента й аніони кислотного залишку:
| Сіль | |||
| Назва солі Калію | Рівняння електролітичної дисоціації | ||
| 1 | сульфіт | Г | |
| 2 | сульфат | A | |
| 3 | нітрат | Б | |
| 4 | сульфід | Д | |
Відповідь: 1Г, 2А, 3Б, 4Д.
ТЕМА: Органічна хімія. Оксигеновмісні органічні речовини. Карбонові кислоти.
Завдання скеровано на перевірку розуміння зумовленості властивостей карбонових кислот складом і будовою їхніх молекул.
Під впливом атомів Хлору в молекулах карбонових кислот полярність зв’язку
Відповідь: B.
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння електролітичної дисоціації.
| Рівняння електролітичної дисоціації | Загальна кількість (моль) йонів унаслідок дисоціації солі кількістю речовини 1 моль | |
| 2 | Б | |
| 3 | A | |
| 4 | Г | |
| 5 | B |
Відповідь: Б А Г В.
ТЕМА: Розчини. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалогідрату, використаного для приготування розчину.
Дано:
Знайти:
Відповідь: 64.
ТЕМА: Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації.
У водному розчині з утворенням катіонів Гідрогену дисоціюють нітратна кислота (1), гідроген хлорид (4) і сульфітна кислота (5).
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Азот. Амоніак.
Завдання скеровано на перевірку вміння виявляти гідроксид-аніони в розчині.
Нашатирний спирт – тривіальна назва водного розчину амоніаку. Середовище водного розчину амоніаку лужне, бо містить гідроксид-аніони, що утворюються внаслідок взаємодії молекул амоніаку з молекулами води:
Відповідь: Б.
ТЕМА: Загальна хімія. Кислоти. Електролітична дисоціація кислот.
Завдання скеровано на перевірку розуміння електролітичної дисоціації кислот.
Універсальний індикаторний папір змінює забарвлення на червоне в кислому середовищі. Тобто в досліджуваному розчині є катіони Гідрогену.
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини й складати рівняння електролітичної дисоціації.
Магній нітрат – сіль, дисоціює у водному розчині на катіони Магнію і нітрат-аніони:
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками калій гідрогенкарбонату є однозарядні катіони Калію та Гідрогену, двозарядні карбонат-аніон:
Згідно з принципом електронейтральності речовини сума зарядів складників дорівнює нулю.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати рівняння електролітичної дисоціації.
| Речовина | |||
| Назва | Рівняння електролітичної дисоціації | ||
| 1 | нітратна кислота | A | |
| 2 | алюміній сульфат | Г | |
| 3 | барій хлорид | Б | |
| 4 | калій гідроксид | B | |
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Електролітична дисоціація лугів.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування продуктів електролітичної дисоціації лугів.
Унаслідок дисоціації у водному розчині натрій гідроксиду утворюються катіони Натрію і гідроксид-аніони:
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Електролітична дисоціація солей.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування продуктів електролітичної дисоціації солей.
Унаслідок дисоціації у водному розчині барій хлориду утворюються катіони Барію і хлорид-аніони:
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку розуміння електролітичної дисоціації багатоосновних сильних кислот у розведених розчинах.
Оскільки розчин розведений, найбільше в ньому молекул води.
Сульфатна кислота як сильний електроліт дисоціює практично повністю, тому кількість сульфат-іонів – на другому місці.
На третьому місці – гідрогенсульфат-аніони – продукти неповної дисоціації сульфатної кислоти.
Сульфатна кислота – сильний електроліт, тому її молекул у розчині найменше.
Відповідь: Б Г А В.
ТЕМА: Загальна хімія. Електролітична дисоціація. Рівняння електролітичної дисоціації.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації.
Речовини, водні розчини яких проводять електричний струм, називають електролітами.
Електролітична дисоціація у водних розчинах – це повний або частковий розпад електроліту на йони під впливом полярних молекул води.
Кислотами називають електроліти, унаслідок дисоціації яких не утворюються жодні інші катіони, крім гідратованих йонів Гідрогену.
Луги (розчинні основи) – це електроліти, які у водному розчині дисоціюють з утворенням гідратованих гідроксид-аніонів. Жодних інших негативних йонів під час цього процесу не утворюється.
Кислі солі – це електроліти, які у водних розчинах дисоціюють на будь-які гідратовані катіони й катіони Гідрогену
Основні солі – це електроліти, які у водних розчинах дисоціюють на будь-які гідратовані катіони крім катіонів Гідрогену
| Клас неорганічних сполук | Рівняння електролітичної дисоціації | ||
| 1 | кисла сіль | B | |
| 2 | кислота | Б | |
| 3 | основа | Г | |
| 4 | основна сіль | A |
Відповідь: 1В; 2Б; 3Г; 4А.
ТЕМА: Неорганічні речовини. Кислоти й основи.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів неорганічних речовин і продуктів їхньої взаємодії з водою.
А азот не реагує з водою, його водний розчин не діє на індикатор
Б водний розчин амоніаку має лужне середовище, гідроген сульфіду – слабокисле, тому в амоніаку й гідроген сульфіді універсальний індикаторний папірець змінює забарвлення на синє і рожеве відповідно
В нітроген(І) оксид несолетворний, його водний розчин, так само як і водний розчин азоту, не діє на індикатор
Г нітроген(ІІ) оксид несолетворний, його водний розчин, так само як і водний розчин азоту, не діє на індикатор
Відповідь: Б.
ТЕМА: Обчислення в хімії. Обчислення маси розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 161.
ТЕМА: Оксиди. Кислоти. Електролітична дисоціація.
Завдання скеровано на перевірку знання хімічних властивостей кислотних оксидів і продуктів електролітичної дисоціації кислот.
Сульфітна кислота дисоціює на катіони Гідрогену й сульфіт-аніони:
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони:
Продуктом розчинення сульфур(VI) оксиду у воді є сульфатна кислота, яка дисоціює на катіони Гідрогену й сульфат-аніони:
Відповідь: A.
ТЕМА: Електролітична дисоціація. Сильні та слабкі електроліти.
Завдання скеровано на перевірку вміння розпізнавати сильні та слабкі електроліти, складати й аналізувати рівняння електролітичної дисоціації.
Сульфатна й нітратна кислоти – сильні електроліти, у розведених розчинах практично повністю дисоціюють на йони:
Кількість речовини катіонів Гідрогену в розчині сульфатної кислоти вдвічі більша за її кількість речовини й становить
Етанова кислота – дуже слабкий електроліт, який незначною мірою дисоціює за рівнянням
Тобто катіонів Гідрогену в розведеному розчині етанової кислоти значно менше порівняно з іншими розчинами, про які йдеться в завданні.
Відповідь: Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 20.
ТЕМА: Загальна хімія. Електролітична дисоціація.
Завдання скеровано на перевірку вміння прогнозувати електролітичну дисоціацію лугів, кислот, солей.
| 1 | Кисла сіль |
|
B |
| 2 | Одноосновна кислота |
|
A |
| 3 | Луг |
|
Г |
| 4 | Багатоосновна кислота |
|
Б |
Відповідь: 1В, 2А, 3Г, 4Б.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти.
Завдання скеровано на перевірку знання хімічних властивостей етанової кислоти.
Молекула карбонової кислоти утворена вуглеводневим залишком, сполученим з карбоксильною групою (однією чи кількома).
Етанова кислота у водному розчині дисоціює:
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь електролітичної дисоціації.
Завдання скеровано на перевірку вміння обчислювати ступінь дисоціації електроліту.
Ступінь дисоціації дорівнює відношенню кількості молекул електроліту, які розпалися на йони, до загальної кількості його молекул:
Відповідь: 12.
ТЕМА: Загальна хімія. Електролітична дисоціація неорганічних сполук різних класів.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі неорганічних речовин.
1 Кисла сіль дисоціює на катіони металічного елемента, катіони Гідрогену й аніони кислотного залишку (В).
2 Одноосновна кислота дисоціює на катіони Гідрогену й однозарядні аніони кислотного залишку (А).
3 Основа дисоціює на катіони металічного елемента й гідроксид-аніони (Г).
4 Багатоосновна кислота дисоціює на катіони Гідрогену й аніони кислотного залишку, заряд яких менше від –1 і становить –2, –3 тощо (Б).
Відповідь: 1В, 2А, 3Г, 4Б.
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку.
Амоніак виявляє осно́вні властивості через наявність в атома Нітрогену неподіленої електронної пари. Під час взаємодії амоніаку з водою утворюються катіони амонію й гідроксид-аніони. Гідроксид-аніони у водному розчині амоніаку зумовлюють набуття фенолфталеїном малинового забарвлення:
Відповідь: Б.
ТЕМА: Загальна хімія. Електролітична дисоціація кислот. Сильні й слабкі електроліти.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації кислот.
Кислоти – електроліти, які під час дисоціації у водному розчині не утворюють інших катіонів окрім катіонів Гідрогену. Рівняння електролітичної дисоціації кислот, про які йдеться в завданні, такі:
Сульфатна й нітратна кислоти – сильні електроліти, тож у розведених водних розчинах дисоціюють повністю.
Кількість речовини катіонів Гідрогену вдвічі більша за кількість речовини сульфатної кислоти і становить, відповідно, 0,001 моль.
Кількість речовини катіонів Гідрогену така сама, як кількість речовини нітратної кислоти і становить, відповідно, 0,001 моль.
Етанова кислота – дуже слабкий електроліт, тому кількість речовини катіонів Гідрогену значно менша за кількість речовини етанової кислоти, тобто за 0,001 моль.
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електроліти й неелектроліти.
Завдання скеровано на перевірку вміння аналізувати склад речовин, визначати типи хімічних зв’язків у них і розпізнавати електроліти.
Електричний струм проводять розчини й розплави електролітів – речовин із йонним або ковалентним сильно полярним типами хімічного зв’язку.
Необхідною умовою дисоціації сульфатної кислоти (Б) на йони є вода, безводна сульфатна кислота на йони не дисоціює.
Етанол (В) і глюкоза (Г) у водному розчині на йони не дисоціюють, тому їхні розчини не проводять електричний струм.
Натрій гідроксид (А) – йонна речовина, її кристалічні ґратки під час плавлення руйнуються. Вільні йони, що утворюються внаслідок цього, за різниці потенціалів рухаються впорядковано – розплав проводить електричний струм.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду й кальцій гідроксиду, уміння прогнозувати продукти електролітичної дисоціації кальцій гідроксиду.
Головним складником негашеного вапна є кальцій оксид. Унаслідок його реакції з водою утворюється кальцій гідроксид:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Г.
ТЕМА: Загальна хімія. Електроліти й неелектроліти.
Завдання скеровано на перевірку вміння розпізнавати електроліти й неелектроліти.
Електричний струм проводить водний розчин етанової кислоти внаслідок того, що етанова кислота дисоціює на катіони Гідрогену й етаноат-аніони.
Молекула сахарози у водному розчині, гідроген хлорид у бензені не розпадаються на йони. Безводна сульфатна кислота не містить йонів, бо її електролітична дисоціація можлива лише за участі молекул води.
Відповідь: А.
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку вміння пояснювати результати досліду хімічними властивостями амоніаку.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він під дією гідроксид-аніонів набуває малинового кольору. З-поміж речовин, хімічні формули яких наведено в завданні, лише розчин амоніаку у воді має лужне середовище. Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію:
Відповідь: Г.
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння електролітичної дисоціації.
| Рівняння електролітичної дисоціації | Загальна кількість (моль) йонів унаслідок дисоціації солі кількістю речовини 1 моль | |
| 2 | Б | |
| 3 | A | |
| 4 | B | |
| 5 | Г |
Відповідь: Б А В Г.
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація. Неорганічна хімія. Сполуки неметалічних елементів.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації речовин.
Умову завдання задовольняють сульфідна кислота (1), гідроген бромід (2), сульфітна кислота (5).
Відповідь: A.
ТЕМА: Розчини. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалогідрату, використаного для приготування розчину.
Дано:
Знайти:
Відповідь: 143.
ТЕМА: Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації.
У водному розчині з утворенням катіонів Гідрогену дисоціюють сульфатна кислота (1), гідроген бромід (2), сульфітна кислота (5).
Відповідь: Б.
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації.
Натрій сульфат – добре розчинна у воді середня сіль, яка дисоціює на катіони Натрію і сульфат-аніони:
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 8.




