Розділ: Будова атома і періодична система хімічних елементів
Тема: Форми електронних орбіталей. s-, p-, d-, f-Елементи
Кількість завдань: 19
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі \(s\)-елемента на зовнішньому енергетичному рівні міститься два електрони. Тобто це елемент ІІА групи періодичної системи. Формула його гідроксиду \(\mathrm{E(OH)_2}\).
Молярна маса його гідроксиду становить \(74\ \text{г/моль}\):
Тобто йдеться про Кальцій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює \(20\).
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген броміду хімічний зв’язок між атомами утворюється внаслідок перекривання кулястої 1s-електронної хмари атома Гідрогену й гантелеподібної 4p-електронної хмари атома Брому.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген хлориду хімічний зв’язок утворюється внаслідок усуспільнення пари електронів атомами Гідрогену й Хлору. В утворенні хімічного зв’язку беруть участь неспарені електрони зовнішніх енергетичних рівнів:
\begin{gather*} \mathrm{H}\ 1s^1\\[7pt] \mathrm{Cl}\ 1s^22s^22p^63s^23p^5 \end{gather*}У молекулі хімічний зв’язок між атомами утворюється внаслідок перекривання 1s-електронної хмари атома Гідрогену та 3p-електронної хмари атома Хлору (рис. 1).
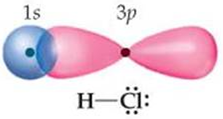
Рис. 1. Перекривання електронних хмар атомів у молекулі гідроген хлориду
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння порівнювати енергетичні підрівні за енергією.
Електронні хмари різних форм відрізняються силою притягання до ядра, а самі електрони розташовані навколо ядра шарами. Енергія електрона є його найважливішою характеристикою. Електрони, які розташовані в атомі в орбіталях однакової форми і розміру, мають однакову енергію. Електрони спочатку заповнюють орбіталі з нижчою енергією (рис. 1).
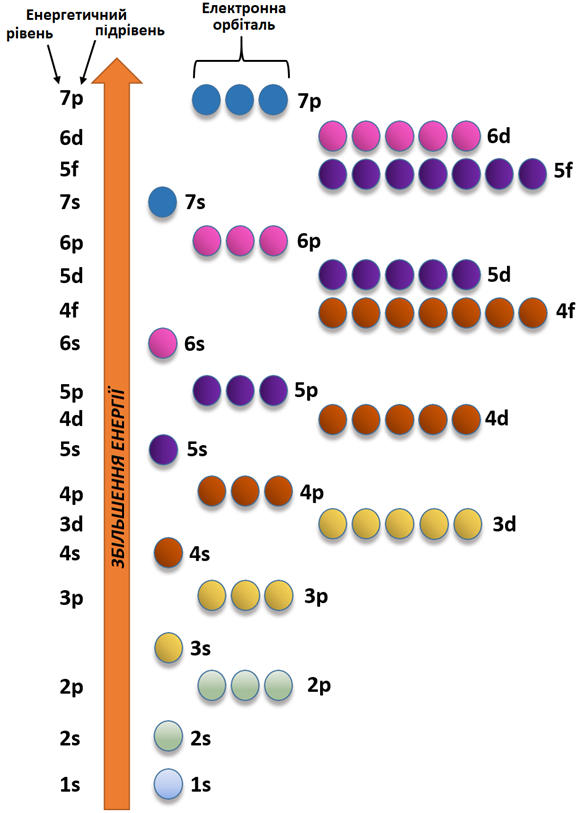
Рис. 1. Послідовність заповнення електронами енергетичних підрівнів
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген броміду хімічний зв’язок утворюється внаслідок усуспільнення пари електронів атомами Гідрогену й Брому. В утворенні хімічного зв’язку беруть участь неспарені електрони зовнішніх енергетичних рівнів:
\begin{gather*} \mathrm{H}\ \ 1s^1\\[7pt] \mathrm{Br}\ \ 1s^22s^22p^63s^23p^63d^{10}4s^24p^5 \end{gather*}У молекулі хімічний зв’язок між атомами утворюється внаслідок перекривання \(1s\)-електронної хмари атома Гідрогену та \(4p\)-електронної хмари атома Брому
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою енергетичних рівнів їхніх атомів.
В атомах d-елементів заповнюється електронами зовнішній d-підрівень (рис. 1).
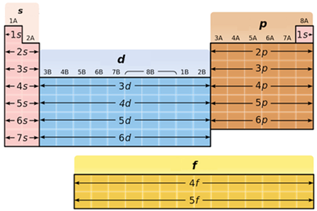
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
| $$\mathrm{F}$$ | $$\mathrm{Cl}$$ | $$\mathrm{Br}$$ | |
| n = | 2, | 3, | 4 |
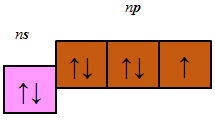
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
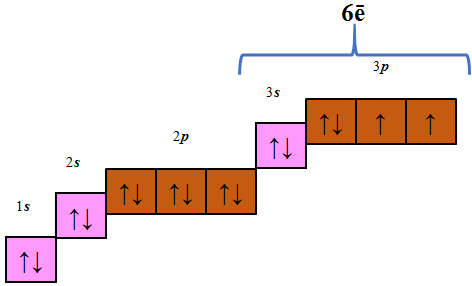
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
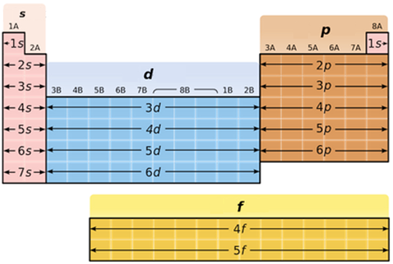
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
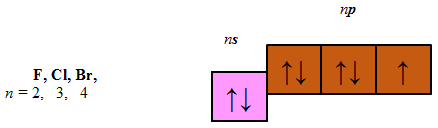
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою енергетичних рівнів їхніх атомів.
В атомах d-елементів заповнюється електронами зовнішній d-підрівень (рис. 1).
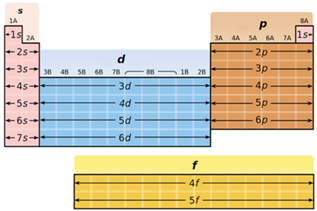
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Відповідь: Б.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння визначати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хімічні елементи класифікують на \(s‐, p‐, d‐, f‐\)елементи за ознакою заповнення електронами енергетичних рівнів. В атомах \(s\)-елементів електронами заповнюється \(s\)-підрівень, в атомах \(p\)-елементів – \(p\)- підрівень тощо.
Берилій, Кальцій, Магній – елементи 2 А групи періодичної системи хімічних елементів. В їхніх атомах на зовнішньому енергетичному рівні перебувають два \(s\)-електрони. Тобто вони належать до \(s\)-елементів:
\begin{gather*} \mathrm{Be}\ 1s^22s^2;\\[7pt] \mathrm{Mg}\ 1s^22s^22p^63s^2;\\[7pt] \mathrm{Ca}\ 1s^22s^22p^63s^23p^64s^2. \end{gather*}Відповідь: Г.
ТЕМА: Періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
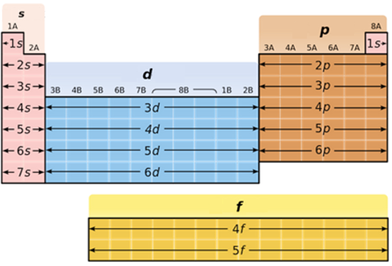
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Алюміній належить до p-елементів, будова зовнішнього енергетичного рівня його атома така:
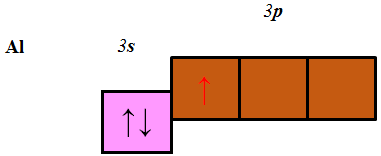
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Форми і перекривання електронних хмар. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип і спосіб утворення хімічного зв’язку.
У молекулі гідроген хлориду сполучені атом Гідрогену й атом Хлору. Хімічний зв’язок між ними утворюється за рахунок перекривання s-електронної хмари атома Гідрогену та p-електронної хмари атома Хлору (рис. 1).
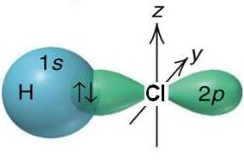
Рис. 1. Перекривання електронних хмар в молекулі гідроген хлориду
Відповідь: Г.
ТЕМА: Загальні відомості про металічні елементи й метали. Алюміній, сполуки Алюмінію.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, сполук Алюмінію.
I Алюміній належить до p-елементів, в його атомі заповнюється електронами p-підрівень: $$ \mathrm{Al}\ 1s^22s^22p^63s^23p^1. $$
II Алюміній гідроксид за нагрівання розкладається: $$ \mathrm{2Al(OH)_3=Al_2O_3+3H_2O.} $$
III У йона \(\mathrm{Al^{3+}}\) така сама електронна конфігурація, як в атома Неону: $$ \mathrm{Al^{3+}\ }1s^22s^22p^6. $$
IV Для добування водню в лабораторії можна використати алюміній і хлоридну кислоту: $$ \mathrm{2Al+6HCl=2AlCl_3+3H_2\uparrow}. $$
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, класифікувати хімічні елементи за будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах Берилію, Магнію, Кальцію заповнюється електронами зовнішній s-підрівень, тому вони належать до s-елементів (рис. 1).
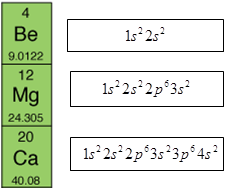
Рис. 1. Будова атомів Берилію, Магнію, Кальцію
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
Берилій – четвертий елемент періодичної системи, міститься в другому періоді у IIA групі. В атомі Берилію два енергетичні рівні з чотирма електронами.
Електронна формула атома Берилію в основному стані така: $$ 1s^22s^2. $$
Тобто в атомі Берилію в основному стані два валентні електрони, орбіталі яких сферичні.
Відповідь: A.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі \(s\)-елемента на зовнішньому енергетичному рівні міститься один електрон. Тобто це елемент ІА групи періодичної системи. Формула його вищого оксиду \(\mathrm{E_2O}\).
Молярна маса його оксиду становить \(62\ \text{г/моль}\):
\begin{gather*} M_r(\mathrm{E_2O})=2A_r(\mathrm{E})+A_r(\mathrm{O})\\[7pt] A_r(\mathrm{E})=\frac{M_r(\mathrm{E_2O})-A_r(\mathrm{O})}{2}\\[7pt] A_r(\mathrm{E})=\frac{62-16}{2}\\[7pt] A_r(\mathrm{E})=23 \end{gather*}Тобто йдеться про Натрій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює \(11\).
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі водню хімічний зв’язок між атомами утворюється внаслідок перекривання двох s-електронних хмар кулястої форми.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, розрізняти електрони \(s-\) і \(p\text{-підрівнів}.\)
З-поміж хімічних елементів, символи яких є в наведених формулах сполук, лише в атомі Флуору частина електронів міститься на \(p\text{-підрівні}\): \begin{gather*} \mathrm{H}\ 1s^1\\[7pt] \mathrm{Li}\ 1s^22s^1\\[7pt] \mathrm{F}\ 1s^22s^22p^5 \end{gather*}
Умову завдання задовольняє молекула фтору.
Відповідь: Г.




