Розділ: Речовина
Тема: Гідроліз солей
Кількість завдань: 23
ТЕМА: Йонні реакції в розчинах. Гідроліз солей.
Завдання скеровано на перевірку вміння розпізнавати реакції, унаслідок яких утворюється газ й осад.
Бурий колір властивий катіонам Феруму(ІІІ), отже, у реакції бере участь ферум(ІІІ) хлорид
Натрій сульфід – сіль слабкої кислоти
За умовою внаслідок реакції виділяється безбарвний газ без запаху, тому натрій сульфід не відповідає умові, бо гідроген сульфід має характерний неприємний запах. Натомість карбон(IV) оксид запаху не має.
Умові завдання відповідають реактанти
Відповідь: Г.
ТЕМА: Властивості солей у водних розчинах. Реакції між солями. Середовище розчину.
Завдання скеровано на перевірку розуміння суті гідролізу солей, знання умов, за яких відбувається реакція між розчиненими у воді солями.
| Варіант відповіді | Формула солі | Середовище водного розчину солі | Висновок |
| А | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Кисле, бо це сіль слабкої основи й сильної кислоти | |||
| Б | Лужне, бо це сіль сильної основи й слабкої кислоти | Правильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти | |||
| B | Лужне, бо це сіль сильної основи й слабкої кислоти | Неправильно | |
| Лужне, бо це сіль сильної основи й слабкої кислоти | |||
| Г | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти |
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі. Гідроліз солей.
Завдання скеровано на перевірку розуміння суті гідролізу солей і вміння складати рівняння реакцій гідролізу.
Наведена схема відповідає гідролізу солі слабкої основи і сильної кислоти. Такими є цинк хлорид і ферум(ІІ) хлорид.
Відповідь: A.
ТЕМА: Загальна хімія. Солі. Гідроліз солей.
Завдання скеровано на перевірку розуміння суті гідролізу солі як реакції обміну з водою, уміння прогнозувати реакцію середовища водного розчину солі внаслідок гідролізу.
Калій сульфат – сіль сильної основи
Натрій сульфід – сіль сильної основи
Тобто внаслідок розчинення натрій сульфіду показник pH спочатку зростатиме аж до повного розчинення, після – не змінюватиметься (Б).
Алюміній нітрат – сіль слабкої основи
Тобто внаслідок розчинення алюміній нітрату показник pH спочатку зменшуватиметься аж до повного розчинення, після – не змінюватиметься (А).
Відповідь: 1Г; 2Б; 3А.
ТЕМА: Загальна хімія. Хімічна реакція. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі з огляду на її здатність до гідролізу.
Натрій карбонат – сіль сильної основи (натрій гідроксиду) і слабкої карбонатної кислоти. Реакція середовища її водного розчину лужна, тож фенолфталеїн набуде в ньому малинового кольору.
З-поміж солей, назви яких наведено у варіантах відповіді, сіллю сильної основи і слабкої кислоти є барій сульфід, тож середовище його водного розчину лужне, а фенолфталеїн у ньому набуде малинового кольору:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Хімічні властивості неорганічних сполук. Гідроліз солей.
Завдання скеровано на перевірку знання кольорів метилового оранжевого в кислому, лужному, нейтральному середовищах, уміння прогнозувати реакцію середовища водних розчинів солей.
Натрій нітрат – сіль сильної кислоти й сильної основи, реакція середовища її водного розчину нейтральна, колір метилового оранжевого в ньому – оранжевий.
Калій силікат – сіль слабкої кислоти й сильної основи, реакція середовища її водного розчину лужна, колір метилового оранжевого в ньому – жовтий.
Алюміній хлорид – сіль сильної кислоти й слабкої основи, реакція середовища її водного розчину кисла, колір метилового оранжевого в ньому – рожевий.
Відповідь: 1В; 2Г; 3Б.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Солі. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати середовище водного розчину солі та склад продуктів її реакції з іншою сіллю.
Лужне середовище у водних розчинах солей, утворених слабкими кислотами і сильними основами. Такими з-поміж наведених є калій етаноат і натрій сульфід.
Та з ферум(ІІ) нітратом у водному розчині з утворенням нерозчинної середньої солі реагує лише натрій сульфід.
Відповідь: B.
ТЕМА: Неорганічна хімія. Хімічні властивості неорганічних сполук. Гідроліз.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і летких сполук неметалічних елементів із Гідрогеном.
Середовище водного розчину амоніаку лужне. Він реагує з водою з утворенням катіона амонію й гідроксид-аніона:
Середовище водного розчину гідроген хлориду кисле:
Середовище водних розчинів амоній хлориду й алюміній хлориду кисле, бо це солі слабких основ і сильної хлоридної кислоти.
Середовище водного розчину натрій сульфіду лужне, бо це сіль сильної основи і слабкої сульфідної кислоти.
Середовище водних розчинів натрій сульфату і натрій хлориду нейтральне, бо це солі сильної основи і сильних кислот – сульфатної і хлоридної.
Відповідь: 1Б; 2Г; 3Д.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Гідроліз солей.
Завдання скеровано на перевірку вміння аналізувати хімічний склад речовин, прогнозувати середовище водного розчину солі й перебіг реакцій між електролітами у водних розчинах.
Лужне середовище в розчинах солей, утворених сильними основами і слабкими кислотами. Такими є калій етаноат і натрій сульфід. Однак із плюмбум(ІІ) нітратом у водному розчині реагує лише натрій сульфід.
Відповідь: B.
ТЕМА: Загальна хімія. Електролітична дисоціація кислот, лугів, солей у водних розчинах. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати тип середовища водних розчинів електролітів.
1. Кисле середовище у водних розчинах хлоридної кислоти та алюміній хлориду – солі сильної кислоти та слабкої основи (А).
2. Нейтральне середовище у водних розчинах натрій хлориду та натрій сульфату – солей сильної основи й сильних кислот (Г).
3. Лужне середовище у водних розчинах натрій гідроксиду й натрій сульфіду – солі сильної основи та слабкої кислоти (В).
Відповідь: 1А, 2Г, 3В.
ТЕМА: Загальна хімія. Гідроліз солей. Умови необоротності реакцій між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і можливість перебігу реакцій між електролітами у водних розчинах.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
Кисле середовище у водних розчинах плюмбум(ІІ) нітрату й цинк сульфату, нейтральне – натрій хлориду й калій нітрату. У водному розчині натрій карбонату середовище лужне.
Тобто в посудинах 1 і 3 можуть міститися розчини плюмбум(ІІ) нітрату й цинк сульфату, а в посудині 2 – натрій хлориду й калій нітрату.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
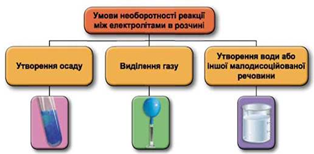
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Тобто розчин калій нітрату не може міститися в посудині 2, бо із жодною із солей, про які йдеться в завданні, не реагує. Отже, у посудині 2 міститься водний розчин натрій хлориду.
Потрібно розрізнити розчини двох солей – цинк сульфату та плюмбум(ІІ) нітрату. Плюмбум(ІІ) нітрат у водному розчині реагує як із натрій хлоридом, так й із цинк сульфатом з утворенням малорозчинних плюмбум(ІІ) хлориду й плюмбум(ІІ) сульфату. Тобто розчин плюмбум(ІІ) нітрат міститься в посудині 1, а цинк сульфату – у посудині 3.
| Номер посудини | 1 |
2 |
3 |
| 1 |
|||
| 2 |
– | ||
| 3 |
– |
Відповідь: 1В, 2Б, 3А.
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і забарвлення індикатора в них.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
| Сіль | утворена | Гідроліз | |
| Назва | основою | кислотою | |
| Амоній етаноат | слабкою | слабкою | за катіоном і за аніоном |
| Натрій етаноат | сильною | слабкою | за аніоном |
| Калій нітрат | сильною | сильною | не відбувається |
| Цинк нітрат | слабкою | сильною | за катіоном |
Відповідь: A.
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище). Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Калій силікат – сіль сильної основи (калій гідроксиду) і слабкої силікатної кислоти, тому середовище її водного розчину лужне.
Алюміній нітрат – сіль слабкої основи (алюміній гідроксиду) і слабкої силікатної кислоти, тому середовище її водного розчину кисле.
Натрій хлорид – сіль сильної основи (натрій гідроксиду) і сильної хлоридної кислоти, тому середовище її водного розчину нейтральне.
Відповідь: Б.
ТЕМА: Розчини. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі за результатами аналізування її складу за хімічною формулою.
Фенолфталеїн – специфічний індикатор лужного середовища, під дією гідроксид-аніонів набуває малинового забарвлення.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном. Унаслідок цього середовище розчину стає лужним.
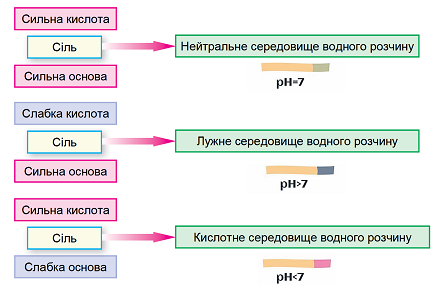
Рис. 1. Характер середовища водного розчину солі залежить від сили відповідних кислоти й основи
Умові задання відповідає калій карбонат.
Відповідь: B.
ТЕМА: Розчини. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі за результатами аналізування її складу за хімічною формулою.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
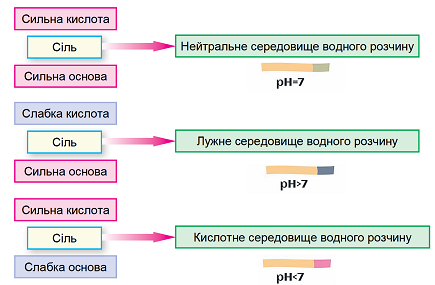
Рис. 1. Характер середовища водного розчину солі залежить від сили відповідних кислоти й основи
Умові задання відповідає амоній сульфат.
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Гідроліз солей. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах. Якісна реакція на сульфат-аніони.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу, перебіг реакцій йонного обміну між солями в розчині.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Тобто за умовою завдання потрібно визначити сіль сильної основи й слабкої кислоти. Такою сіллю є натрій силікат
Рівняння реакцій, описаних у завданні, такі:
Відповідь: Г.
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Тобто за умовою завдання потрібно визначити рядок, у якому послідовно наведено формули солей слабкої основи й сильної кислоти, сильної основи й сильної кислоти, сильної основи й слабкої кислоти.
Цій умові відповідають солі, формули яких наведено в рядку B. Адже
а
Відповідь: B.
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Як за аніоном, так і за катіоном відбувається гідроліз солі, утвореної катіоном слабкої основи й аніоном слабкої кислоти.
Адже
З-поміж солей, формули яких наведено в завданні, катіоном слабкої основи й аніоном слабкої кислоти утворено амоній карбонат.
Відповідь: Г.
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Тобто за умовою завдання потрібно визначити рядок, у якому послідовно наведено формули солей слабкої основи й сильної кислоти, сильної основи й сильної кислоти, сильної основи й слабкої кислоти.
Цій умові відповідають солі, формули яких наведено в рядку A. Адже
Відповідь: A.
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. Загальні відомості про неметалічні елементи й неметали. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання властивостей основних класів неорганічних сполук, розуміння процесу гідролізу солей і вміння визначати середовища водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз; розуміти, як визначити середовище водного розчину солі.
Проаналізуємо склад розчину кожної речовини й визначимо реакцію середовища.
1 – сульфур(IV) оксид (
Відповідь: Г.
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. рН розчинів.
Завдання скеровано на перевірку розуміння процесу гідролізу солей і вміння визначати середовище водного розчину солі залежно від того, якими електролітами утворена сіль, знання значень рН для кожного середовища.
Для виконання завдання необхідно знати, що таке гідроліз, розуміти, як визначити середовище водного розчину солі, знати значення рН для кожного середовища.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном, реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається електролітична дисоціація, реакція середовища – нейтральна.
| Середовище розчину солі | Значення рН |
| нейтральне | рН = 7 |
| кисле | рН < 7 |
| лужне | рН > 7 |
Аналізуємо твердження:
І. Водний розчин
ІІ. Водний розчин
Відповідь: B.
ТЕМА: Суміші речовин. Розчини. Гідроліз солей.
Завдання скеровано на перевірку розуміння процесу гідролізу солей і вміння визначати середовище водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз, розуміти як визначити середовище водного розчину солі.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном – реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається електролітична дисоціація, реакція середовища – нейтральна.
Проаналізуємо, якою основою і кислотою утворена кожна сіль, і визначимо реакцію середовища:
Зіставляємо визначене середовище водного розчину солі з варіантами відповідей.
Відповідь: A.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Гідроліз солей.
Завдання скеровано на перевірку знання гідролізу солей.
Для виконання завдання необхідно знати поняття гідроліз і розуміти, за яким йоном у водному розчині сіль зазнає гідролізу.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном, реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається дисоціація, реакція середовища – нейтральна.
Проаналізуємо, якою основою і кислотою утворена кожна сіль:
| Назва солі | Сіль утворено | Гідролізує за | ||
| основою | кислотою | |||
A |
алюміній хлорид | слабкою | сильною | катіоном |
Б |
амоній карбонат | слабкою | слабкою | катіоном |
B |
амоній сульфат | слабкою | сильною | катіоном |
Г |
натрій сульфід | сильною | слабкою | аніоном |
У водному розчині зазнає гідролізу як за катіоном, так і за аніоном амоній карбонат.
Відповідь: Б.




