Розділ: Речовина
Тема: Якісні реакції на катіони й аніони
Кількість завдань: 69
ТЕМА: Загальна хімія. Речовина. Якісні реакції на катіони й аніони.
Завдання скеровано на перевірку вміння аналізувати реакції йонного обміну між електролітами у водних розчинах і прогнозувати зовнішні ефекти їхнього перебігу.
Умову завдання задовольняють натрій карбонат (В) в посудині
Унаслідок дії на натрій карбонат
Унаслідок дії на нітратну кислоту
Унаслідок дії на барій гідроксид
Узагальнено:
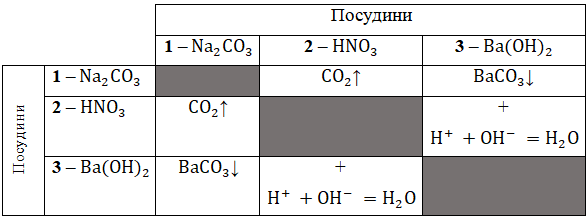
Відповідь: 1В, 2Г, 3Б.
ТЕМА: Загальна хімія. Гідроліз солей. Умови необоротності реакцій між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і можливість перебігу реакцій між електролітами у водних розчинах.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
Кисле середовище у водних розчинах плюмбум(ІІ) нітрату й цинк сульфату, нейтральне – натрій хлориду й калій нітрату. У водному розчині натрій карбонату середовище лужне.
Тобто в посудинах 1 і 3 можуть міститися розчини плюмбум(ІІ) нітрату й цинк сульфату, а в посудині 2 – натрій хлориду й калій нітрату.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
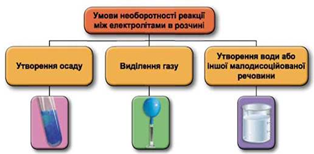
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Тобто розчин калій нітрату не може міститися в посудині 2, бо із жодною із солей, про які йдеться в завданні, не реагує. Отже, у посудині 2 міститься водний розчин натрій хлориду.
Потрібно розрізнити розчини двох солей – цинк сульфату та плюмбум(ІІ) нітрату. Плюмбум(ІІ) нітрат у водному розчині реагує як із натрій хлоридом, так й із цинк сульфатом з утворенням малорозчинних плюмбум(ІІ) хлориду й плюмбум(ІІ) сульфату. Тобто розчин плюмбум(ІІ) нітрат міститься в посудині 1, а цинк сульфату – у посудині 3.
| Номер посудини | 1 |
2 |
3 |
| 1 |
|||
| 2 |
– | ||
| 3 |
– |
Відповідь: 1В, 2Б, 3А.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
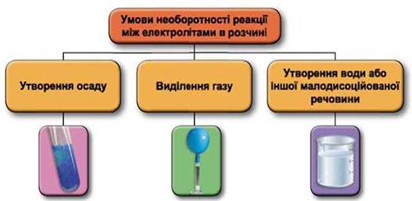
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Катіони Магнію взаємодіють із гідроксид-аніонами з утворенням осаду – малорозчинного магній гідроксиду.
Сульфат-аніони зв’язують катіони Барію в нерозчинний барій сульфат.
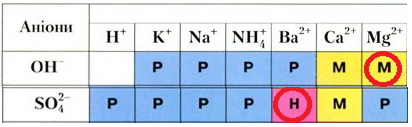
Рис. 2. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Г.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин.
Розбавлена хлоридна кислота не реагує з міддю, а концентрована нітратна – реагує.
Натрій сульфат на відміну від натрій нітрату реагує з барій хлоридом.
Унаслідок реакції з лугом алюміній хлориду і магній хлориду у водному розчині утворюються осади відповідних гідроксидів. Однак осад алюміній гідроксиду, на відміну від осаду магній гідроксиду, розчиняється в надлишку лугу.
Відповідь: 1А, 2Б, 3Д.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності реакцій між електролітами в розчині.
Хлоридна кислота є сильною, тому може витіснити із солей слабші за неї сульфідну, залишок якої є в натрій сульфіді (варіант відповіді А) і сульфітну, залишок якої є в натрій сульфіті (варіант відповіді Г) кислоти. Однак осад з барій хлоридом у водному розчині утворить лише натрій сульфіт – він є малорозчинною речовиною, а барій сульфід розчиняється у воді (рис. 1).
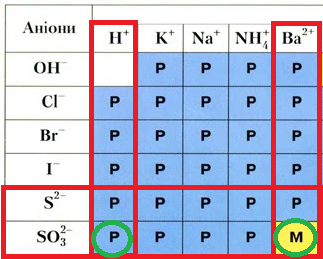
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей у воді за температури 20–25 °С»
Відповідь: Г.
ТЕМА: Розчини. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Під час розв’язування завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20‑25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
У першій пробірці містився розчин солі карбонатної кислоти, оскільки під дією сильної сульфатної кислоти виділився газ – карбон(IV) оксид:
У другій пробірці містився розчин солі Магнію, бо внаслідок дії водного розчину натрій гідроксиду утворився осад магній гідроксиду:
У третій пробірці був розчин солі Барію, бо внаслідок дії водного розчину сульфатної кислоти утворився осад барій сульфату:
Відповідь: 1Б, 2Д, 3А.
ТЕМА: Основні класи неорганічних сполук. Солі. Реакції обміну між електролітами в розчині. Явище амфотерності.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
У кожну пробірку добавляли краплями водний розчин калій гідроксиду. У пробірках 1 і 3 утворився осад, а в пробірці 2 змін не було. Із калій гідроксидом не реагуватиме натрій хлорид. Тому пошуки правильної відповіді потрібно обмежити варіантами А і Г.
У пробірці 3 під дією надлишку лугу спостерігали швидке розчинення осаду, що утворився на попередньому етапі досліду, а в пробірці 1 осад не розчинився. Це дає змогу дійти висновку, що від початку в пробірці 1 був розчин магній хлориду. Унаслідок дії на нього розчину лугу утворився осад основного магній гідроксиду, що за описаних умов досліду з лугами не реагує.
Натомість цинк гідроксид, осад якого утворився під дією лугу в розчині на цинк хлорид, є амфотерним, тобто реагує і з кислотами, і з лугами.
Суть реакцій, що відбулися, можна описати за допомогою скорочених йонних рівнянь:
Відповідь: A.
ТЕМА: Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати склад солей за допомогою якісних реакцій на йони.
Узявши до уваги дані, наведені в довідковій таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді», можна дійти висновку, що для підтвердження якісного складу барій хлориду потрібно використати водні розчини калій сульфату й аргентум(І) нітрату. Адже реактивом на катіони Барію є сульфат-аніони, а реактивом на хлорид-аніони є катіони аргентуму(І):
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Гідроліз солей. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах. Якісна реакція на сульфат-аніони.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу, перебіг реакцій йонного обміну між солями в розчині.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Тобто за умовою завдання потрібно визначити сіль сильної основи й слабкої кислоти. Такою сіллю є натрій силікат
Рівняння реакцій, описаних у завданні, такі:
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння ідентифікувати речовини за допомогою якісних реакцій на йони в їхньому складі.
Для правильного розв’язання завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
1 |
Під дією хлоридної кислоти на калій силікат (В) утвориться осад силікатної кислоти. Унаслідок реакції калій силікату з барій хлоридом у розчині утвориться осад барій силікату. |
2 |
Магній сульфат (А) у розчині не реагує ні з хлоридною кислотою, ні з барій хлоридом, усі ці речовини перебувають у розчині у формі йонів. |
3 |
Натрій карбонат (Б) реагує з хлоридною кислотою з виділенням газу. Унаслідок взаємодії з барій хлоридом у розчині утворюється осад барій карбонату. |
Відповідь: 1В, 2А, 3Б.
ТЕМА: Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати склад солей за допомогою якісних реакцій на йони.
Узявши до уваги дані, наведені в довідковій таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді», можна дійти висновку, що сіль, про яку йдеться в умові завдання, – натрій гідрогенкарбонат. Рівняння реакцій, описаних у завданні, такі:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах.
Завдання скеровано на перевірку знання властивостей речовин, уміння прогнозувати їхню здатність реагувати з водою, забарвлення індикатора в розчині.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Середовище водного розчину амоніаку лужне внаслідок перебігу реакції за схемою
Гідроксид-аніони у водному розчині амоніаку зумовлюють лужну реакцію середовища в ньому.
Натрій хлорид – сіль сильної основи й сильної кислоти – не зазнає гідролізу, тож середовище його водного розчину нейтральне.
Водний розчин гідроген сульфіду – слабка сульфідна кислота.
Сульфур(IV) оксид – кислотний, унаслідок його змішування з водою утворюється слабка сульфітна кислота.
Відповідь: A.
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Для виконання завдання необхідно знати, за яких умов відбуваються реакції обміну між електролітами в розчинах.
Проаналізуємо описані в завданні досліди й зіставимо їх із варіантами відповіді.
У першій пробірці після добавляння до розчину речовини Х розчину барій нітрату утворився осад:
У другій пробірці після добавляння до розчину речовини Х розчину натрій гідроксиду також утворюється осад:
Відповідь: A.
ТЕМА: Суміші речовин. Розчини. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку розуміння реакцій йонного обміну, якісне виявлення катіонів Ферум(3+).
Для виконання завдання необхідно знати, що осадити катіон можна аніоном, і вміти користуватися таблицею розчинності.
Проаналізуємо запропоновані водні розчини на вміст аніонів і за допомогою таблиці розчинності визначимо, який саме аніон з катіоном
| Катіон | |||
| Аніон | |||
A |
p | ||
Б |
н | ||
B |
p | ||
Г |
p | ||
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Амоніак. Йони амонію.
Завдання скеровано на перевірку знання якісної реакції на катіони амонію.
Реактивом на катіони амонію є гідроксид-аніони:
Унаслідок реакції виділяється амоніак – газ iз характерним різким запахом, у якому вологий універсальний індикаторний папірець набуває синього кольору.
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічні речовини та їхні властивості. Електролітична дисоціація. Якісні реакції на катіони й аніони.
Завдання скеровано на перевірку вміння доводити якісний склад неорганічних речовин за допомогою характерних реакцій на катіони й аніони в їхньому складі.
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони. Тому реагує з алюмінієм з утворенням відповідної солі та водню і з аргентум(І) нітратом з утворенням осаду аргентум(І) хлориду:
Відповідь: B.
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за хімічною формулою.
Завдання скеровано на перевірку вміння розпізнавати аніони за допомогою якісних реакцій та обчислювати молярну масу речовини за хімічною формулою.
Умову завдання задовольняє силікат-аніон. Під дією хлоридної кислоти на розчинний силікат випадає склоподібний осад силікатної кислоти. Осад розчиняється внаслідок нейтралізації кислоти лугом.
Відповідь: 76.
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною і реагентом.
Пірохімічний аналіз (від грец. πυρо́ς – вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (див. рисунок).
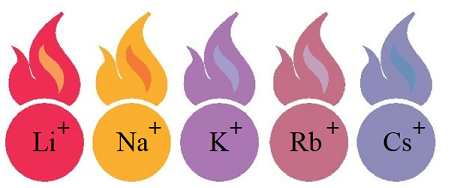
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Калію.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді магній сульфат дисоціює на йони:
З-поміж аніонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із катіоном Магнію утворюють лише гідроксид-аніони:
З-поміж катіонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із сульфат-аніоном утворюють лише катіони Барію:
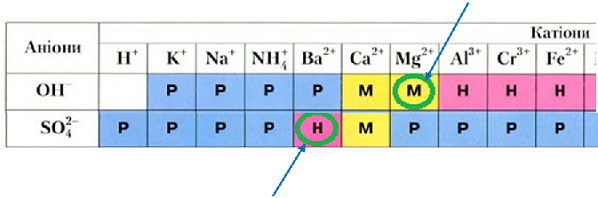
Тобто для підтвердження якісного складу магній сульфату потрібно використати водні розчини натрій гідроксиду і барій хлориду.
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Солі.
Завдання перевіряє вміння якісно визначати солі за аніоном.
Для розв’язання завдання необхідно знати якісні реакції на аніони. За умовою завдання є водні розчини солей магній нітрат
з нітрат-аніонами катіони барію не реагують. Таким чином, магній сульфат можна відрізнити від магній нітрату, використавши водний розчин барій хлориду.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання якісного визначення лужних металічних елементів у сполуках, а саме Калію, і взаємодію солей з кислотами.
Для розв’язання завдання необхідно знати, що із запропонованих лише солі Калію забарвлюють полум’я у фіолетовий колір. Таких солей дві (А і Г). Далі в умові зазначено, що сіль реагує з хлоридною кислотою з виділенням газу. Із двох солей з утворенням газуватої речовини з хлоридною кислотою реагує лише
Відповідь: A.
ТЕМА: Розчини. Електролітична дисоціація, йонно-молекулярні рівняння.
Завдання перевіряє вміння визначати можливість перебігу реакції обміну між електролітами в розчинах.
Для виконання завдання необхідно розуміти що означає осадити йон і за яких умов можлива реакція між електролітами в розчинах, уміння користуватися таблицею розчинності.
Осадити йон означає зв’язати його іншим йоном в осад. В умові завдання йдеться про катіон, а катіон можна осадити аніоном. Проаналізуємо, які є аніони в запропонованих варіантах водних розчинів:
За таблицею розчинності, яка є в тестовому зошиті, визначаємо, з яким із запропонованих аніонів катіон
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами. Неорганічна хімія. Основні класи неорганічних сполук. Хімічні властивості солей і лугів. Добування нерозчинних основ.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині, знання хімічних властивостей солей і лугів.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині, уміти користуватися таблицею розчинності, знати хімічні властивості солей і лугів, способи добування нерозчинних основ.
Однією з умов, за якою відбувається реакція обміну в розчині, є утворення осаду.
У пробірці 1 осад не утворюється, тому що реакція між калій сульфатом і натрій гідроксидом не відбувається, речовини перебувають в розчині у вигляді йонів:
У пробірці 2 осад утворюється, тому що реакція між купрум(ІІ) сульфатом і натрій гідроксидом відбувається з утворенням нерозчинної основи купрум(ІІ) гідроксиду:
Відповідь: B.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами у розчині, уміти користуватися таблицею розчинності. Реакція у водних розчинах відбувається за умови утворення осаду, або газу, або води. У завданні необхідно визначити, між якими речовинами відбувається реакція з утворенням осаду. Перша пара речовин магній хлорид і арґентум нітрат, унаслідок зливання водних розчинів цих речовин утворюється осад:
Магній хлорид і натрій нітрат не взаємодіють між собою у водному розчині. Розчини сульфатної кислоти і натрій карбонату взаємодіють з утворенням газу, а за умовою завдання необхідно, щоб випав осад. Розчини сульфатної кислоти і натрій гідроксиду взаємодіють з утворенням води.
Отже, завдання має лише одну правильну відповідь – А.
Відповідь: A.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині, уміти користуватися таблицею розчинності.
У завданні наведено карбонат-аніон
Отже, правильна відповідь – Б.
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині. Магній сульфат і магній нітрат – солі магнію, тому відрізнити їх можна лише за аніоном. Сульфат від нітрату у водному розчині можна відрізнити катіонами барію, із запропонованих речовин це водний розчин барій хлориду. Магній сульфат у водному розчині вступає в реакцію з барій хлоридом, а магній нітрат – ні.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Розчини. Йонно-молекулярне рівняння. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей і умови необоротності реакцій обміну між електролітами в розчині для прогнозування можливості перебігу хімічних реакцій, їхніх продуктів.
Солі, про які йдеться в завданні, утворені катіоном Магнію i різними аніонами – хлорид-аніоном і нітрат-аніоном. З-поміж йонів, назви яких наведено у варіантах відповіді, два катіони й два аніони. Тобто для розрізнення розчинів магній хлориду й магній нітрату потрібно використати певний катіон, який осаджуватиме або нітрат-, або хлорид-аніон.
Скориставшись таблицею розчинності, легко дійти висновку, що цю умову задовольняє катіон Аргентуму(І):
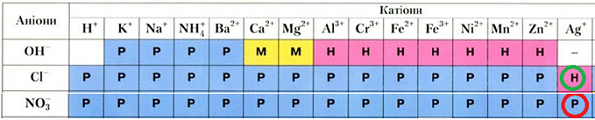
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей, визначати можливість перебігу реакції обміну між електролітами в розчині.
Проаналізувавши умову завдання, можна дійти висновку, що її задовольнить речовина, яка у водному розчині дисоціює з утворенням:
- аніонів, які осаджують катіони Калію і Барію;
- катіонів, які утворюють осад із гідроксид- і хлорид-аніонами.
Цю умову з-поміж наведених варіантів відповіді задовольняє лише магній сульфат:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді калій нітрат, натрій карбонат і кальцій хлорид дисоціюють на йони:
З-поміж йонів, які утворюються внаслідок електролітичної дисоціації речовин, про які йдеться в завданні, осад утворюється лише внаслідок взаємодії катіонів Кальцію і карбонат-аніонів:
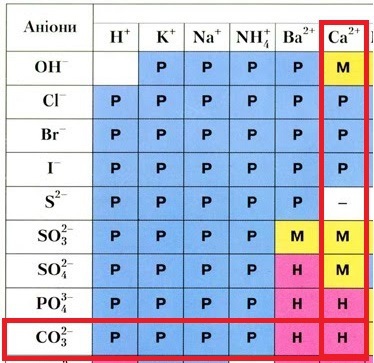
Тому осад випаде лише в пробірці ІІ.
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Дія основних класів сполук на індикатор.
Завдання перевіряє знання кольору універсального індикаторного папірця залежно від середовища та дії на індикатор водневих сполук неметалічних елементів і оксидів неметалічних елементів за наявності води.
Для виконання завдання необхідно знати, що універсальний індикаторний папірець змінює колір на синій у лужному середовищі. Із наведених сполук лужне середовище в присутності води дає лише
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі деяких йонів.
Скорочені йонні рівняння реакцій, про які йдеться в завданні, такі:
Відповідь: 1Г, 2А, 3Б, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій між неорганічними сполуками різних класів.
Унаслідок реакції нейтралізації барій гідроксиду нітратною кислотою утворюються барій нітрат і вода:
Унаслідок реакції між барій хлоридом і калій сульфатом у водному розчині утворюються калій хлорид і нерозчинний барій сульфат:
Унаслідок дії сильної нелеткої сульфатної кислоти на натрій хлорид – сіль леткої хлоридної кислоти – утворюється натрій гідрогенсульфат і виділяється газуватий гідроген хлорид:
Відповідь: 2В, 3А, 4Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами у водних розчинах.
Завдання скеровано на перевірку розуміння умов необоротності реакцій обміну між електролітами у водних розчинах.
Відповідь: Б, А, Г, В
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування можливості перебігу реакцій йонного обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
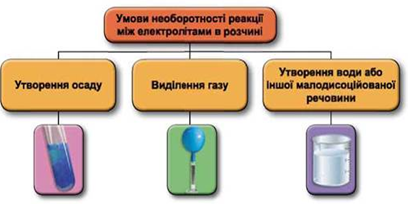
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині відбудеться реакція між аргентум(І) нітратом і калій хлоридом:
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування можливості перебігу реакцій йонного обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
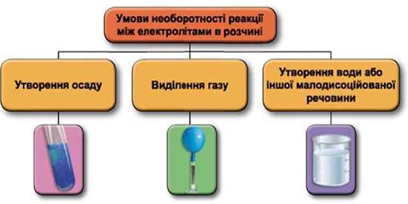
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Одночасно в розчині не можуть перебувати катіони Барію та ортофосфат-аніони, оскільки реагують з утворенням нерозчинного барій ортофосфату:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Умовою необоротності перебігу реакцій між електролітами у водному розчині є утворення води, осаду, виділення газу.
Між натрій нітратом і калій сульфатом (варіант відповіді А) реакція не відбувається, бо як реагенти, так і продукти реакції є сильними електролітами.
Між речовинами, формули яких наведено у варіантах відповіді Б – Г відбуваються хімічні реакції:
Б
В
Г
Відповідь: A.
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів. Якісна реакція на карбонат-аніони.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом.
Пірохімічний аналіз (від грец. πυρо́ς - вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (рис. 1).
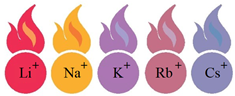
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Натрію.
Газ виділиться внаслідок дії хлоридної кислоти на натрій гідрогенкарбонат:
Відповідь: Г.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
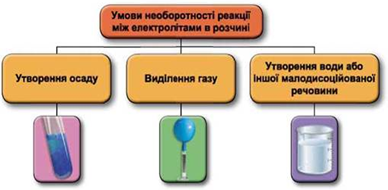
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій нітрат (В), на відміну від аргентум(І) нітрату (Г), не реагує з калій хлоридом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
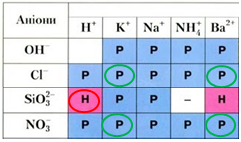
Рис. 2. Хлориди й нітрати Калію і Барію – розчинні речовини, а силікатна кислота нерозчинна
Унаслідок реакції між сульфатною кислотою і натрій силікатом (А) утворюється нерозчинна силікатна кислота, а в реакції з натрій карбонатом виділяється карбон(IV) оксид (Б).
Відповідь: B.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
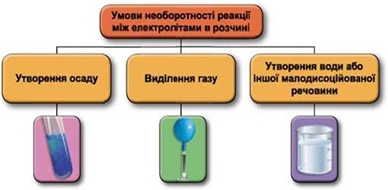
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити катіони Барію з водного розчину барій хлориду можна за допомогою розчину натрій карбонату (рис. 2).
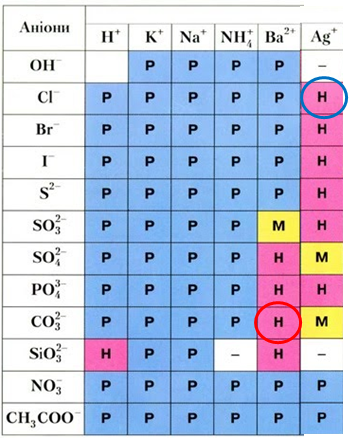
Рис. 2. Барій карбонат утворюється внаслідок осадження катіонами Барію карбонат-аніонами
Унаслідок дії калій нітрату й натрій етаноату на барій хлорид усі речовини залишаються в розчині у формі йонів, тобто про осадження не йдеться. Аргентум(І) нітрат осадить із розчину барій хлориду аніони Хлору. Барій карбонат є нерозчинною речовиною, тому для осадження з розчину барій хлориду катіонів Барію можна використати водний розчин натрій карбонату.
Відповідь: B.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
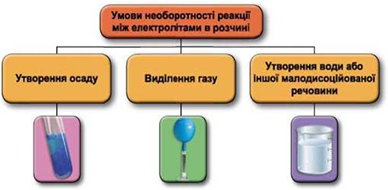
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Натрій нітрат (А), на відміну від натрій силікату (Б), не реагує з хлоридною кислотою у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
Рис. 2. Натрій хлорид – розчинна речовина, натомість силікатна кислота й ферум(ІІІ) гідроксид нерозчинні, магній гідроксид – малорозчинний
Унаслідок реакції між ферум(ІІІ) хлоридом і лугом (В) утворюється нерозчинний ферум(ІІІ) гідроксид, а в реакції між магній хлоридом і лугом – малорозчинний магній гідроксид (Г).
Відповідь: A.
ТЕМА: Неорганічні речовини. Кислоти й основи.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів неорганічних речовин і продуктів їхньої взаємодії з водою.
А азот не реагує з водою, його водний розчин не діє на індикатор
Б водний розчин амоніаку має лужне середовище, гідроген сульфіду – слабокисле, тому в амоніаку й гідроген сульфіді універсальний індикаторний папірець змінює забарвлення на синє і рожеве відповідно
В нітроген(І) оксид несолетворний, його водний розчин, так само як і водний розчин азоту, не діє на індикатор
Г нітроген(ІІ) оксид несолетворний, його водний розчин, так само як і водний розчин азоту, не діє на індикатор
Відповідь: Б.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
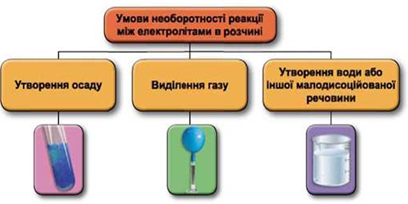
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів барій нітрату й натрій сульфату утвориться осад барій сульфату:
Відповідь: Б.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
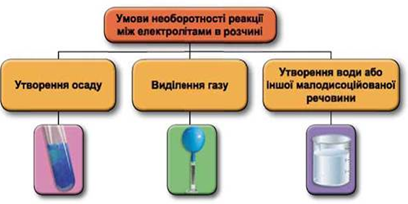
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів натрій карбонату та барій хлориду утвориться осад барій карбонату:
Відповідь: Б.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
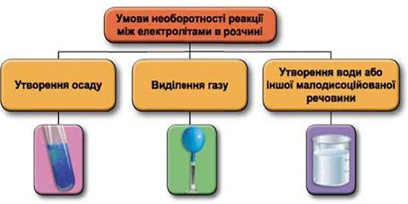
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують купрум(ІІ) сульфат і барій хлорид, унаслідок цього утворюється осад барій сульфату:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Реактивом на хлорид-аніони є катіони Аргентуму(І), за їхньою допомогою можна розрізнити водні розчини натрій хлориду й натрій нітрату:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
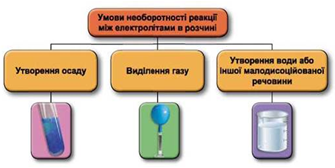
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою натрій нітрат і кальцій гідроксид, оскільки поміж йонів, які утворюються внаслідок їхньої електролітичної дисоціації, немає таких, що взаємодіють з утворенням слабкого електроліту.
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
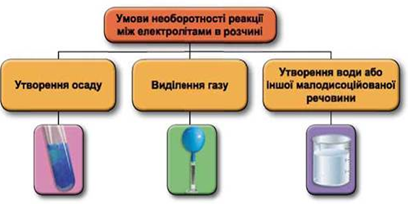
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою калій хлорид і натрій нітрат:
Відповідь: Г.
ТЕМА: Неорганічні речовини. Карбонатна кислота та її солі.
Завдання скеровано на перевірку знання хімічних властивостей карбонатів як солей слабкої та нестійкої карбонатної кислоти.
Солі карбонатної кислоти реагують із кислотами. Характерною ознакою перебігу таких реакцій є виділення вуглекислого газу. Столовий оцет – водний розчин етанової кислоти. Тож між нею і карбонатами Магнію і Кальцію відбуваються такі реакції:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
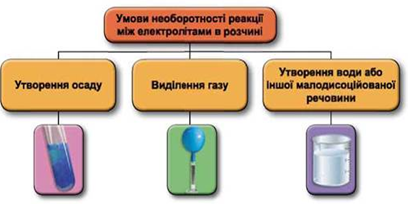
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою аргентум(І) нітрат і калій хлорид, одним із продуктів реакції є осад аргентум(І) хлориду:
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Умовою необоротності перебігу реакцій між електролітами у водному розчині є утворення води, осаду, виділення газу.
A
Б
B
Г
Відповідь: Б.
ТЕМА: Загальна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розрізнення розчинів речовин.
Обидві солі містять катіон Магнію, тому розрізнити їх можна лише за аніонами. Реактивом на сульфат-аніон є катіон Барію, унаслідок їхньої взаємодії утворюється нерозчинний барій сульфат. Натомість барій хлорид є розчинною речовиною (рис. 1).
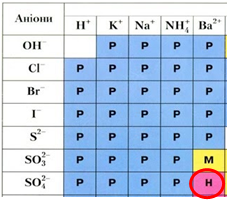
Рис. 1. Реактивом на сульфат-аніон є катіон Барію
Відповідь: B.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
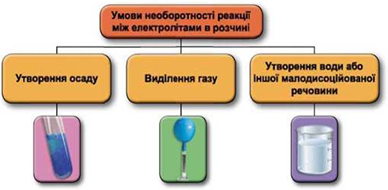
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити карбонат-аніони з водного розчину можна за допомогою розчину барій хлориду (рис. 2).
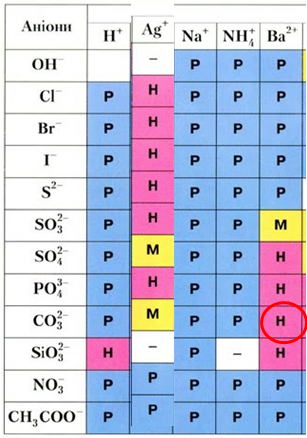
Рис. 2. Барій карбонат утворюється внаслідок осадження карбонат-аніонів катіонами Барію
Унаслідок дії сульфатної та етанової кислот на карбонат-аніони виділяється газ – карбон(ІV) оксид, тобто про осадження не йдеться. Натрій карбонат є розчинною речовиною, тож осадити карбонат-аніони за допомогою розчину натрій хлориду не можна. Натомість барій карбонат є нерозчинною речовиною, тому для осадження карбонат-аніонів можна використати водний розчин барій хлориду.
Відповідь: Г.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
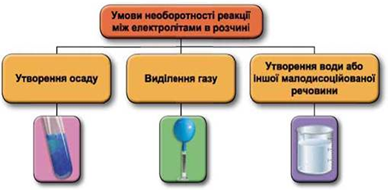
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій хлорид (А), на відміну від магній хлориду (Б), не реагує з натрій гідроксидом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
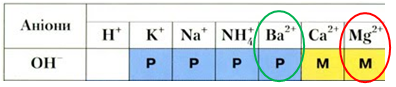
Рис. 2. Барій гідроксид – розчинна речовина, натомість магній гідроксид малорозчинний
Сильна й нелетка сульфатна кислота витісняє слабку й летку карбонатну з її солі (В), а сильна нітратна кислота – слабку сульфітну. Також можливе окиснення сульфітної кислоти до сульфатної (Г).
Відповідь: A.
ТЕМА: Неорганічна хімія. Органічна хімія. Алкани. Карбон(IV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей алканів і карбон(IV) оксиду, якісної реакції на карбон(IV) оксид.
Реактивом на карбон(IV) оксид є вапняна вода:
Унаслідок пропускання карбон(IV) оксиду крізь неї утворюється білий осад кальцій карбонату.
Пропан як представник алканів із кальцій гідроксидом не реагує.
Відповідь: А.
ТЕМА: Основні класи неорганічних сполук. Реакції обміну між електролітами у розчині.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій обміну між електролітами в розчині, продукти цих реакцій.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
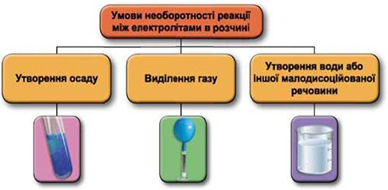
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє натрій карбонат:
Сильна хлоридна кислота витісняє слабку й нестійку карбонатну кислоту з її солі (рис. 2).
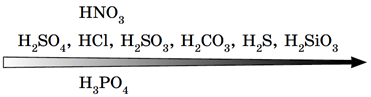
Рис. 2. Витискувальний ряд кислот
Відповідь: В.
ТЕМА: Основні класи неорганічних сполук. Солі. Реакції обміну між електролітами у розчині. Явище амфотерності.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Якщо в кожну пробірку добавляти краплями водний розчин натрій гідроксиду спочатку в обох пробірках утворяться осади нерозчинних гідроксидів. Магній гідроксид осно́вний, тому з надлишком лугу не реагуватиме. Натомість осад амфотерного алюміній гідроксиду в надлишку лугу розчиниться.
Суть реакцій, що відбулися, можна описати за допомогою скорочених йонних рівнянь:
Відповідь: А.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
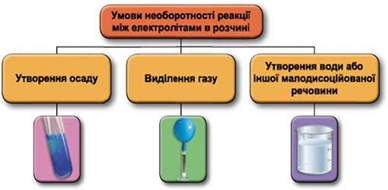
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують барій сульфат і хлоридна кислота – летка хлоридна кислота не витісняє сильну нелетку сульфатну кислоту з її солі – нерозчинного барій сульфату (рис. 2).
Рис. 2. Витискувальний ряд кислот
У решті поданих варіантів відповіді внаслідок перебігу реакцій між речовинами в розчинах утворюються осади силікатної кислоти (А), ферум(ІІ) гідроксиду (В), барій карбонату (Г).
Відповідь: В.
ТЕМА: Загальна хімія. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
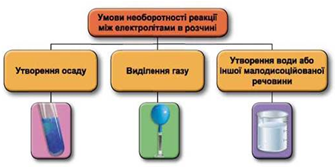
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Між собою у водному розчині не реагують натрій нітрат і калій хлорид, тому що йони, які утворюються внаслідок їхньої дисоціації, не взаємодіють між собою з утворенням слабких електролітів (газу, осаду, води тощо):
| A |
|
| Б |
|
| B |
|
| Г |
|
Відповідь: B.
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
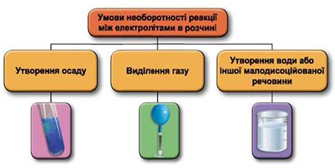
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити катіони Феруму(ІІІ) з водного розчину ферум(ІІІ) нітрату можна гідроксид-аніонами, які утворюються внаслідок електролітичної дисоціації натрій гідроксиду:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
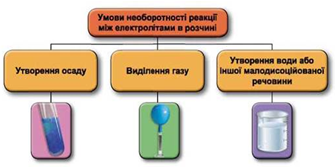
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою барій гідроксид і ферум(ІІІ) хлорид, бо внаслідок взаємодії катіона Феруму(ІІІ) з гідроксид-аніонами утворюється нерозчинний ферум(ІІІ) гідроксид:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
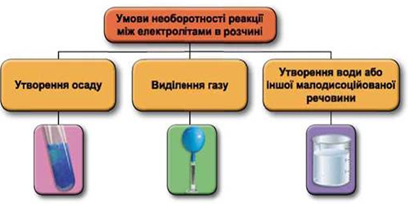
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє хлоридна кислота, яка не реагує з натрій сульфатом і реагує з натрій карбонатом:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
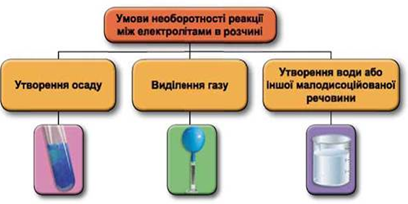
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція між барій гідроксидом і калій сульфатом:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині для розпізнавання деяких йонів за допомогою якісних реакцій.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
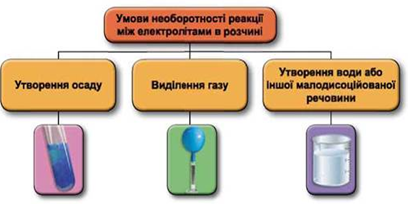
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом.
У цьому контексті реагент – речовина відомого складу, яку використовують для виявлення йонів у складі аналізованої речовини.
Якісні (характерні) реакції супроводжувані добре помітними змінами, як-от: утворення або розчинення осаду, поява інтенсивного забарвлення або знебарвлення розчину, виділення або поглинання газу, утворення кристалів характерної форми тощо. Якісний аналіз у водних розчинах ґрунтується на йонних реакціях і дає змогу виявити катіони або аніони.
Водний розчин натрій хлорид можна відрізнити від водного розчину натрій ацетату за допомогою аргентум(І) нітрату. Катіони Аргентуму(І) із хлорид аніонами утворюють нерозчинний аргентум(І) хлорид – білий сирнистий осад, стійкий до дії нітратної кислоти:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Сульфатна кислота. Якісна реакція на сульфат-аніон.
Завдання скеровано на перевірку вміння визначати склад неорганічних речовин за допомогою якісних реакцій.
Формула сульфатної кислоти
Реакція із цинком доводить, що в молекулі сульфатної кислоти є атоми Гідрогени:
Реакція з із барій нітратом у розчині доводить, що в молекулі сульфатної кислоти є залишок сульфат:
Відповідь: B.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. За умовою завдання мають прореагувати дві розчинні сполуки, одна з яких дисоціює з утворенням катіона Алюмінію, а друга – з утворенням гідроксид-аніона. Умову завдання задовольняють алюміній нітрат і калій гідроксид:
Відповідь: A.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
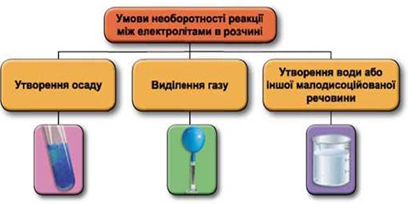
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Реакція у водному розчині відбудеться між натрій сульфатом і барій нітратом:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Луги. Індикатори. Реакція нейтралізації.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації та знання кольорів індикаторів у різних середовищах – лужному, кислому, нейтральному.
У водному розчині калій гідроксиду є гідроксид-аніони, під дією яких фенолфталеїн набуває малинового кольору. Унаслідок поступового додавання хлоридної кислоти відбувається реакція нейтралізації, гідроксид-аніони реагують із катіонами Гідрогену:
Тому учень, який до розбавленого водного розчину калій гідроксиду, підфарбованого фенолфталеїном, поступово добавлятиме хлоридну кислоту, спостерігатиме знебарвлення розчину.
Відповідь: Г.




