Розділ: Метали й неметали
Тема: Загальні відомості про неметалічні елементи та неметали
Кількість завдань: 96
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^-_3}\).
Для пом’якшення води використовують кип’ятіння, що забезпечує перетворення розчинних гідрогенкарбонатів Кальцію і Магнію на нерозчинні карбонати цих елементів:
\begin{gather*} \mathrm{Ca(HCO_3)_2=CaCO_3\downarrow +\ CO_2\uparrow +\ H_2O};\\[7pt] \mathrm{Mg(HCO_3)_2=MgCO_3\downarrow +\ CO_2\uparrow +\ H_2O}. \end{gather*}Відповідь: Г.
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза. Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється стійка оксидна плівка.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
ТЕМА: Групи хімічних елементів.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі галогенів і їхніх сполук.
Хлор як активніший галоген витісняє менш активні галогени \(\mathrm{(Br,\ I)}\) з їхніх солей у водних розчинах. Тому внаслідок пропускання хлору крізь водний розчин натрій йодиду виділиться йод і розчин набуде бурого кольору:
$$ \mathrm{2NaI+Cl_2=2NaCl+I_2}. $$Відповідь: Г.
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку знання тривіальних назв деяких неорганічних речовин.
Хімічна формула амоніаку \(\mathrm{NH_3}\), тривіальна назва водного розчину якого – нашатирний спирт.
Відповідь: B.
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду й уміння прогнозувати можливість перебігу реакцій за його участі.
Карбон(ІV) оксид є кислотним, йому відповідає слабка карбонатна кислота. Як кислотний оксид він реагує з лугами (гідроксидами Натрію і Барію) та з основним калій оксидом.
З іншим кислотним силіцій(ІV) оксидом карбон(ІV) оксид не реагує.
Відповідь: A.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Твердість води.
Завдання скеровано на перевірку знання причин твердості води й способів її пом’якшення.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів, що містяться в ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють з певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{SO^{2-}_4}\) i \(\mathrm{NO^-_3}\).
Тимчасову (карбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^-_3}\). Її усувають кип’ятінням, яке забезпечує перетворення розчинних гідрогенкарбонатів Кальцію і Магнію на нерозчинні карбонати цих елементів:
Також для усунення тимчасової твердості води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і Магнію:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени. Гідроген хлорид.
Завдання скеровано на перевірку знання промислових способів добування гідроген хлориду.
Одним зі способів промислового добування гідроген хлориду є синтез із простих речовин:
$$ \mathrm{H_2+Cl_2=2HCl}. $$Відповідь: A.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Алотропні видозміни Карбону.
Завдання скеровано на перевірку розуміння поняття алотропія, знання алотропних видозмін Карбону.
Алотропи – різні структурні модифікації одного елемента, мають різні фізичні й хімічні властивості. Алмаз (рис. 1) і графіт (рис. 2) є алотропами Карбону.
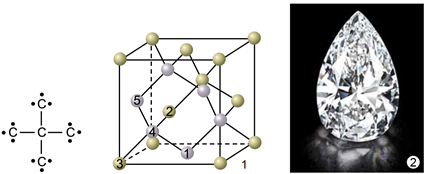
Рис. 1. 1. Модель кристалічних ґраток алмазу. 2. Діамант – огранений алмаз
У кристалічних ґратках алмазу всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні. Атоми Карбону в графіті розташовані плоскими сітками.

Рис. 2. 1. Модель кристалічних ґраток графіту. 2. Кристал графіту
Відповідь: A.
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
У промисловості з двох простих речовин синтезують амоніак:
$$ \mathrm{N_2+3H_2\rightarrow 2NH_3}. $$Відповідь: A.
ТЕМА: Неорганічна хімія. Амоніак. Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку й уміння класифікувати хімічні реакції.
Амоніак і гідроген бромід вступають у реакцію сполучення з утворенням солі – амоній броміду: $$ \mathrm{HN_3+HBr=NH_4Br}. $$
Відповідь: Г.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності й окиснювальних властивостей хімічних елементів у періодах і групах (рис. 1).
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: Г Б А В.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Неметали. Озон. Хлор.
Завдання скеровано на перевірку знання галузей застосування неметалів.
Найпоширенішими дезінфектантами води на водопровідних станціях є хлор й озон. Протонні числа Хлору й Оксигену – \(17\) і \(8\) відповідно.
Відповідь: 25.
ТЕМА: Неорганічна хімія. Сполуки неметалічних елементів. Амоніак.
Завдання скеровано на перевірку знання способів добування деяких неорганічних речовин.
Умову завдання задовольняє амоніак, який у промисловості синтезують з азоту й водню:
$$ \mathrm{N_2+3H_2=2NH_3.} $$Відповідь: B.
ТЕМА: Неорганічна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку знання лабораторних способів добування кисню.
У лабораторії кисень добувають розкладанням гідроген пероксиду, калій перманганату, натрій нітрату:
\begin{gather*} \mathrm{2H_2O_2=2H_2O+O_2\uparrow ;}\\[7pt] \mathrm{2KMnO_4=K_2MnO_4+MnO_2+O_2\uparrow ;}\\[7pt] \mathrm{2NaNO_3=2NaNO_2+O_2\uparrow .} \end{gather*}Відповідь: Б.
ТЕМА: Загальна хімія. Неорганічна хімія. Метали. Неметали.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння реакцій між металами й неметалами.
| Хімічне рівняння | Сума коефіцієнтів | |
| $$ \mathrm{Ca+S=CaS} $$ | 3 | Г |
| $$ \mathrm{3Ca+N_2=Ca_3N_2} $$ | 5 | A |
| $$ \mathrm{4Li+O_2=2Li_2O} $$ | 7 | Б |
| $$ \mathrm{4Al+3O_2=2Al_2O_3} $$ | 9 | B |
Відповідь: Г А Б В.
ТЕМА: Алотропія. Кисень. Озон.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних форм Оксигену.
Алотропія – явище існування одного хімічного елемента у вигляді кількох простих речовин з різними властивостями – алотропних видозмін (модифікацій).
Алотропні модифікації здатні взаємоперетворюватися. Кисень \(\mathrm{O_2}\) й озон \(\mathrm{O_3}\) – алотропні видозміни Оксигену (рис. 1).
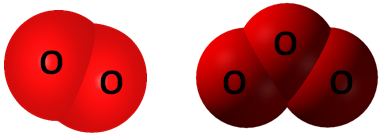
Рис. 1. Моделі молекул алотропних видозмін Оксигену: кисень \(\mathrm{O_2}\) й озон \(\mathrm{O_3}\)
Відповідь: B.
ТЕМА: Загальна хімія. Електронна формула. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодичній системі.
У завданні наведено електронні формули атомів елементів третього періоду. У періоді зі збільшенням кількості електронів на зовнішньому енергетичному рівні атомів посилюються неметалічні властивості хімічних елементів.
| $$ 1s^22s^22p^63s^1 $$ | Б |
| $$ 1s^22s^22p^63s^2 $$ | A |
| $$ 1s^22s^22p^63s^23p^1 $$ | Г |
| $$ 1s^22s^22p^63s^23p^2 $$ | B |
Відповідь: Б А Г В.
ТЕМА: Неорганічна хімія. Органічна хімія. Амоніак. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння порівнювати основні властивості амоніаку й амінів.
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього на атомі Нітрогену електрон на густина зменшується, і тому зменшуються осно́вні властивості аміногрупи. Тож у воді анілін виявляє слабші основні властивості, ніж амоніак.
Амоніак виявляє слабші основні властивості порівняно з метиламіном, оскільки замісник метил передає частину електронної густини на атом Нітрогену. У диметиламіну основні властивості виражені сильніше, ніж у метиламіну, оскільки в цьому разі електронну густину на атом Нітрогену передають два такі замісники:
$$ \underset{\xrightarrow[{\text{посилення основних властивостей}}]{\ }} { \underbrace{\mathrm{C_6H_5NH_2}}_{\text{Г}}\ \ \underbrace{\mathrm{NH_3}}_{\text{В}}\ \ \underbrace{\mathrm{CH_3NH_2}}_{\text{А}}\ \ \underbrace{\mathrm{(CH_3)_2NH}}_{\text{Б}} } $$Відповідь: Г В А Б.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи хімічних елементів | ||
| металічних | неметалічних | |
| A | – | \(\mathrm{S,\ Se,\ Si}\) |
| Б | \(\mathrm{Ba}\) | \(\mathrm{Cl,\ Br}\) |
| B | \(\mathrm{Al,\ Mg}\) | \(\mathrm{Si}\) |
| Г | \(\mathrm{Ag,\ Au,\ Al}\) | – |
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{Cl^{-}}\), \(\mathrm{SO^{2-}_4}\).
Відповідь: B.
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку вміння прогнозувати здатність галогенів витісняти один одного із солей у водних розчинах.
Окиснювальні властивості галогенів зменшуються в підгрупі зі збільшенням протонного числа. Хлор витісняє йод із калій йодиду у водному розчині: $$ \mathrm{Cl_2+2KI=I_2\downarrow +\ 2KCl.} $$
Відповідь: A.
ТЕМА: Неорганічна хімія. Кисень.
Завдання скеровано на перевірку знання способів добування кисню.
У лабораторії кисень добувають з гідроген пероксиду (1), калій перманганату (3), натрій нітрату (5):
\begin{gather*} \mathrm{2H_2O_2=2H_2O+O_2\uparrow ;}\\[7pt] \mathrm{2KMnO_4=K_2MnO_4+MnO_2+O_2\uparrow ;}\\[7pt] \mathrm{2NaNO_3=2NaNO_2+O_2\uparrow .} \end{gather*}Відповідь: Б.
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку вміння пояснювати результати досліду хімічними властивостями амоніаку.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він під дією гідроксид-аніонів набуває малинового кольору. З-поміж речовин, хімічні формули яких наведено в завданні, лише розчин амоніаку у воді має лужне середовище. Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію: $$ \mathrm{ HOH+:NH_3\rightleftarrows OH^-+ [H:NH_3]^+. } $$
Відповідь: Г.
ТЕМА: Неорганічна хімія. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі неорганічних речовин різних класів.
З-поміж речовин, назви яких наведено в завданні, потрібно вибрати ту, яка реагує з карбон(IV) оксидом і не реагує з киснем. Цим умовам відповідає натрій гідроксид: $$ \mathrm{CO_2+2NaOH=Na_2CO_3+H_2O.} $$
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють тимчасову твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасова (карбонатна) твердість води зумовлена катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^-_3}\).
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Хлор. Гідроген хлорид.
Завдання скеровано на перевірку знання властивостей хлору й гідроген хлориду.
Хлор – газ жовто-зеленого кольору з різким запахом.
Гідроген хлорид – безбарвний газ із різким запахом.
Відповідь: B.
ТЕМА: Неорганічна хімія. Способи добування амоніаку.
Завдання скеровано на перевірку знання промислового способу добування амоніаку.
У промисловості амоніак добувають синтезом з азоту й водню: $$ \mathrm{N_2+3H_2=2NH_3.} $$
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^-_3}\).
Відповідь: А.
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку знання хімічних властивостей галогенів, уміння порівнювати їхню активність.
Хімічна активність й окиснювальна здатність галогенів (атомів і молекул) спадає в ряду від Флуору до Йоду. Активніші галогени витісняють менш активні з їхніх сполук:
$$ \mathrm{2KBr+Cl_2=2KCl+Br_2}. $$
Відповідь: Б.
ТЕМА: Неорганічна хімія. Добування амоніаку.
Завдання скеровано на перевірку знання способів добування неорганічних речовин, тривіальних назв деяких із них.
Нашатир – тривіальна назва амоній хлориду \(\mathrm{NH_4Cl}\), гашеним вапном у побуті й на виробництві називають кальцій гідроксид \(\mathrm{Ca(OH)_2}\).
Амоніак \(\mathrm{NH_3}\) в лабораторних умовах можна добути нагріванням амоній хлориду з кальцій гідроксидом:
Густина амоніаку менша за густину повітря, тому його збирають витісненням останнього з пробірки, розташованої догори дном.
Відповідь: В.
ТЕМА: Органічна хімія. Назви органічних речовин різних класів.
Завдання скеровано на перевірку знання назв органічних речовин різних класів.
| 1 | \(\mathrm{4NH_3+5O_2=4NO+6H_2O}\) | B |
| 2 | \(\mathrm{4NH_2CH_3+9O_2=2N_2+4CO_2+10H_2O}\) | A |
| 3 | \(\mathrm{2CH_4=C_2H_2+3H_2}\) | Г |
| 4 | \(\mathrm{4NH_3+3O_2=2N_2+6H_2O}\) | Д |
Відповідь: 1В, 2А, 3Г, 4Д.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи хімічних елементів | ||
| металічних | неметалічних | |
| A | \(\mathrm{Al,\ Au}\) | \(\mathrm{As}\) |
| Б | \(\mathrm{Na,\ Ni}\) | \(\mathrm{N}\) |
| B | \(\mathrm{Cs,\ Cr}\) | \(\mathrm{C}\) |
| Г | \(\mathrm{Sc}\) | \(\mathrm{S,\ Se}\) |
Відповідь: Г.
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку.
Амоніак виявляє осно́вні властивості через наявність в атома Нітрогену неподіленої електронної пари. Під час взаємодії з кислотами утворює амонієві солі: $$ \mathrm{\ddot{N}H_3+H^+\rightarrow [NH_4]^+}. $$
Залежно від мольного відношення продуктом реакції може бути кисла сіль амоній гідрогенсульфат або середня – амоній сульфат:
\begin{gather*} \mathrm{NH_3+H_2SO_4=NH_4HSO_4};\\[7pt] \mathrm{2NH_3+H_2SO_4=(NH_4)_2SO_4}. \end{gather*}Відповідь: Г.
ТЕМА: Неорганічні речовини. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки.
Сірка згоряє в кисні з утворенням сульфур(ІV) оксиду:
$$ \mathrm{S+O_2=SO_2}. $$Відповідь: A.
ТЕМА: Неорганічна хімія. Кисень. Нітрати.
Завдання скеровано на перевірку знання способів добування кисню і вміння прогнозувати продукти реакцій термічного розкладання солей.
Один зі способів добування кисню в лабораторії – термічне розкладання нітратів, зокрема лужних елементів: $$ \mathrm{2NaNO_3=2NaNO_2+O_2\uparrow .} $$
Відповідь: A.
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку, уміння складати рівняння реакції його горіння.
Продуктами горіння амоніаку в кисні є азот і вода: $$ \mathrm{4NH_3+3O_2=\underline{2}N_2+\underline{6}H_2O.} $$
Сума коефіцієнтів у правій частині рівняння цієї реакції дорівнює \(8\ (2+6)\).
Відповідь: Б.
ТЕМА: Неорганічна хімія. Алотропія Карбону.
Завдання скеровано на перевірку знання властивостей алотропних модифікацій Карбону.
Алотропи – різні структурні модифікації одного елемента, мають різні фізичні й хімічні властивості. Алмаз (рис. 1) і графіт (рис. 2) є алотропами Карбону.
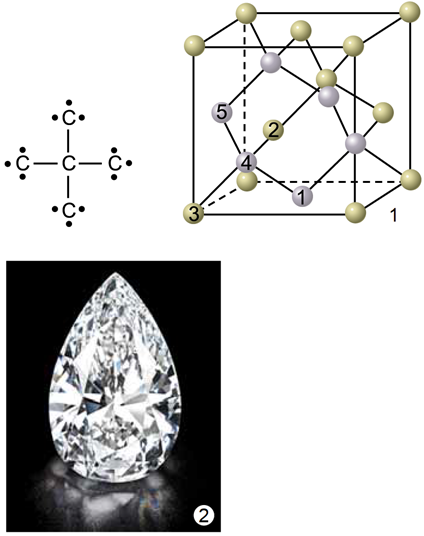
Рис. 1. 1. Модель кристалічних ґраток алмазу. 2. Діамант – огранений алмаз
У кристалічних ґратках алмазу всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні. Атоми Карбону в графіті розташовані плоскими сітками.
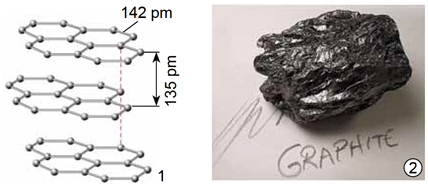
Рис. 1. 1. Модель кристалічних ґраток графіту. 2. Кристал графіту
В кристалі алмазу атоми Карбону сполучені між собою ковалентними зв’язками, тобто немає вільних електронів або йонів – носіїв електричних зарядів, тому алмаз не проводить електричний струм.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Ферум. Сполуки Феруму.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі заліза й сполук Феруму.
| 1 | \(\mathrm{2Fe+3Cl_2=2FeCl_3}\) | Г |
| 2 | \(\mathrm{3Fe+4H_2O=Fe_3O_4+4H_2}\) | Б |
| 3 | \(\mathrm{Fe_2O_3+6HCl=2FeCl_3+3H_2O}\) | B |
| 4 | \(\mathrm{4Fe(OH)_2+2H_2O+O_2=4Fe(OH)_3}\) | Д |
Відповідь: 1Г, 2Б, 3В, 4Д.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна твердість води зумовлена катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}},\) аніонами \(\mathrm{SO^{2-}_4}\).
Відповідь: A.
ТЕМА: Періодична система хімічних елементів. Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Відносна густина газу \(\mathrm{H_2E}\) за воднем 17. Це означає, що його відносна молекулярна маса вдвічі більша за відносну молекулярну масу водню, яка дорівнює 2. Тобто відносна молекулярна маса газу \(\mathrm{H_2E}\) становить 34, відносна атомна маса хімічного елемента \(\mathrm{E}\) – 32. Цей елемент – Сульфур.
Його летка сполука з Гідрогеном – гідроген сульфід – виявляє у водному розчині кислотні властивості й реагує з лугом.
Відповідь: Г.
ТЕМА: Хімічні реакції. Хімічні властивості фосфору.
Завдання скеровано на перевірку вміння розпізнавати зовнішні ефекти реакцій за участі фосфору.
Білий фосфор легко окиснюється киснем повітря навіть за звичайної температури. Згоряє білий фосфор з виділенням світла й тепла.
Відповідь: B.
ТЕМА: Загальна хімія. Неорганічні речовини. Зовнішні ефекти реакцій за участі неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин, зовнішніх ефектів реакцій за їхньої участі.
1 Одним із продуктів реакції міді з концентрованою нітратною кислотою є бурий газ (В) – нітроген(IV) оксид.
2 Одним із продуктів реакції купрум(ІІ) сульфату з натрій гідроксидом є блакитний осад (А) – купрум(IІ) гідроксид.
3 Одним із продуктів реакції ферум(ІІ) карбонату з хлоридною кислотою є безбарвний газ (Г) – карбон(IV) оксид.
4 Бурий осад ферум(ІІІ) гідроксиду під дією сульфатної кислоти розчиняється (Д).
Відповідь: 1В, 2А, 3Г, 4Д.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи. Будова атома.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
А \(\mathrm{He,\ P,\ Zn}\)
Б \(\mathrm{N,\ O,\ Cl}\)
В \(\mathrm{F,\ Cu,\ Kr}\)
Г \(\mathrm{Mg,\ S,\ Ca}\)
Нітроген \((\mathrm{N})\), Оксиген \((\mathrm{O})\) розташовані в правій половині другого періоду, Хлор \((\mathrm{Cl})\) – наприкінці третього періоду. Усі три елементи є типовими неметалічними.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Добування амоніаку.
Завдання скеровано на перевірку знання способів добування неорганічних речовин, тривіальних назв деяких із них.
Нашатир – тривіальна назва амоній хлориду \(\mathrm{NH_4Cl}\), а гашеним вапном у побуті й на виробництві називають кальцій гідроксид \(\mathrm{Ca(OH)_2}\).
Амоніак \(\mathrm{NH_3}\) в лабораторних умовах можна добути нагріванням амоній хлориду з кальцій гідроксидом:
Густина амоніаку менша за густину повітря, тому його збирають витісненням останнього з пробірки, розташованої догори дном.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{HCO^{-}_3}\).
З-поміж речовин, формули яких наведено в завданні, для пом’якшення води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і гідрогенкарбонат-аніонів:
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна (некарбонатна) твердість води зумовлена катіонами \(\mathrm{Ca^{2+}}\) i \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{SO^{2-}_4}\).
Відповідь: A.
ТЕМА: Неорганічні речовини. Органічні речовини.
Завдання скеровано на перевірку знання промислових способів добування неорганічних й органічних речовин.
Метан виокремлюють із природного газу.
Етин добувають термічним розкладанням метану.
Гідроген хлорид синтезують із водню й хлору: $$ \mathrm{H_2+Cl_2=2HCl}. $$
Кальцій оксид добувають випалюванням вапняку.
Відповідь: B.
ТЕМА: Хімічні реакції.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Унаслідок реакції між двома складними речовинами (амоніаком і гідроген хлоридом) утворюється одна складна речовина (амоній хлорид): $$ \mathrm{NH_3+HCl=NH_4Cl}. $$
Це реакція сполучення.
Відповідь: Г.
ТЕМА: Алотропія. Кисень. Озон.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних форм Оксигену.
Алотропія – явище існування одного хімічного елемента у вигляді кількох простих речовин з різними властивостями – алотропних видозмін (модифікацій).
Алотропні модифікації здатні взаємоперетворюватися. Кисень \(\mathrm{O_2}\) й озон \(\mathrm{O_3}\) – алотропні видозміни Оксигену (рис. 1).
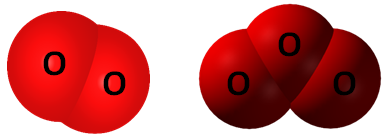
Рис. 1. Моделі молекул алотропних видозмін Оксигену: кисень \(\mathrm{O_2}\) й озон \(\mathrm{O_3}\)
Відповідь: B.
ТЕМА: Органічні й неорганічні речовини.
Завдання скеровано на перевірку знання хімічних властивостей органічних і неорганічних речовин.
Вибухонебезпечні суміші з повітрям утворюють водень, метан, етин.
У решті варіантів відповіді хоча б одна речовина не реагує з киснем повітря \(\mathrm{(N_2,\ CO_2,\ H_2O,\ O_3})\).
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Гідроген хлорид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості гідроген хлориду для аналізування результатів експерименту й формулюванні висновків за ними.
Унаслідок хімічної взаємодії молекул амоніаку \(\mathrm{NH_3}\) з молекулами води утворюються катіони амонію \(\mathrm{NH_4^+}\) і гідроксид-аніони \(\mathrm{OH^-}\):
$$ \mathrm{NH_3+HOH\rightleftarrows NH_4^+ +\underline{OH}^-.} $$
Середовище водного розчину гідроген хлориду, у якому є катіони Гідрогену, кисле. Тому вологий універсальний індикаторний папірець під дією гідроген хлориду набуде червоного забарвлення, а не синього, як зазначено в першому твердженні.
Унаслідок хімічної взаємодії молекул гідроген хлориду \(\mathrm{HCl}\) з молекулами амоніаку \(\mathrm{NH_3}\) утворюються катіони амонію \(\mathrm{NH_4^+}\) і хлорид-аніони \(\mathrm{Cl^-}\). Вони сполучаються з утворенням дрібних білих кристалів амоній хлориду (білого диму навколо скляної палички в описаному досліді): $$ \mathrm{NH_3+HCl\rightleftarrows NH_4^+ +Cl^-\rightleftarrows \underbrace{NH_4Cl}_{\text{білі кристали}}}. $$
Тобто друге твердження правильне.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Властивості кисню і карбон(IV) оксиду.
Завдання скеровано на перевірку знання властивостей кисню і карбон(IV) оксиду.
Газуваті кисень і карбон(IV) оксид безбарвні, не реагують із сульфатною кислотою і не діють на фенолфталеїн у розчині.
Кисень підтримує горіння, а карбон(IV) оксид – ні, тому в кисні тліюча скіпка спалахує, а в карбон(IV) оксиді – згасає.
Відповідь: Б.
ТЕМА: Загальна хімія. Твердість води і способи її усунення.
Завдання скеровано на перевірку розуміння причин твердості води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Найважливіші йони, які зумовлюють твердість води
| Катіони | Аніони |
| \(\mathrm{Ca^{2+},\ Mg^{2+}}\) | \(\mathrm{HCO^-_3,\ SO^{2-}_4,\ NO^-_3,\ Cl^-}\) |
Унаслідок кип’ятіння твердої води розчинні гідрогенкарбонати Кальцію і Магнію перетворюються на нерозчинні карбонати, які осідають на стінках чайника.
Відповідь: A.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сульфур. Алотропія Сульфуру.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних видозмін Сульфуру.
Алотропія Сульфуру зумовлена відмінностями в складі та будові утворених цим елементом простих речовин, здатних до взаємоперетворення. Кристалічна сірка – крихка речовина жовтого кольору, не розчиняється у воді. Сірка важча за воду, тому її кристали опускаються на дно посудини. Однак уміщений у посудину з водою порошок сірки спливає на поверхню. Це відбувається тому, що цей неметал водою не змочується. Сірка – діелектрик і від тертя сильно електризується та набуває від’ємного заряду.
Сірка утворена циклічними молекулами \(\mathrm{S_8}\), що мають форму корони. Кристалічна сірка плавиться за температури \(113\ ^\circ\text{C}\). З розплаву під час повільного охолодження утворюються кристали іншої форми: ромбічна сірка перетворюється на моноклінну. Унаслідок відмінностей у просторовому розташуванні молекул сірки у кристалах ці алотропні модифікації відрізняються густиною, кольором тощо.
Унаслідок підвищення температури руйнуються слабкі міжмолекулярні зв’язки в кристалах і вивільняються циклічні молекули \(\mathrm{S_8}\), які набувають певної рухливості. В’язкість цього розплаву менша за в’язкість води. За температури \(195\ ^\circ\text{C}\) в’язкість розплаву сірки зростає чи не в \(10 000\) разів, тому він не виливається з пробірки. Унаслідок руйнування циклів \(\mathrm{S_8}\) утворюються відкриті структури, кінцеві атоми яких сполучаються між собою в полімерні ланцюги, що містять мільйони атомів Сульфуру. З подальшим підвищенням температури полімерні ланцюги руйнуються, стають коротшими, тож в’язкість розплаву зменшується. Якщо його температуру різко знизити, уливши в посудину з холодною водою, утвориться пластична сірка, яка за механічними властивостями нагадує гуму чи пластилін: її форму легко можна змінити.
Відповідь: B.
ТЕМА: Загальна хімія. Неорганічні й органічні речовини. застосування неорганічних й органічних сполук.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Речовина | |||
| Назва | Застосування | ||
| 1 | барій сульфат | у медицині для рентгеноскопії шлунка | Б |
| 2 | фенол | для виробництва фенолформальдегідних пластмас | Д |
| 3 | глауберова сіль | у медицині як проносний засіб | Г |
| 4 | білки | будівельний матеріал організмів | B |
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодах.
Завдання скеровано на перевірку розуміння закономірностей зміни властивостей хімічних елементів у періодах.
Бор, Карбон, Нітроген, Оксиген – елементи другого періоду. У періодах зі збільшенням протонних чисел посилюються неметалічні властивості хімічних елементів.
Відповідь: В, Б, А, Г.
ТЕМА: Неорганічні речовини та їхні властивості. Алюміній у природі. Сполуки Алюмінію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук Алюмінію.
Головним складником корунду є алюміній оксид \(\mathrm{Al_2O_3}\).
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Твердість води переважно зумовлена катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\).
Відповідь: Б.
ТЕМА: Неорганічна хімія. Оксиген. Озон.
Завдання скеровано на перевірку знання властивостей озону.
Озон – газ блакитного кольору, дуже активний, розчинний у воді, його молекула має кутову будову.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон. Алмаз.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
Алмаз вирізняється високою твердістю, тому його використовують у виробництві шліфувальних матеріалів.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Азот. Амоніак.
Завдання скеровано на перевірку вміння виявляти гідроксид-аніони в розчині.
Нашатирний спирт – тривіальна назва водного розчину амоніаку. Середовище водного розчину амоніаку лужне, бо містить гідроксид-аніони, що утворюються внаслідок взаємодії молекул амоніаку з молекулами води: $$ \mathrm{HOH+:NH_3\rightarrow OH^-+[H:NH_3]^+.} $$ Тому фенолфталеїн у нашатирному спирті набуває малинового кольору.
Відповідь: Б.
ТЕМА: Оксиген і Сульфур. Способи добування кисню. Нітроген і Фосфор. Хімічні властивості нітратів.
Завдання перевіряє знання способів добування кисню в лабораторних умовах або розкладання нітратів.
Для виконання завдання необхідно знати як розкладають гедрогенкарбонати, карбонати, силікати та нітрати. Із наведених сполук з виділенням кисню розкладається лише калій нітрат: \begin{gather*} \mathrm{ 2KNO_3 \stackrel{t}{\longrightarrow} 2KNO_2\ +\ O_2 \uparrow } \end{gather*}
Відповідь: Г.
ТЕМА: Загальна хімія. Неорганічні речовини. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку вміння застосовувати знання про неорганічні речовини для прогнозування продуктів їхньої взаємодії.
1 \(\mathrm{FeO+H_2=Fe+H_2O}\) Б
2 \(\mathrm{2FeCl_2+Cl_2=2FeCl_3}\) A
3 \(\mathrm{Fe_2O_3+6HCl=2FeCl_3+3H_2O}\) B
4 \(\mathrm{4Fe(OH)_2+O_2+2H_2O=4Fe(OH)_3}\) Д
Відповідь: 1Б, 2А, 3В, 4Д.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання властивостей сполук неметалічних елементів, а саме гідроген хлориду.
Для виконання завдання необхідно знати, що гідроген хлорид у присутності води виявляє кислотні властивості та:
- дисоціює з утворення протонів Гідрогену \( \mathrm{ (H^+)}\), і універсальний індикаторний папірець змінить колір на червоний, що свідчить про утворення кислого середовища \( \mathrm{ (H^+)}\). Тому І твердження правильне;
- реагує з амоніаком, який у свою чергу виявляє оснόвні властивості. Унаслідок реакції утворюється білий дим – амоній гідроген хлорид \(\mathrm{ NH_4Cl}\). Тому ІI твердження також правильне.
Відповідь: B.
ТЕМА: Карбон. Алотропія. Карбон(ІІ) оксид.
Завдання скеровано на перевірку знань про алотропні форми Карбону, хімічні властивості карбон(ІІ) оксиду, уміння розпізнавати екзо- й ендотермічні реакції.
В алмазу – алотропної модифікації Карбону – атомні, а не молекулярні кристалічні ґратки.
Ступінь окиснення атома Карбону в карбон(ІІ) оксиді дорівнює +2, а максимальний ступінь окиснення Карбону – елемента IVА групи – становить +4. Тому карбон(ІІ) оксид виявляє відновні властивості, зокрема й в екзотермічній реакції горіння:
\begin{gather*} \mathrm{2\overset{+2}{C}\overset{-2}{O}+\overset{0}{O}_2=2\overset{+4}{C}\overset{-2}{O}_2},\ \triangle H\lt 0\\[7pt] \mathrm{\overset{+2}{C}-2}\overline{e}\rightarrow\mathrm{\overset{+4}{C}}\ \ \text{відновник, окиснення}\\[7pt] \mathrm{2\overset{0}{O}-4}\overline{e}\rightarrow\mathrm{2\overset{-2}{O}}\ \ \text{окисник, відновлення} \end{gather*}
Відповідь: Б.
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
У промисловості з двох простих речовин синтезують амоніак: $$ \mathrm{N_2+3H_2\rightarrow 2NH_3 .} $$
Відповідь: Г.
ТЕМА: Будова атома. Протонне число. Поширеність хімічних елементів у земній корі.
Завдання скеровано на перевірку знання поширеності хімічних елементів у земній корі та вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
Найпоширенішими хімічними елементами земної кори є Оксиген і Силіцій. Їхні порядкові номери в періодичній системі \(8\) і \(14\) відповідно.
\begin{gather*} Z(\mathrm{O})=8;\ \ Z(\mathrm{Si})=14;\\[7pt] Z(\mathrm{O})+Z(\mathrm{Si})=22. \end{gather*}Відповідь: 22.
ТЕМА: Неорганічна хімія. Алюміній. Нітратна кислота.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і нітратної кислоти.
Концентровану нітратну кислоту можна зберігати та транспортувати в цистернах, виготовлених з алюмінію, тому що цей метал під дією сильного окисника, яким є концентрована нітратна кислота, укривається щільним шаром алюміній оксиду.
Відповідь: A.
ТЕМА: Неорганічна хімія. Сполуки Нітрогену. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку.
Каталітичне окиснення амоніаку описують таким хімічним рівнянням:
$$ \mathrm{4NH_3+5O_2=4NO+6H_2O.} $$Відповідь: Г.
ТЕМА: Застосування органічних й неорганічних речовин.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Речовина | |||
| Назва | Галузь застосування | ||
| 1 | амофос | добриво | Б |
| 2 | алюміній, сплави алюмінію | пакувальний матеріал (фольга, бокси) | Г |
| 3 | натрій стеарат | мило | Д |
| 4 | фенол | дезінфікувальний засіб | A |
Відповідь: 1Б, 2Г, 3Д, 4A.
ТЕМА: Органічні й неорганічні речовини. Хімічні реакції.
Завдання скеровано на перевірку знання умов перебігу хімічних реакцій за участі органічних й неорганічних речовин.
Маса речовини дорівнює добутку її кількості на молярну масу:
| Хімічна реакція | |||
| Схема | Умови здійснення | ||
| 1 | \(\mathrm{N_2+H_2\rightarrow NH_3}\) | \(\mathrm{Fe,\ 500\ ^\circ\text{С},\ 250\ \text{атм}}\) | Г |
| 2 | \(\mathrm{SO_2+O_2\rightarrow SO_3}\) | \(\mathrm{V_2O_5,\ 450\ ^\circ\text{С}}\) | A |
| 3 | \(\mathrm{C_2H_2\rightarrow C_6H_6}\) | \(\mathrm{C_{\text{АКТ}},\ 600\ ^\circ\text{С}}\) | Д |
| 4 | \(\mathrm{C_6H_6+Cl_2\rightarrow C_6H_6Cl_6}\) | ультрафіолетове випромінювання | Б |
Відповідь: 1Г, 2А, 3Д, 4Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сірка. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей і застосування сполук Сульфуру.
У завданні наведено схематичні рисунки двох дослідів:
1) знебарвлення квітки сульфур(IV) оксидом, що утворився внаслідок спалювання сірки під скляним дзвоном;
2) спалювання сірки над водою і розчинення продукту згоряння – сульфур(IV) оксиду – з утворенням сульфітної кислоти.
Сульфур(IV) оксид реагує з барвниками, утворюючи безбарвні речовини, його використовують для вибілювання вовни, шовку, соломи тощо.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей карбон(IV) оксиду.
Карбон(IV) оксид є кислотним, він реагує з усіма речовинами, формули яких наведено в завданні, окрім сульфатної кислоти. Тож саме сульфатну кислоту можна використовувати як водовбирну речовину для осушування карбон(IV) оксиду.
Відповідь: Б.
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. Загальні відомості про неметалічні елементи й неметали. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання властивостей основних класів неорганічних сполук, розуміння процесу гідролізу солей і вміння визначати середовища водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз; розуміти, як визначити середовище водного розчину солі.
Проаналізуємо склад розчину кожної речовини й визначимо реакцію середовища.
1 – сульфур(IV) оксид (\(\mathrm{SO_2}\)) є кислотним оксидом, розчин речовини має кисле середовище:
$$
\mathrm{
SO_2+H_2O \rightleftarrows H^{+}+HSO_3^{-};
}
$$
2 – амоніак (\(\mathrm{NH_3}\)) добре розчиняється у воді й має лужне середовище:
$$
\mathrm{
NH_3 + H_2O \rightleftarrows NH^{+}_4+OH^{-};
}
$$
3 – амоній хлорид (\(\mathrm{NH_4Cl}\)), сіль утворена слабкою основою і сильною кислотою, гідроліз відбувається за катіоном, у такому разі реакція середовища кисла:
\begin{gather*}
\mathrm{
NH_4Cl+HOH \rightleftarrows NH_3\cdot H_2O+HCl;
}\\[7pt]
\mathrm{
NH^{+}_4+HOH\leftrightarrows NH_3\cdot H_2O+H^{+}
}
\end{gather*}
4 – кальцій оксид (\(\mathrm{CaO}\)) є основним оксидом, розчин речовини має лужне середовище:
\begin{gather*}
\mathrm{
CaO+H_2O \rightleftarrows Ca(OH)_2;
}\\[7pt]
\mathrm{
Ca(OH)_2\rightarrow Ca^{2+} +2OH^{-}
}
\end{gather*}
До кожного розчину добавили водно-спиртовий розчин фенолфталеїну, який набуває малинового забарвлення лише в лужному середовищі.
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати ступені окиснення хімічних елементів за формулою речовини чи йона.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Гідроген у сполуках із неметалічними елементами має ступінь окиснення \(+1\). Формула катіона амонію – \(\mathrm{NH_4^+}\). Вочевидь ступінь окиснення Нітрогену в катіоні амонію можна обчислити, склавши алгебричне рівняння $$ \underset{ \begin{array}{c} \text{ступінь}\\ \text{окиснення}\\ \text{Нітрогену} \end{array} }{x}\ +\ \underset{ \begin{array}{c} \text{кількість}\\ \text{атомів}\\ \text{Гідрогену} \end{array} } {4}\ \cdot \ \underset{ \begin{array}{c} \text{ступінь}\\ \text{окиснення}\\ \text{Гідрогену} \end{array} } {(+1)}\ =\ \underset{ \begin{array}{c} \text{заряд}\\ \text{катіона}\\ \text{амонію} \end{array} } {+1} $$ і розв’язавши його: \(x+4\cdot 1=1;\ \ x+4=1;\ \ x=-3\).
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона \(\mathrm{H^+}\) до молекули амоніаку. Тож один із чотирьох ковалентних зв’язків у катіоні амонію утворено за донорно-акцепторним механізмом (рис. 1).
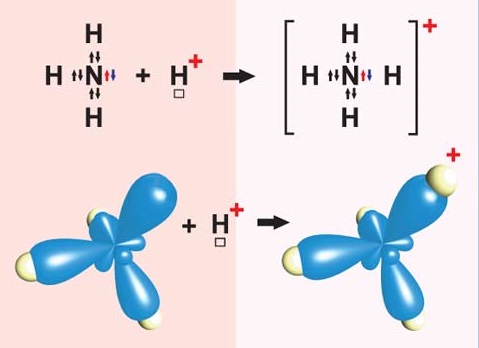
Рис. 1. Утворення катіона амонію
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами \(\mathrm{Ca^{2+}}\) і \(\mathrm{Mg^{2+}}\), аніонами \(\mathrm{SO^{2-}_4}\) і \(\mathrm{NO^{-}_3}\).
Відповідь: Б.
ТЕМА: Загальна хімія. Валентність. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати валентність хімічних елементів за формулою речовини чи йона.
Валентність – здатність атомів вступати в хімічний зв’язок лише з певною кількістю інших атомів, що здійснюється в результаті взаємодії електронів верхніх електронних оболонок.
Кількісною мірою валентності атома є кількість атомів елемента, валентність якого вважають відомою, що їх здатний приєднати даний атом.
Зазвичай валентність атома визначають за максимальною кількістю одновалентних атомів (історично це атоми \(\mathrm{H}\) або \(\mathrm{Cl}\), що можуть сполучатися з атомом певного елемента або заміщати його. У катіоні амонію атом Нітрогену зв’язаний із чотирма атомами Гідрогену, тобто валентність Нітрогену в цій частинці дорівнює чотирьом.
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона \(\mathrm{H^+}\) до молекули амоніаку. Тож один із чотирьох ковалентних зв’язків у катіоні амонію утворено за донорно-акцепторним механізмом (рис. 1).
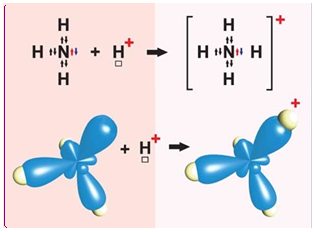
Рис. 1. Утворення катіона амонію
Відповідь: B.
ТЕМА: Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин.
Розбавлена хлоридна кислота не реагує з міддю, а концентрована нітратна – реагує.
Натрій сульфат на відміну від натрій нітрату реагує з барій хлоридом.
Унаслідок реакції з лугом алюміній хлориду і магній хлориду у водному розчині утворюються осади відповідних гідроксидів. Однак осад алюміній гідроксиду, на відміну від осаду магній гідроксиду, розчиняється в надлишку лугу.
Відповідь: 1А, 2Б, 3Д.
ТЕМА: Основні хімічні поняття. Алотропія. Алмаз, графіт.
Завдання скеровано на перевірку розуміння поняття алотропія, знання алотропних модифікацій Карбону.
Алотропи – різні структурні модифікації одного елемента, мають різні фізичні й хімічні властивості. Алмаз (рис. 1) і графіт (рис. 2) є алотропами Карбону.
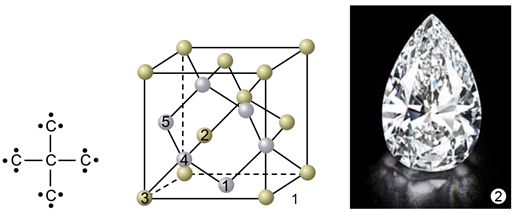
Рис. 1. 1. Модель кристалічних ґраток алмазу. 2. Діамант – огранений алмаз
У кристалічних ґратках алмазу всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні. Атоми Карбону в графіті розташовані плоскими сітками.

Рис. 2. 1. Модель кристалічних ґраток графіту. 2. Кристал графіту
Відповідь: Б.
ТЕМА: Неорганічні речовини. Карбон(IV) оксид.
Завдання скеровано на перевірку знання тривіальної назви карбон(IV) оксиду і його хімічної формули.
Вуглекислий газ – продукт газообміну в легенях людини й сировина для фотосинтезу глюкози й крохмалю рослинами, його систематична назва карбон(IV) оксид, хімічна формула – \(\mathrm{CO_2}\).
Відповідь: B.
ТЕМА: Основні хімічні поняття. Хімічні формули. Прості речовини. Склад повітря.
Завдання скеровано на перевірку знання хімічних формул простих речовин – складників повітря.
Молекула азоту двохатомна, його хімічна формула \(\mathrm{N_2}\).
Відповідь: B.
ТЕМА: Неметали. Вуглець. Адсорбційні властивості активованого вугілля.
Завдання скеровано на перевірку розуміння зумовленості застосування активованого вугілля в медицині його властивостями.
Адсорбція (від лат. ad – на і лат. sorbeo – поглинаю) – вибіркове поглинання речовини з газового чи рідкого середовища поверхневим шаром твердого тіла (адсорбенту).
Активоване вугілля має велику поверхню з величезною кількістю дуже дрібних отворів – пор. Це зумовлює його велику вбирну здатність. Тому активоване вугілля використовують у медицині як адсорбент для поглинання токсичних речовин.
Відповідь: Г.
ТЕМА: Хімічні елементи й прості речовини. Поширеність хімічних елементів у природі.
Завдання скеровано на перевірку вміння відрізняти хімічний елемент (вид атомів) від простої речовини (форми існування хімічного елемента).
Білий фосфор і червоний фосфор – прості речовини, алотропні форми, у яких існує хімічний елемент Фосфор.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Загальні відомості про неметалічні елементи та неметали. Властивості летких сполук неметалічних елементів із Гідрогеном.
Завдання скеровано на перевірку вміння застосовувати знання про властивості гідроген хлориду, амоніаку, метану.
Метан – малорозчинна у воді сполука, тому додавання кількох крапель водно-спиртового розчину фенолфталеїну в колбу з метаном не вплине на тиск цього газу всередині неї.
Натомість гідроген хлорид й амоніак добре розчиняються у воді, тому додавання навіть незначної її кількості зумовить зменшення кількості цих газів у колбах і приведе до зниження тиску в них.
Середовище водного розчину амоніаку лужне, тому фенолфталеїн набуде в ньому малинового забарвлення.
Середовище водного розчину гідроген хлориду кисле, тому фенолфталеїн у ньому залишиться безбарвним.
Тому правильним із-поміж наведених є лише перше твердження.
Відповідь: A.
ТЕМА: Загальна хімія. Хімічний елемент.
Завдання скеровано на перевірку знання символів хімічних елементів, складу молекули азоту, уміння відрізняти просту речовину від хімічного елемента.
Молекулу азоту утворюють два атоми Нітрогену. Хімічний символ Нітрогену (лат. nitrogenium) – \(\mathrm{N}.\)
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку знання хімічних властивостей летких сполук неметалічних елементів із Гідрогеном, уміння прогнозувати середовище їхніх водних розчинів.
Фенолфталеїн набуває малинового забарвлення у лужному середовищі, у якому метилоранж змінює оранжевий колір на жовтий. Умову завдання задовольняє амоніак \(\mathrm{NH_3}.\) Він реагує з водою з утворенням катіона амонію i гідроксид-аніона:
Відповідь: A.
ТЕМА: Неорганічна й органічна хімія. Неорганічні й органічні речовини і їхні властивості.
Завдання скеровано на перевірку знання складу органічних і неорганічних речовин.
Умову завдання задовольняє гідроген пероксид – бінарна сполука Гідрогену з Оксигеном.
Решта сполук містять металічні елементи – Натрій, Кальцій, Літій.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Хімічні властивості неорганічних сполук. Гідроліз.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і летких сполук неметалічних елементів із Гідрогеном.
Середовище водного розчину амоніаку лужне. Він реагує з водою з утворенням катіона амонію й гідроксид-аніона:
Середовище водного розчину гідроген хлориду кисле: $$ \mathrm{HCl\rightleftarrows \textbf{H}^++Cl^-.} $$
Середовище водних розчинів амоній хлориду й алюміній хлориду кисле, бо це солі слабких основ і сильної хлоридної кислоти.
Середовище водного розчину натрій сульфіду лужне, бо це сіль сильної основи і слабкої сульфідної кислоти.
Середовище водних розчинів натрій сульфату і натрій хлориду нейтральне, бо це солі сильної основи і сильних кислот – сульфатної і хлоридної.
Відповідь: 1Б; 2Г; 3Д.
ТЕМА: Загальна хімія. Хімічний елемент.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за властивостями простих речовин, які вони утворюють.
Неметалічним елементом є Карбон. Він утворює прості речовини-неметали, вищий оксид Карбону кислотний.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Амоніак.
Завдання скеровано на перевірку знання властивостей амоніаку.
Амоніак – газ із різким характерним запахом, із багатоосновними кислотами утворює і кислі, і середні солі, є складною речовиною, реагує з киснем.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Метали й неметали. Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей амоніаку й гідроген хлориду.
Гідроген хлорид й амоніак добре розчиняються у воді, тому додавання навіть незначної її кількості зумовить зменшення кількості цих газів у колбах і приведе до зниження тиску в них.
Середовище водного розчину амоніаку лужне, тому фенолфталеїн набуде в ньому малинового забарвлення.
Середовище водного розчину гідроген хлориду кисле, тому фенолфталеїн у ньому залишиться безбарвним.
Тож правильним із-поміж наведених є лише перше твердження.
Відповідь: A.
ТЕМА: Неорганічна хімія. Кисень. Склад повітря.
Завдання скеровано на перевірку знання вмісту кисню в повітрі й уміння тлумачити діаграми.
Об’ємна частка кисню в повітрі становить приблизно \(21\ \text{%}\). Кругову діаграму використовують для візуалізації часток від цілого. Об’ємній частці кисню відповідатиме сектор, що займає приблизно \(21\ \text{%}\ (\sim \frac 15)\) від кола.
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Метали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів, основних оксидів металічних елементів, солей із кислотами.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Оксиди і леткі сполуки з Гідрогеном неметалічних елементів. Індикатори.
Завдання скеровано на перевірку знання властивостей оксидів і летких сполук із Гідрогеном неметалічних елементів, уміння прогнозувати кольори індикаторів у водних розчинах лугів і кислот.
Водні розчини карбон(ІІ) оксиду й метану не містять катіонів Гідрогену чи гідроксид-аніонів, тому не діють ні на фенолфталеїн, ні на метиловий оранжевий.
Водний розчин амоніаку містить гідроксид-аніони, тому фенолфталеїн набуде під їхньою дією малинового забарвлення. Отже, цей варіант не задовольняє умову завдання:
Водний розчин гідроген хлориду містить катіони Гідрогену, під дією яких метиловий оранжевий змінює оранжеве забарвлення на рожеве:
$$ \mathrm{H:Cl\rightarrow H^+\ +:Cl^-.} $$Відповідь: Б.
ТЕМА: Загальна хімія. Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів. Неметали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку знання властивостей розведених і концентрованих нітратної і сульфатної кислот, уміння користуватися рядом активності металів для прогнозування продуктів реакції з кислотами.
Сіль не утвориться внаслідок занурення мідної дротинки в розведену сульфатну кислоту. З концентрованими сульфатною і нітратною, розведеною нітратною кислотою мідь реагує з утворенням солі відповідної кислоти:
Відповідь: A.




