Розділ: Речовина
Тема: Йонні рівняння
Кількість завдань: 20
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі. Електролітична дисоціація. Умови необоротності реакцій йонного обміну в розчинах електролітів.
Завдання скеровано на перевірку знання умов необоротності реакцій йонного обміну в розчинах електролітів і вміння прогнозувати продукти реакцій.
Скориставшись таблицею «Розчинність кислот, основ, амфотерних гідроксидів, солей у воді за температури 20–25 °С», можна дійти висновку, що осад не утвориться внаслідок змішування водних розчинів амоній хлориду й калій ортофосфату, тому що не утворюється жодної нерозчинної солі, а лише суміш катіонів й аніонів. У решті реакцій утворюються нерозчинні солі.
Відповідь: Г.
ТЕМА: Загальна хімія. Розчини. Реакції йонного обміну.
Завдання скеровано на перевірку вміння застосовувати знання про необоротність реакцій йонного обміну в розчині для прогнозування перебігу реакцій.
У разі використання розчину сульфатної кислоти іншим реактантом може бути лише натрій гідроксид. Бо в разі використання барій гідроксиду утвориться осад барій сульфату, який у воді не розчиняється. Тож скорочене йонне рівняння буде іншим:
У разі використання натрій гідроксиду іншим реактантом може бути і хлоридна, і сульфатна кислоти:
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння суті реакцій йонного обміну.
Натрій сульфат і барій хлорид – сильні електроліти, у водному розчині повністю дисоціюють на йони. Катіони Барію
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
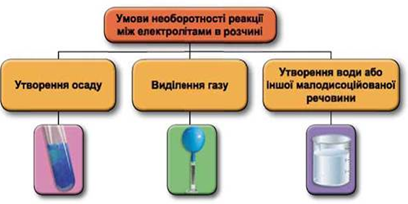
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
| Назва реагентів | Молекулярне та йонно-молекулярні рівняння | ||
| 1 | аргентум(І) нітрат і барій хлорид |
|
B |
| 2 | ферум(III) оксид і нітратна кислота |
|
Д |
| 3 | калій гідроксид і сульфатна кислота |
|
A |
| 4 | ферум(II) сульфід і хлоридна кислота |
|
Г |
Відповідь: 1В, 2Д, 3А, 4Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
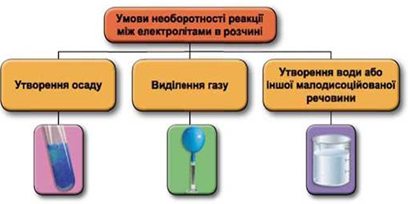
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сильною кислотою (наприклад хлоридною) і середньою сіллю (силікатом):
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
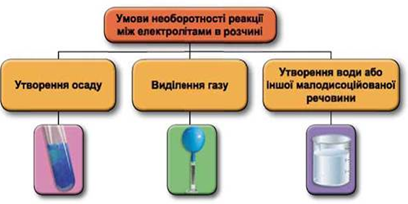
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сіллю Магнію і лугом:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
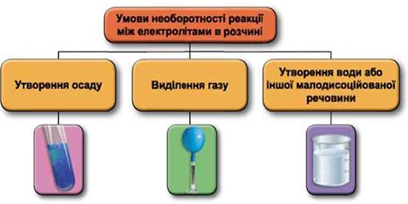
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Аналіз скороченого йонного рівняння дає змогу дійти висновку, що як реагенти, так і продукти реакції – розчинні речовини, а реакція необоротна, бо внаслідок її перебігу утворюється вода – неелектроліт.
Розчинними є обидва реагенти (нітратна й сульфатна кислоти, барій гідроксид) лише у варіантах відповіді Б і В.
Однак у варіанті відповіді Б один з продуктів реакції – барій сульфат – нерозчинна речовина, що не відповідає скороченому йонному рівнянню.
Відповідь: B.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умову завдання задовольняє такий варіант відповіді:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині. Йонно-молекулярне рівняння.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині й уміння складати йонно-молекулярні рівняння.
Для того, щоби скласти повне йонно-молекулярне рівняння реакції між купрум(ІІ) гідроксидом і нітратною кислотою, потрібно формули електролітів записати в йонній формі:
Відповідь: Г.
ТЕМА: Йонні рівняння.
Завдання скеровано на перевірку вміння за скороченими йонно-молекулярними рівняннями відтворювати молекулярні.
Скорочене йонне рівняння
Реакція нейтралізації – це реакція між основою і кислотою з утворенням солі та води.
Умову завдання задовольняє пара речовин «натрій гідроксид і нітратна кислота».
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині й складати повні й скорочені йонно-молекулярні рівняння.
Цинк оксид – нерозчинна у воді речовина, вода не практично не дисоціює. Гідроген хлорид – сильний електроліт, який у водному розчині дисоціює на катіони Гідрогену й хлорид-аніони. На катіони Цинку й хлорид-аніони дисоціює цинк хлорид – розчинна у воді сіль:
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині, складати повні й скорочені йонні та йонно-молекулярні рівняння.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
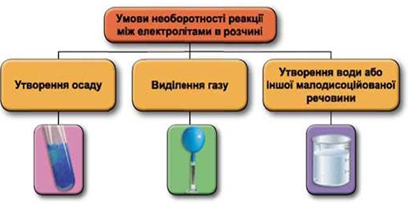
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Взаємодію у водному розчині ферум(ІІ) гідроксиду й хлоридної кислоти описують такими рівняннями:
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
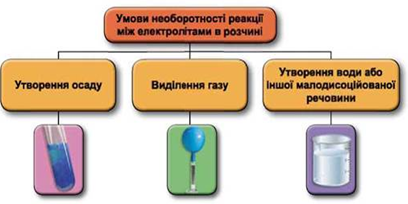
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Скорочене йонне рівняння
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині, складати повні й скорочені йонні та йонно-молекулярні рівняння.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
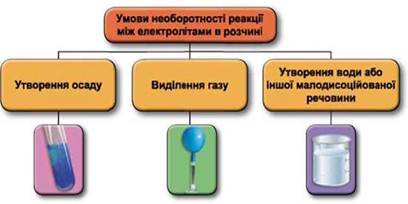
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Взаємодію у водному розчині ферум(ІІ) гідроксиду й хлоридної кислоти описують такими рівняннями:
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині. Йонно-молекулярне рівняння.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині й уміння складати йонно-молекулярні рівняння.
З-поміж карбонатів, які беруть участь у реакції, лише калій карбонат є розчинним і дисоціює у водному розчині на йони (рис. 1).
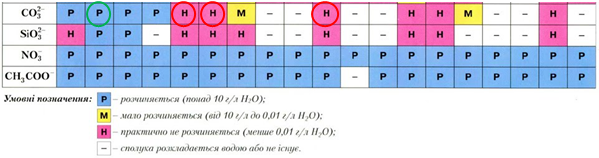
Рис. 1. Розчинність карбонатів Калію, Кальцію, Барію, Феруму(ІІ)
Відповідь: Г.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
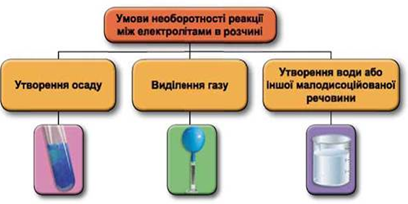
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція між барій гідроксидом і калій сульфатом:
Відповідь: B.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
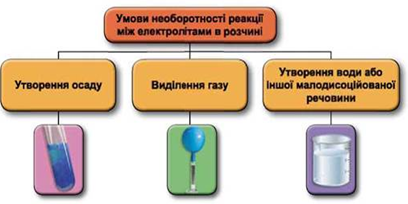
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сіллю Купруму(ІІ) і лугом:
Відповідь: Г.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. За умовою завдання мають прореагувати дві розчинні сполуки, одна з яких дисоціює з утворенням катіона Алюмінію, а друга – з утворенням гідроксид-аніона. Умову завдання задовольняють алюміній нітрат і калій гідроксид:
Відповідь: A.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
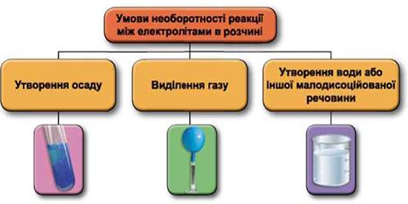
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: B.




