Розділ: Хімічна реакція
Тема: Окисно-відновні реакції
Кількість завдань: 142
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння аналізувати переходи електронів в окисно-відновних реакціях, визначати окисники й відновники.
Три електрони беруть участь у відновленні заліза з ферум(ІІІ) оксиду (окисник) чадним газом:
У реакції окиснення заліза хлором атом Хлору (окисник) приймає один електрон:
У реакції гідролізу фосфор(V) оксиду ступені окиснення хімічних елементів не змінюються.
У реакції окиснення фосфор(III) хлориду хлором кожен атом Хлору, який був у молекулі хлору (окисник), приймає один електрон:
Відповідь: A.
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння суті відновлення як приєднання електронів до атомів чи йонів.
Катіони – позитивно заряджені йони. Відновлення відбувається внаслідок приєднання електронів, унаслідок цього ступінь окиснення хімічного елемента зменшується.
Цю умову задовольняє варіант відповіді A – приєднання електрона до катіона Купруму (2+), який унаслідок цього перетворюється на катіон Купруму (+).
Відповідь: A.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Кислоти. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння прогнозувати склад продуктів реакцій металів із кислотами.
У завданні йдеться про дуже розведений розчин сульфатної кислоти. У такому разі окисниками є катіони Гідрогену, а відновниками – атоми Магнію.
Натомість у концентрованих розчинах сульфатної кислоти окисниками є атоми Сульфуру кислотного залишку.
Тобто в цій реакції катіони Гідрогену відновлюватимуться до водню.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна реакція. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння аналізувати схеми окисно-відновних реакцій, визначати ступені окиснення хімічних елементів, процеси окиснення і відновлення.
У реакції, про яку йдеться в завданні, ступінь окиснення Стануму підвищується від нуля до чотирьох унаслідок втрачання атомом чотирьох електронів. Ступінь окиснення Нітрогену знижується з
Тобто в цій реакції Нітроген відновлюється.
Відповідь: Б.
ТЕМА: Хімічна реакція. Окисно-відновні реакція.
Завдання скеровано на перевірку вміння аналізувати хімічні реакції з погляду окиснення-відновлення.
| Ступінь окиснення металічного елемента в частині рівняння | ||
| лівій | правій | |
A |
||
Б |
||
B |
||
Г |
||
Ступінь окиснення металічного елемента в зменшується лише у варіанті
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна реакція. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння аналізувати перебіг і зовнішні ефекти хімічних реакцій, класифікувати реакції за різними ознаками.
Кальцій оксид (негашене вапно) реагує з водою з утворенням кальцій гідроксиду (гашеного вапна):
З двох складних речовин утворюється одна складна. Це реакція сполучення.
Під час реакції виділяється теплова енергія, унаслідок чого частина води випаровується. Ця реакція екзотермічна.
Ступені окиснення хімічних елементів у цій реакції змін не зазнають.
Відповідь: B.
ТЕМА: Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, добирати коефіцієнти рівняння окисно-відновної реакції, визначати окисники й відновники.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Відповідно
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 10.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Як натрій, так і кальцій є активними металами, реагують iз водою з утворенням відповідного гідроксиду й виділенням газуватого водню. Обидві реакції є екзотермічними, унаслідок їхнього перебігу змінюються ступені окиснення хімічних елементів:
Однак кальцій гідроксид на відміну від натрій гідроксиду є малорозчинним (рис. 1).
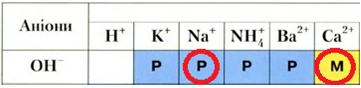
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Б.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання класифікації хімічних реакцій за тепловим ефектом і переходом електронів під час їхнього перебігу.
Негашене вапно добувають прожарюванням вапняку. Реакція потребує постійного нагрівання, тобто відбувається із поглинанням теплової енергії. Тому ця реакція – ендотермічна.
Під час реакції ступені окиснення хімічних елементів не змінюються:
Відповідь: Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 7.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти процеси окиснення і відновлення в окисно-відновних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
А
Б
В
Г
Відповідь: В.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 6.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти процеси окиснення і відновлення в окисно-відновних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
А
Б
В
Г
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів дорівнює 19.
Відповідь: 19.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі неорганічних речовин, класифікувати хімічні реакції за різними ознаками.
Натрій бурхливо реагує з водою з виділенням великої кількості теплоти й утворенням водню і натрій гідроксиду. Тобто ця реакція є екзотермічною:
Атоми Натрію віддають електрони з утворенням катіонів:
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення. Тому його можна використати, щоби дослідити середовище розчину, який утворився в посудині після реакції.
Для якісного виявлення водню – одного з продуктів реакції – використати вапняну воду не можна, бо реакція не відбувається. Вапняна вода – насичений розчин кальцій гідроксиду – є реактивом на вуглекислий газ – карбон(ІV) оксид.
Відповідь: A.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку вміння прогнозувати окисно-відновні властивості хімічного елементів за формулою речовини.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
У сполуках із неметалічними елементами Гідроген має ступінь окиснення +1, ступінь окиснення Оксигену зазвичай дорівнює -2.
Спочатку потрібно визначити ступені окиснення атомів Сульфуру в речовинах, формули яких наведено в умові завдання:
Сульфур – елемент VI А (16) групи періодичної системи хімічних елементів. У його атомі на зовнішньому енергетичному рівні шість валентних електронів. Тому максимальний ступінь окиснення атомів Сульфуру становить +6, а мінімальний дорівнює -2.
Атом Сульфуру зі ступенем окиснення +6 може лише приймати електрони, унаслідок чого його ступінь окиснення знижуватиметься.
Атом Сульфуру зі ступенем окиснення -2 може лише віддавати електрони, унаслідок чого його ступінь окиснення підвищуватиметься.
Атом Сульфуру з проміжним ступенем окиснення +4 може як приймати, так і віддавати електрони, тобто в хімічних реакціях виявляти як окисні, так і відновні властивості.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 11.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку вміння визначати ступені окиснення атомів хімічних елементів і прогнозувати їхні окисно-відновні властивості.
Спочатку потрібно визначити ступені окиснення атомів Сульфуру в речовинах, формули яких наведено в умові завдання, узявши до уваги, що:
- ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам;
- ступінь окиснення атомів Гідрогену в молекулах складних речовин дорівнює +1, а Оксигену, зазвичай, -2;
- алгебрична сума ступенів окиснення всіх атомів в молекулі дорівнює нулю.
А саме:
Виявляти лише відновні властивості (віддавати електрони) у хімічних реакціях може атом Сульфуру з мінімально можливим для нього ступенем окиснення. Сульфур – елемент головної підгрупи VI групи. На на зовнішньому енергетичному рівні його атома 6 електронів. Тому найменший ступінь окиснення атома Сульфуру дорівнює -2 (різниці між номером групи й числом 8). Такий ступінь окиснення мають атоми Сульфуру в молекулі гідроген сульфіду.
Атоми Сульфуру зі ступенем окиснення -2 віддають електрони й виявляють відновні властивості:
Відповідь: Г.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку вміння аналізувати рівняння окисно-відновних реакцій.
Спочатку потрібно визначити ступені окиснення атомів Нітрогену в лівій і правій частинах хімічного рівняння, узявши до уваги, що алгебрична сума ступенів окиснення всіх атомів у молекулі дорівнює нулю:
Зниження ступеня окиснення атома елемента в молекулі називають відновленням. У цій реакції атоми Нітрогену зі ступенем окиснення +5 в натрій нітраті приймають електрони й відновлюються до азоту, у якому ступінь окиснення атомів Нітрогену дорівнює нулю.
Відповідь: B.
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Визначимо ступені окиснення елементів, що змінюються, складемо електронний баланс і перетворимо схему окисно-відновної реакції на хімічне рівняння:
Обчислюємо суму коефіцієнтів у рівнянні реакції: 22.
Відповідь: 22.
ТЕМА: Загальні відомості про металічні елементи й метали. Солі.
Завдання скеровано на перевірку знання хімічних властивостей металів.
Метал може відновлювати катіони металів або протон (катіон Гідрогену), якщо він активніший за той метал, який утворює катіон, або активніший за катіон Гідрогену.
Для порівняння активності металів користуємося рядом активності металів (таблиця 4 тестового зошита). За умовою завдання необхідно вказати катіон, який цинк не може відновити. Скориставшись рядом активності металів, визначаємо, що цинк у ньому розташований лівіше від міді, срібла й водню, тому може відновити відповідні йони з водного розчину. Проте, цинк менш активний, ніж магній, тому не відновлює катіони цього металу з водного розчину.
Відповідь: Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 18.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
З-поміж наведених рівнянь реакцій умову завдання задовольняє варіант
Відповідь: Г.
ТЕМА: Неорганічна хімія. Алюміній. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Алюмінію менша за електронегативність Сульфуру. Тож алюміній виявлятиме відновні властивості в реакції із сіркою:
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 6.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали.
Завдання скеровано на перевірку знання хімічних властивостей металів і вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Серед наведених варіантів лише реакція цинку із сульфатною кислотою є окисно-відновною, цинк під час реакції втрачає електрони й окиснюється:
Відповідь: B.
ТЕМА: Неорганічна хімія. Вуглець. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей вуглецю і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Карбону більша за електронегативність Гідрогену, Магнію та Алюмінію, менша за електронегативність Оксигену. Тож вуглець виявлятиме відновні властивості в реакції з киснем:
Відповідь: A.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів:
Відповідь: 38.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, відновлення як процес приєднання електронів, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і складних йонів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Відновлення – процес приєднання електронів окисником.
1
2
3
4
Відповідь: 1В, 2А, 3Г, 4Д.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A |
|
Б |
|
B |
|
Г |
|
Відповідь: B.
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання перевіряє вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Визначимо ступені окиснення кожного елемента, складемо електронний баланс і перетворимо схему окисно-відновної реакції на хімічне рівняння:
За умовою завдання необхідно вказати суму коефіцієнтів, вона становить 20.
Відповідь: 20.
ТЕМА: Хімічна реакція. Окисно-відновні реакції. Ступінь окиснення.
Завдання перевіряє вміння визначати ступінь окиснення в простих і складних йонах і визначати кількість електронів, що беруть участь у процесі відновлення.
Для виконання завдання необхідно правильно визначити ступінь окиснення і кількість електронів, що беруть участь у цьому процесі.
| Схема процесу відновлення | Кількість електронів |
1 |
Б3 |
2 |
Г5 |
3 |
А2 |
4 |
Д6 |
Відповідь: 1Б, 2Г, 3А, 4Д.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Загальні відомості про металічні елементи та метали. Основи.
Завдання перевіряє здатність з опису хімічного досліду зрозуміти тип хімічної реакції, фізичних і хімічних властивостей лужноземельних елементів.
Лужноземельні елементи активно реагують з водою, тому реакція є екзотермічною. Унаслідок взаємодії лужноземельних елементів з водою утворюється основа (кальцій гідроксид – малорозчинна у воді основа) і водень. Тому з наведених тверджень правильними є лише І і ІV.
Відповідь: Б.
ТЕМА: Хімічна реакція. Поняття ступінь окиснення.
Завдання на розуміння поняття «ступінь окиснення» та вміння визначати ступінь окиснення елементів у речовині.
Для розв’язання завдання достатньо визначити ступінь окиснення елементів у сполуках наведеної схеми хімічної реакції:
Аналіз ступенів окиснення Силіцію, Флуору і Нітрогену показує, що ступінь окиснення жодного з хімічних елементів не змінився.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Складання електронного балансу.
Завдання перевіряє вміння перетворювати схему реакції на хімічне рівняння методом електронного балансу.
Для виконання завдання необхідно вміти визначати ступені окиснення хімічних елементів у речовині, знати поняття "окиснення", "відновлення", "окисник", "відновник", складати електронний баланс.
Відновник – це речовина, яка віддає електрони.
Відповідь: 6.
ТЕМА: Загальна хімія. Хімічна реакція. Окисно-відновні реакції.
Завдання перевіряє вміння правильно визначати кількість електорів, які беруть участь в окисно-відновних процесах.
Для виконання завдання необхідно правильно визначити ступінь окиснення елемента, який відновлюється, і число електронів, що беруть участь у процесах відновлення.
Відповідь: 1Б, 2В, 3Д, 4А.
ТЕМА: Загальна хімія. Хімічна реакція. Неорганічна хімія. Основні класи неорганічних сполук. Хімічні властивості солей
Завдання перевіряє знання поняття «окисно-відновна реакція», уміння визначати та аналізувати склад солей, знання хімічних властивостей солей.
Для виконання завдання необхідно знати, які реакції називають окисно-відновними, як розкладаються за нагрівання солі карбонатної, хлоридної, нітратної кислот та солі амонію.
Усі наведені в завданні солі розкладаються за нагрівання, але окисно-відновною є лише одна реакція – розкладання калій нітрату, тому що внаслідок цієї реакції змінюється ступінь окиснення елементів у речовинах:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Металічні елементи та їхні сполуки. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання загальних властивостей металів, а саме їх взаємодія з кислотами.
Для виконання завдання необхідно знати, що в реакціях металів з кислотами метали віддають електрони, а якщо елемент віддає електрони, то він окиснюється.
Отже, в завданні лише одна правильна відповідь – Г. Магній віддає електрони й окиснюється.
Відповідь: Г.
Загальна хімія. Хімічна реакція.
Завдання перевіряє знання ступеня окиснення елемента в речовині й окисно-відновні реакції, уміння визначати ступінь окиснення елемента за хімічною формулою.
Для виконання завдання необхідно знати такі поняття, як ступінь окиснення та окисно-відновні реакції, уміти визначати ступінь окиснення елемента за хімічною формулою. Ступінь окиснення – це умовний заряд, якого набуває атом, якщо він віддає або приєднує електрони. Окисно-відновні реакції – це реакції, у яких елементи змінюють ступінь окиснення. Якщо проаналізувати всі схеми з точки зору зміни ступеня окиснення елементів
то легко можна побачити, що лише в останній схемі два елементи змінюють свої ступені окиснення, тому правильна відповідь – Г.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
За рівнянням реакції
Коефіцієнт перед формулою окисника – 5.
Відповідь: 5.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння аналізувати окисно-відновні процеси.
1
2
3
4
Відповідь: 1Д, 2В, 3А, 4Б.
ТЕМА: Неорганічні речовини і їхні властивості. Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів другого і третього періодів.
Завдання скеровано на перевірку вміння визначати за формулами речовин ступені окиснення атомів хімічних елементів, прогнозувати їхні окисно-відновні властивості.
A |
|
Б |
|
B |
|
Г |
|
Сульфур – елемент VІа групи, у його атомі на зовнішньому енергетичному рівні 6 електронів. Тобто максимальний ступінь окиснення атомів Сульфуру становить +6 (збігається з номером групи), а мінімальний дорівнює –2 (різниця між номером групи й числом 8).
Тобто атом Сульфуру зі ступенем окиснення +6 може лише приймати електрони й виявляти окисні властивості, а атом Сульфуру зі ступенем окиснення -2 може лише віддавати електрони й виявляти відновні властивості.
Атом Сульфуру зі ступенем окиснення +4 може як віддавати електрони, так і приймати їх:
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Поняття ступінь окиснення, окисно-відновна реакція.
Завдання скеровано на перевірку знання особливостей термічного розкладання солей, розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
A |
|
Б |
|
B |
|
Г |
|
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання магній нітрату.
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно. Ступінь окиснення Нітрогену в молекулі амоніаку й катіоні амонію дорівнює –3. З огляду на це можна визначити ступені окиснення Цирконію:
Вочевидь ступінь окиснення жодного хімічного елемента не змінився.
Відповідь: Г.
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання перевіряє вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Для виконання завдання необхідно вміти визначати окисник і відновник і складати електронний баланс.
Відновник в окисно-відновних реакціях віддає електрони. Відповідно до електронного балансу віддає електрони Сульфур, тому він і є відновником. Коефіцієнт перед формулою відновника – 5.
Відповідь: 5.
ТЕМА: Загальна хімія. Хімічна реакція. Поняття окиснення, відновлення.
Завдання перевіряє вміння визначати число електронів за схемою процесу відновлення.
Для виконання завдання необхідно вміти визначати ступінь окиснення елементів у йонах і число електронів за схемою відновлення.
Схемі 1
cхемі 2
cхемі 3
cхемі 4
Відповідь: 1А, 2Д, 3Г, 4Б.
ТЕМА: Загальні відомості про металічні елементи та метали. Хімічні властивості металів. Ряд активності металів.
Завдання перевіряє застосування знань про хімічні властивості металів і ряд активності металів у конкретній дослідницькій задачі.
Для розв’язання задачі краще взяти три елементи, які відповідають літерам у завданні
У першій пробірці
Відповідь: B.
ТЕМА: Алюміній
Завдання перевіряє знання фізичних і хімічних властивостей алюмінію.
Відповідь: Г.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання типів хімічних реакцій, хімічних властивостей солей, зокрема карбонатів, хлоридів, нітратів.
Усі солі, назви яких наведено в завданні, розкладаються, але зі зміною ступеня окиснення – лише натрій нітрат
Відповідь: Г.
ТЕМА: Хімічна реакція. Поняття окисник, відновник, окиснення, відновлення, ступінь окиснення.
Завдання на розуміння понять ступінь окиснення, окиснення, відновлення та вміння визначати ступінь окиснення елементів в речовині.
Для виконання завдання достатньо визначити ступінь окиснення Нітрогену в сполуках, які містять Нітроген.
Відповідь: Г.
ТЕМА: Обчислення в хімії. Класифікація хімічних реакцій. Екзо- й ендотермічні реакції. Окисно-відновні реакції.
Завдання скеровано на перевірку вмінь класифікувати хімічні реакції та перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
До екзотермічних реакцій із-поміж тих, фрагменти схем яких наведено в умові, належить повне окиснення фосфіну:
Загальна кількість прийнятих електронів в електронному балансі –
Відповідь: 4.
ТЕМА: Обчислення в хімії. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Загальна кількість прийнятих електронів в електронному балансі –
Відповідь: 4.
ТЕМА: Обчислення в хімії. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів перед формулами реагентів –
Відповідь: 14.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Способи добування металів.
Завдання скеровано на перевірку розуміння хімізму пірометалургійних процесів.
Пірометалургія об’єднує хімічні способи відновлення металів із руд за високої температури.
Як відновники в пірометалургії використовують вугілля (кокс), карбон(ІІ) оксид, водень, активні метали, силіцій.
Наприклад, для добування металів пірометалургійним способом із сульфідних руд їх спочатку випалюють:
Відповідь: A.
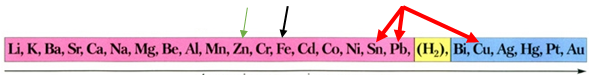
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Витискувальний ряд металів.
Завдання скеровано на перевірку вміння аналізувати реакції металів із солями.
Цинк – активніший за мідь метал, бо розташований лівіше від неї в ряду активності (рис. 1).

Рис. 1. Ряд активності металів
Тому цинк відновлює мідь із розчину солі Купруму(ІІ):
Відповідь: A.
ТЕМА: Обчислення в хімії. Класифікація хімічних реакцій. Екзо- й ендотермічні реакції. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 3.
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. металургія.
Завдання скеровано на перевірку розуміння хімізму добування заліза з руди.
Послідовність відновлення заліза із червоного залізняку така:
Відповідь: Б, В, А, Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисник і відновник в окисно-відновній реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисник приймає електрони, відновник – віддає.
Водень як окисник реагує з металом натрієм, а в реакціях із неметалами – хлором, азотом, киснем – віддає електрони, тобто є відновником. Адже електронегативність Гідрогену більша за електронегативність Натрію і менша за електронегативність Хлору, Нітрогену, Оксигену (рис. 1).
Рис. 1. Відносна електронегативність хімічних елементів
Відповідь: B.
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Залізо відновлює Хром із хром(ІІІ) оксиду:
Відповідь: Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 5.
ТЕМА: Неорганічна хімія. Хімічні реакції.
Завдання скеровано на перевірку вміння розпізнавати хімічні реакції за кількістю і хімічним складом їхніх реагентів і продуктів, зміною ступенів окиснення хімічних елементів під час їхнього перебігу.
За кількістю і складом реагентів і продуктів розрізняють реакції розкладання, сполучення, заміщення, обміну.
Реакції розкладання відбуваються за участю одного реагенту з утворенням кількох продуктів.
Реакції сполучення проходять за участю кількох реагентів з утворенням одного продукту.
У реакціях заміщення реагенти – проста і складна речовини. Під час реакції атоми простої речовини заміщують атоми одного з хімічних елементів у складній речовині. Продукти – нові проста і складна речовини.
У реакціях обміну реагенти – дві складні речовини. Під час реакції вони обмінюються складовими частинами – утворюються дві нові складні речовини.
Ступінь окиснення – загальна характеристика атомів хімічних елементів. Зміна ступенів окиснення хімічних елементів (чи їхня незмінність) – одна з ознак, за якими класифікують хімічні реакції.
Окисно-відновні реакції супроводжуються переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто зміною ступенів окиснення атомів хімічних елементів.
| Хімічне рівняння | Кількість і хімічний склад | Зміна ступенів окиснення хімічних елементів | Тип хімічної реакції | |||
| реагентів | продуктів реакції | |||||
A |
Складна і проста речовини | Складна речовина | є | Сполучення, окисно-відновна | 4 |
|
Б |
Дві складні речовини | Складна речовина | немає | Сполучення, без зміни ступенів окиснення | 3 |
|
B |
Складна речовина | Дві складні речовини | немає | Розкладання, без зміни ступенів окиснення | 2 |
|
Г |
Складна і проста речовини | Складна і проста речовини | є | Заміщення, окисно-відновна | – | |
Д |
Складна речовина | Дві складні й проста речовини | є | Розкладання, окисно-відновна | 1 |
|
Відповідь: 1Д, 2В, 3Б, 4А.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Азот є відновником у реакції з киснем:
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
А
Б
В
Г
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Луги.
Завдання скеровано на перевірку знання хімічних властивостей натрію, уміння класифікувати хімічні реакції за різними ознаками.
Натрій – проста речовина, вода – складна. Продуктами реакції є водень – проста речовина – і натрій гідроксид – складна. Унаслідок перебігу реакції Натрій і Гідроген змінюють ступені окиснення:
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
Ступінь окиснення Нітрогену в нітрат-аніоні можна визначити за формулою нітратної кислоти, а ступінь його окиснення в катіоні амонію – за формулою амоніаку:
Атом Нітрогену зі ступенем окиснення +5 приймає 8 електронів і набуває ступеня окиснення –3:
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
А
Б
В
Г
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 3.
Відповідь: 3.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій перетворень.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| 1 | Б | |
| 2 | Д | |
| 3 | B | |
| 4 | A |
Відповідь: 1Б, 2Д, 3В, 4А.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, прогнозувати окисні й відновні властивості речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисники й відновники.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, прогнозувати окисні й відновні властивості речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
У карбонат- і нітрат-аніонах атоми Карбону й Нітрогену перебувають у своїх максимальних ступенях окиснення (+4 і +5 відповідно). Тому вони не можуть бути відновниками.
Натомість у сульфіт-аніоні атом Сульфуру перебуває в ступені окиснення +4, тобто може як приймати, так і віддавати електрони, а в сульфід-аніоні ступінь окиснення атома Сульфуру мінімальний (–2), тому він не може приймати електрони, а здатен лише віддавати їх.
Тобто відновні властивості здатні виявляти лише сульфіт- і сульфід-аніони.
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
| A |
|
| Б |
|
| B |
|
| Г |
реакція не є окисно-відновною |
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
У сполуках із неметалічними елементами Гідроген має ступінь окиснення +1, ступінь окиснення Оксигену зазвичай дорівнює -2.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
А
Б
В
Г
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання натрій нітрату.
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 3.
Відповідь: 5.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій перетворень.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| 1 | Г | |
| 2 | A | |
| 3 | Д | |
| 4 | Б |
Відповідь: 1Г, 2А, 3Д, 4Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
А
Б
В
Г
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт біля формули окисника –
Відповідь: 8.
ТЕМА: Залізо. Закон збереження маси речовин. Хімічні рівняння.
Завдання скеровано на перевірку знання хімізму виробництва заліза із залізної руди й уміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання рівнянь реакцій.
У завданні йдеться про випалювання залізного колчедану – першу стадію виробництва заліза із залізної руди:
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Купрум є відновником у реакції купрум(І) оксиду з киснем:
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Азот є відновником у реакції з киснем:
Відповідь: A.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 2.
ТЕМА: Сполуки Феруму(ІІ). Окисно-відновні реакції.
Завдання скеровано на перевірку знання властивостей сполук Феруму, уміння розпізнавати окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором:
Відповідь: Б.
ТЕМА: Металічні елементи. Метали. Ряд активності металів. Корозія металів і способи захисту від неї.
Завдання скеровано на перевірку розуміння суті електрохімічної корозії металів, уміння порівнювати активність металів.
Одним зі способів захисту металевих конструкцій від морської води і ґрунтової корозії є використання протектора з активнішого металу.
Тобто протектором для заліза (головного складника сталі) є метал, розташований лівіше від нього в ряду активності металів (рис. 1).
Активність металів зменшується
Рис. 1. Ряд активності металів
Умову завдання задовольняє цинк.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 12.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 8.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника –
Відповідь: 5.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1
2
3
4 у реакцію розкладання вступає одна складна речовина, утворюються дві речовини, не змінюються ступені окиснення хімічних елементів – A.
Відповідь: 1В, 2Д, 3Г, 4А.
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
A
Б
B
Г
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором.
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції манган(IV) оксид є відновником, а в зміні ступеня окиснення Хлору беруть участь шість електронів.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 5.
Відповідь: 5.
ТЕМА: Неорганічна хімія. Ферум. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі сполук Феруму.
| А |
|
| Б |
|
| А |
|
| А |
|
Відповідь: A.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
У реакції літій оксиду з водою беруть участь дві складні речовини, єдиним продуктом реакції є складна речовина, ступені окиснення хімічних елементів під час цієї реакції не змінюються:
Тому ця реакція є реакцією сполучення, що відбувається без зміни ступенів окиснення.
Відповідь: A.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 3.
ТЕМА: Неорганічні речовини і їхні властивості. Лужноземельні метали.
Завдання скеровано на перевірку вміння аналізувати з погляду окиснення-відновлення реакції за участі лужноземельних металів.
Лужноземельні металічні елементи належать до ІІ А групи. У їхніх атомах на зовнішньому енергетичному рівні два електрони. Щоби набути завершеного зовнішнього енергетичного рівня атоми лужноземельних елементів під час хімічних реакцій віддають електрони й, відповідно, окиснюються.
Відповідь: A.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника –
Відповідь: 2.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника – 5.
Відповідь: 5.
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за кількістю і складом реагентів і продуктів, зміною ступенів окиснення.
| Схема хімічної реакції | Тип хімічної реакції | ||
| 1 | сполучення, окисно-відновна | B | |
| 2 | сполучення, ступені окиснення елементів не змінюються | Б | |
| 3 | розкладання, окисно-відновна | A | |
| 4 | розкладання, ступені окиснення елементів не змінюються | Г |
Відповідь: 1В, 2Б, 3А, 4Г.
ТЕМА: Ступінь окиснення. Окисники й відновники. Хімічні властивості амоніаку.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A
Б
B
Г
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисники й відновники. Хімічні властивості сірки.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Електронегативність Сульфуру більша за електронегативність Гідрогену й Магнію і менша порівняно з електронегативністю Флуору й Оксигену (рис. 1). Тому окисником сірка – проста речовина Сульфуру – може бути з воднем і магнієм і не може – із фтором й киснем.
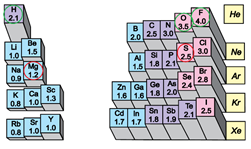
Рис. 1. Відносна електронегативність атомів хімічних елементів
Відповідь: A.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Відповідь: Г.
ТЕМА: Загальна хімія. Застосування оксидів. Окисники й відновники.
Завдання скеровано на перевірку знання властивостей і застосування неорганічних речовин.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Карбон(IV) оксид, силіцій(IV) оксид, сульфур(VI) оксид є вищими оксидами, атоми
У карбон(ІІ) оксиді атом Карбону
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 3.
Відповідь: 3.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Сульфур.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, уміння визначати ступені окиснення хімічних елементів за формулами речовин, кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
А
Б
В
Г
Відповідь: Б.
ТЕМА: Загальна хімія. Окисно-відновні реакції. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, уміння визначати ступені окиснення хімічних елементів за формулами речовин, кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: В.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 12.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відповідь: Б.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів, розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A
Б
B
Г
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 17.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, умінь визначати ступені окиснення атомів хімічних елементів за формулами речовин, окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У процесі відновлення Нітрогену беруть участь вісім електронів.
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 23.
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
А
Б
В
Г
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором.
Відповідь: Б.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції Натрій не змінює ступінь окиснення:
Відповідь: Г.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин, розрізняти окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції плюмбум(IV) оксид є окисником, а в зміні ступеня окиснення Сульфуру беруть участь шість електронів.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Кількість відданих електронів –
Відповідь: 6.
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум. Хімічні властивості заліза.
Завдання скеровано на перевірку знання хімічних властивостей заліза.
| Хімічне рівняння | ||
| 1 | Д | |
| 2 | Г | |
| 3 | A | |
| 4 | B |
Відповідь: 1Д, 2Г, 3А, 4В.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
| Схема реакції | Зміна ступеня окиснення окисника | ||
| 1 |
|
|
B |
| 2 |
|
|
A |
| 3 |
|
|
Г |
| 4 |
|
|
Б |
Відповідь: 1В, 2А, 3Г, 4Б.
ТЕМА: Неорганічна хімія. Калій. Водень. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей водню і калію та вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Калію менша за електронегативність Гідрогену (рис. 1).
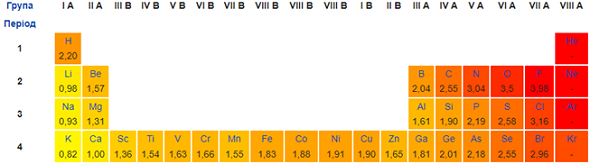
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тож калій виявлятиме відновні властивості в реакції з воднем:
Відповідь: B.
ТЕМА: Неорганічна хімія. Сірка. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей сірки та вміння аналізувати реакції за її участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Оксигену більша за електронегативність Сульфуру (рис. 1).
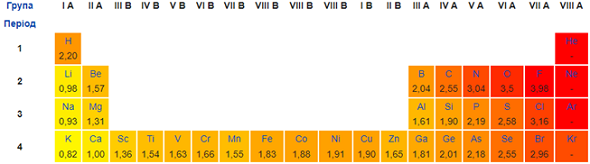
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тож кисень виявлятиме окисні властивості в реакції із сіркою:
Відповідь: A.
ТЕМА: Обчислення в хімії. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 2.
ТЕМА: Загальна й неорганічна хімія. Окисно-відновні реакції. Металічні елементи.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів із неметалами й кислотами.
| Рівняння реакції | ||
| 1 | Б | |
| 2 | B | |
| 3 | Г | |
| 4 | Д |
Відповідь: 1Б, 2В, 3Г, 4Д.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени.
Завдання скеровано на перевірку знання хімічних властивостей галогенів і їхніх сполук та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Умову завдання задовольняє реакція між ферум(ІІ) хлоридом і хлором з утворенням ферум(ІІІ) хлориду:
Відповідь: B.
ТЕМА: Неорганічна хімія. Сульфур. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей вуглецю і вміння аналізувати з погляду окиснення-відновлення реакції за його участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Вищий ступінь окиснення +6 Сульфур виявляє в сульфатній кислоті. Тому в цій сполуці Сульфур виявляє лише окисні властивості:
Відповідь: Б.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
У реакції розкладання бере участь одна складна речовина, утворюється кілька речовин.
Під час окисно-відновної реакції ступені окиснення хімічних елементів змінюються.
Умову завдання задовольняє реакція розкладання калій хлорату:
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 5.
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Умову завдання задовольняє реакція між ферум(ІІ) хлоридом і хлором з утворенням ферум(ІІІ) хлориду:
Відповідь: B.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
A
Б
B
Г
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 3.
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Умову завдання задовольняє реакція між ферум(ІІ) хлоридом і хлором з утворенням ферум(ІІІ) хлориду:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Сірка. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння аналізувати реакції за її участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Сульфуру більша за електронегативність Гідрогену, Натрію і Феруму, менша за електронегативність Оксигену. Тож сірка виявлятиме відновні властивості в реакції з киснем:
Відповідь: Г.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника –
Відповідь: 10.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сульфур. Сірка. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей сполук Сульфуру, уміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Умову завдання задовольняє реакція між сульфур(IV) оксидом і киснем:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Металічні елементи. Корозія металів.
Завдання скеровано на перевірку розуміння явища корозії металів і вміння прогнозувати її перебіг з огляду на положення металів у ряду активності (рис. 1).

Рис. 1. Ряд активності металів
Корозія – процес руйнування металів унаслідок їхньої взаємодії з корозивним середовищем.
Що більше різняться між собою за хімічною активністю два метали, що стикаються, тим сильніше кородує активніший із них. Тобто в морській воді в гальванічній парі залізо – цинк кородує цинк, а в гальванічній парі залізо – мідь кородує залізо.
Відповідь: B.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 14.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за хімічним складом і кількістю реагентів і продуктів, зміною ступенів окиснення хімічних елементів.
| 1 | У реакції беруть участь дві складні речовини, утворюється одна складна речовина. Це реакція сполучення без зміни ступенів окиснення
|
Д |
| 2 | У реакції бере участь одна складна речовина, утворюються три складні речовина. Це реакція розкладання без зміни ступенів окиснення
|
A |
| 3 | Протонне число У реакції бере участь одна складна речовина, утворюються дві складні речовина. Це окисно-відновна реакція розкладання
|
B |
| 4 | У реакції беруть участь дві прості речовини, утворюється одна складна речовина. Це окисно-відновна реакція сполучення
|
Г |
Відповідь: 1Д, 2А, 3В, 4Г.




