Розділ: Основні класи неорганічних сполук
Тема: Солі
Кількість завдань: 113
ТЕМА: Йонні реакції в розчинах. Гідроліз солей.
Завдання скеровано на перевірку вміння розпізнавати реакції, унаслідок яких утворюється газ й осад.
Бурий колір властивий катіонам Феруму(ІІІ), отже, у реакції бере участь ферум(ІІІ) хлорид
Натрій сульфід – сіль слабкої кислоти
За умовою внаслідок реакції виділяється безбарвний газ без запаху, тому натрій сульфід не відповідає умові, бо гідроген сульфід має характерний неприємний запах. Натомість карбон(IV) оксид запаху не має.
Умові завдання відповідають реактанти
Відповідь: Г.
ТЕМА: Реакції між солями, кислотами й основами.
Завдання скеровано на перевірку знання типових реакцій кислот із солями, уміння аналізувати послідовність хімічних перетворень.
Умові завдання відповідає лише варіант В:
Відповідь: B.
ТЕМА: Властивості основних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участю неорганічних сполук різних класів.
| Варіант відповіді | Схема реакції | Оцінка можливості перебігу реакції |
| А | Мідь не реагує з водою | |
| Б | Нерозчинні основи термічно нестійкі й із часом і/або внаслідок нагрівання розкладаються на оксид металічного елемента й воду | |
| B | Основні й амфотерні гідроксиди реагують із кислотами. Продукти реакції – сіль і вода | |
| Г | Активніший метал цинк витісняє мідь із розчиненої у воді солі Купруму |
Відповідь: A.
ТЕМА: Класифікація солей. Реакції солей із лугами й кислотами. Ознаки утворення осаду й газу.
Завдання скеровано на перевірку вміння тлумачити спостереження і робити висновки з них.
| Варіант відповіді | Формула солі | Хімічні властивості | Реактанти | Посудина | |
| А | Не реагує з натрій гідроксидом і сульфатною кислотою, осад не утворюється | ||||
| Б | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з виділенням газу | ||||
| B | Не реагує з натрій гідроксидом і сульфатною кислотою | ||||
| Г | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з утворенням осаду | ||||
| Д | Реагує з натрій гідроксидом з утворенням осаду й не реагує із сульфатною кислотою | ||||
Відповідь: 1Г; 2Д; 3Б.
ТЕМА: Властивості солей у водних розчинах. Реакції між солями. Середовище розчину.
Завдання скеровано на перевірку розуміння суті гідролізу солей, знання умов, за яких відбувається реакція між розчиненими у воді солями.
| Варіант відповіді | Формула солі | Середовище водного розчину солі | Висновок |
| А | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Кисле, бо це сіль слабкої основи й сильної кислоти | |||
| Б | Лужне, бо це сіль сильної основи й слабкої кислоти | Правильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти | |||
| B | Лужне, бо це сіль сильної основи й слабкої кислоти | Неправильно | |
| Лужне, бо це сіль сильної основи й слабкої кислоти | |||
| Г | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти |
Відповідь: Б.
ТЕМА: Термічне розкладання солей. Леткі продукти реакції.
Завдання скеровано на перевірку знання хімічних властивостей гідрогенкарбонатів і карбонатів, уміння прогнозувати продукти термічного розкладання солей.
| Варіант відповіді | Формула солі | Продукти термічного розкладання | Твердий залишок |
| А | |||
| Б | |||
| B | |||
| Г |
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі. Гідроліз солей.
Завдання скеровано на перевірку розуміння суті гідролізу солей і вміння складати рівняння реакцій гідролізу.
Наведена схема відповідає гідролізу солі слабкої основи і сильної кислоти. Такими є цинк хлорид і ферум(ІІ) хлорид.
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Солі.
Завдання скеровано на перевірку вміння аналізувати формулу кислоти й визначати її основність, складати й аналізувати формули солей.
Основність кислоти визначають за кількістю атомів Гідрогену, здатних заміщуватися на атоми металічного елемента.
Сульфатна кислота
Відповідь: Г.
ТЕМА: Неорганічна хімія. Солі.
Завдання скеровано на перевірку знання властивостей солей.
Етанова кислота слабка, тому не зможе витіснити нітратну кислоту з амоній нітрату.
З-поміж амоній карбонату, магній карбонату й кальцій сульфіду і з калій гідроксидом, і з етановою кислотою прореагує лише амоній карбонат. В обох реакціях виділиться газ. У реакції амоній карбонату з концентрованим розчином лугу виділиться амоніак, а в реакції з етановою кислотою – карбон(IV) оксид:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Солі. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати середовище водного розчину солі та склад продуктів її реакції з іншою сіллю.
Лужне середовище у водних розчинах солей, утворених слабкими кислотами і сильними основами. Такими з-поміж наведених є калій етаноат і натрій сульфід.
Та з ферум(ІІ) нітратом у водному розчині з утворенням нерозчинної середньої солі реагує лише натрій сульфід.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини. Основні класи неорганічних сполук. Кислоти. Солі
Завдання скеровано на перевірку вміння аналізувати хімічні реакції, прогнозувати склад і властивості їхніх продуктів.
Унаслідок реакції між кристалічним натрій хлоридом і концентрованою сульфатною кислотою виділяється гідроген хлорид.
Водний розчин гідроген хлориду – сильна хлоридна кислота. Унаслідок дії хлоридної кислоти на натрій силікат утворюється осад силікатної кислоти (посудина 1).
Унаслідок реакції аргентум(І) нітрату з хлоридною кислотою утворюється осад аргентум(І) хлориду. (посудина 2).
Умову завдання задовольняє варіант відповіді В: в обох посудинах утворилися осади.
Відповідь: B.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Гідроліз солей.
Завдання скеровано на перевірку вміння аналізувати хімічний склад речовин, прогнозувати середовище водного розчину солі й перебіг реакцій між електролітами у водних розчинах.
Лужне середовище в розчинах солей, утворених сильними основами і слабкими кислотами. Такими є калій етаноат і натрій сульфід. Однак із плюмбум(ІІ) нітратом у водному розчині реагує лише натрій сульфід.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів, розуміння, за яких умов метал реагує із сіллю, уміння прогнозувати можливість перебігу між металом і сіллю у водному розчині.
За довідковою таблицею «Ряд активності металів» (див. рисунок) можна визначити, що з-поміж наведених пар метал – сіль лише цинк реагуватиме з купрум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від міді:
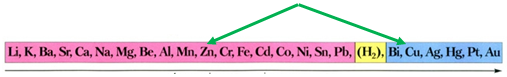
Ряд активності металів
Відповідь: A.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що у водному розчині цинк як активніший метал витіснить залізо з ферум(ІІ) хлориду, залізо – свинець, кадмій – мідь, а нікель як менш активний метал не витіснить цинк.
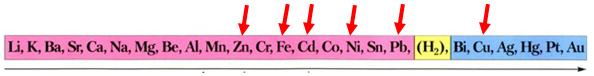
Активність металів зменшується
Рис. 1. Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Зрозуміло, що лише маса залізної пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) етаноату, бо атомна маса Плюмбуму більша за атомну масу Феруму.
Відповідь: Б.
ТЕМА: Класифікація неорганічних речовин. Генетичні зв’язки між класами неорганічних сполук. Способи добування солей.
Завдання скеровано на перевірку знання генетичних зв’язків між класами неорганічних сполук і способів добування солей.
Продуктами реакції гідроген сульфіду з киснем є вода й сульфур(ІV) оксид. Продукт реакції барій оксиду з водою – барій гідроксид – луг.
Гідроген хлорид реагує з амоніаком, а натрій із бромом з утворенням солей:
Відповідь: A.
ТЕМА: Солі. Хімічні властивості солей.
Завдання скеровано на перевірку знання продуктів термічного розкладання середніх і кислих солей, солей амонію, карбонатної та нітратної кислот.
Унаслідок розкладання амоній нітрату утворюються лише газуваті продукти:
Унаслідок розкладання решти речовин, про які йдеться в завданні, утворюються тверді залишки оксиду металічного елемента (А, Г) або солі (Б).
Відповідь: B.
ТЕМА: Неорганічна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1. Продуктом гідратації кальцій оксиду є одна складна речовина – кальцій гідроксид.
2. Унаслідок розкладання кальцій карбонату утворюються дві складні речовини – оксиди Кальцію і Карбону(IV).
3. Унаслідок розкладання гідроген пероксиду утворюються вода (складна речовина) і кисень (проста речовина).
Відповідь: 1В, 2Б, 3А.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю, уміння кількісно оцінювати результати перебігу таких реакцій.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що кадмій і залізо витіснятимуть із солей свинець і мідь, оскільки в ряду активності вони розташовані лівіше від них:
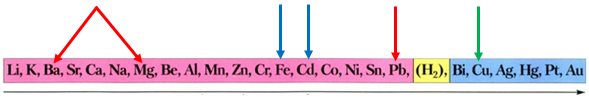
Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса залізної пластинки збільшиться, а кадмієвої – зменшиться, якщо її занурити у водний розчин купрум(ІІ) нітрату. Унаслідок занурення в розчин плюмбум(ІІ) нітрату маса обох пластинок збільшиться.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Карбонатна кислота. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку вміння прогнозувати продукти реакції за участі солей карбонатної кислоти – карбонатів і гідрогенкарбонатів.
Для перетворення натрій гідрогенкарбонату – кислої солі – на натрій карбонат (середню сіль) потрібно використати луг:
Дією сильнішої за карбонатну етанової кислоти на натрій карбонат, можна добути карбон(IV) оксид:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розрізняти середні й кислі солі за їхніми формулами й назвами.
Кисла сіль – це продукт неповного заміщення атомів Гідрогену в молекулі багатоосновні кислоти на йони металічних елементів. Цим вона відрізняється від середньої солі, яка є продуктом повного заміщення і не містить атомів Гідрогену, здатних заміщуватися на катіони металічних елементів.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що кадмій витіснятиме із солей олово, нікель і мідь, оскільки в ряду активності він розташований лівіше від них:
Затим потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса кадмієвої пластинки збільшиться, якщо її занурити у водний розчин станум(ІІ) хлориду.
Відповідь: Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що цинк витіснятиме із солей свинець (А) і нікель (Б), оскільки в ряду активності він розташований лівіше від них:
Затим потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса цинкової пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) нітрату, і зменшиться внаслідок занурення у водний розчин нікель(ІІ) нітрату.
Відповідь: A.
ТЕМА: Загальні відомості про металічні елементи й метали. Солі.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Метал реагує із сіллю, якщо він активніший за той метал, який входить до складу солі. Для порівняння активності металів користуємося рядом активності металів (таблиця 4 тестового зошита). За умовою завдання одна з пластинок виготовлена з кадмію, а інша – з міді. Пластинки занурили у водний розчин плюмбум(ІІ) етаноату. Порівняємо активність металів. Кадмій активніший за свинець, тому реагуватиме із сіллю, мідь – менш активний метал порівняно зі свинцем, тому із сіллю не реагує. Унаслідок взаємодії металу з розчином солі маса металу (пластинки) змінюється, тому що відносні атомні маси різних металів різні. В умові зазначено, що змінилася маса лише пластинки, виготовленої з металу Х, тому Х – кадмій, тоді Y – мідь. Отже, твердження ІІ правильне. Проаналізуємо, як зміниться маса пластинки, виготовленої з кадмію. Напишемо рівняння реакції кадмію з плюмбум(ІІ) етаноатом:
Порівняємо відносні атомні маси кадмію і свинцю:
Відповідь: Б.
ТЕМА: Загальна хімія. Класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати формули неорганічних речовин різних класів.
| Оксигеновмісна органічна речовина | ||||
| Клас неорганічних сполук | Формула | |||
| 1 | сіль | складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Б | |
| 2 | оксид | бінарна сполука з Оксигеном, ступінь окиснення якого –2 | Д | |
| 3 | основа | складна речовина, утворена катіонами металічного елемента й гідроксид-аніонами | B | |
| 4 | кислота | складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами кислотного залишку | Г | |
Відповідь: 1Б, 2Д, 3В, 4Г.
ТЕМА: Загальна хімія. Класифікація неорганічних речовин. Солі.
Завдання скеровано на перевірку вміння розпізнавати хімічні формули солей.
Речовини, формули яких наведено, утворені катіонами металічних елементів й аніонами кислотних залишків, тобто належать до солей.
Відповідь: Г.
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Речовиною
є кислотний карбон(IV) оксид:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | B | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | двохосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | Д |
Відповідь: 1В, 2А, 3Б, 4Д.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
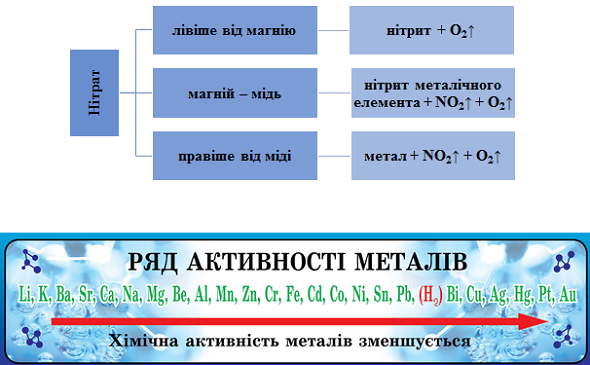
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів рівняння термічного розкладання калій нітрату дорівнює
Відповідь: B.
ТЕМА: Неорганічна хімія. Солі.
Завдання скеровано на перевірку вміння класифікувати солі.
Формула амоній карбонату
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Поняття ступінь окиснення, окисно-відновна реакція.
Завдання скеровано на перевірку знання особливостей термічного розкладання солей, розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
A
Б
B
Г
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання амоній нітрату.
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза, способів добування і властивостей сполук Феруму(ІІІ).
1
2
3
4
Відповідь: Б.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.

Ряд активності металів
Порівнявши положення металів у ряду активності, можна дійти висновку, що мідь витіснятиме із солей ртуть (Б), оскільки в ряду активності мідь розташована лівіше:
Активніші метали (барій, магній, нікель), які в ряду активності розташовані лівіше за мідь, вона з розчинів солей витіснити не зможе.
Атомна маса ртуті більша за атомну масу міді, тому маса пластинки збільшилася.

Відповідь: Б.
ТЕМА: Номенклатура середніх і кислих солей.
Завдання скеровано на перевірку вміння називати середні й кислі солі за систематичною номенклатурою, розрізняти їх за хімічними формулами.
Кислі солі відрізняються від середніх тим, що крім катіона металічного елемента й аніона кислотного залишку містять один чи кілька атомів Гідрогену. У назві їх позначають відповідним префіксом – ди-, три- тощо.
Формула натрій дигідрогенортофосфату –
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі.
Завдання перевіряє вміння якісно визначати солі за аніоном.
Для розв’язання завдання необхідно знати якісні реакції на аніони. За умовою завдання є водні розчини солей магній нітрат
з нітрат-аніонами катіони барію не реагують. Таким чином, магній сульфат можна відрізнити від магній нітрату, використавши водний розчин барій хлориду.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання властивостей сполук неметалічних елементів, а саме гідроген хлориду.
Для виконання завдання необхідно знати, що гідроген хлорид у присутності води виявляє кислотні властивості та:
- дисоціює з утворення протонів Гідрогену
\(\mathrm{ (H^+)}\) , і універсальний індикаторний папірець змінить колір на червоний, що свідчить про утворення кислого середовища\(\mathrm{ (H^+)}\) . Тому І твердження правильне; - реагує з амоніаком, який у свою чергу виявляє оснόвні властивості. Унаслідок реакції утворюється білий дим – амоній гідроген хлорид
\(\mathrm{ NH_4Cl}\) . Тому ІI твердження також правильне.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання хімічних властивостей солей, а саме умов, за яких метал взаємодіє з розчином солі; уміння аналізувати результати реакції, а саме зміну маси після взаємодії металу з розчином солі; уміння користуватися рядом активності металів.
Для розв’язання завдання необхідно скористатися рядом активності металів, який є в тестовому зошиті. У ряду активності метали розміщено за зменшенням їхньої активності. Активніший метал знаходиться ліворуч. Метал може витискувати інший метал з розчину солі, якщо він більш активний, тобто стоїть у ряду активності ліворуч.
За допомогою ряду активності порівняємо кадмій (за умовою завдання пластинка кадмієва) із металами, які входять до складу запропонованих солей. Кадмій активніший лише за Купрум і Плюмбум (Б і Г).
Тепер проаналізуємо, як змінюється маса пластинки, якщо кадмій реагуватиме з розчинами
Загальна схема реакції:
Якщо в реакцію вступає 1 моль Кадмію, то внаслідок реакції утворюється 1 моль металу, тому достатньо порівняти молярні маси.
Розглянемо два випадки:
1) Реакція Кадмію з
2) Реакція кадмію з
За умовою завдання маса пластинки збільшилася, тому правильна відповідь – Г.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання хімічних властивостей сполук неметалічних елементів, солей.
Для розв’язання завдання необхідно знати, що відбувається з різними солями за нагрівання, і визначати окисно-відновні реакції.
Проаналізуємо наведені варіанти солей з огляду на можливість їхнього термічного розкладання. Розкладання солей карбонатної кислоти (А і Б) відбувається без зміни ступеня окиснення з виділенням вуглекислого газу; амоній хлорид (В) легко розкладається за нагрівання на амоніак і гідроген хлорид, реакція відбувається без зміни ступеня окиснення; розкладання нітратів, зокрема магній нітрату (Г) супроводжується зміною ступеня окиснення.
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє знання поняття основних класів неорганічних сполук, уміння визначати елемент, який утворює кислоту, і відповідні солі за формулами солей.
Для виконання завдання необхідно знати, що солі утворюються з кислот, а кислоти утворюють неметалічні елементи. Хімічний елемент
Відповідь: A.
ТЕМА: Загальна хімія. Хімічна реакція. Неорганічна хімія. Основні класи неорганічних сполук. Хімічні властивості солей
Завдання перевіряє знання поняття «окисно-відновна реакція», уміння визначати та аналізувати склад солей, знання хімічних властивостей солей.
Для виконання завдання необхідно знати, які реакції називають окисно-відновними, як розкладаються за нагрівання солі карбонатної, хлоридної, нітратної кислот та солі амонію.
Усі наведені в завданні солі розкладаються за нагрівання, але окисно-відновною є лише одна реакція – розкладання калій нітрату, тому що внаслідок цієї реакції змінюється ступінь окиснення елементів у речовинах:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Металічні елементи та їхні сполуки. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання хімічних властивостей металів, а саме їхню взаємодію із солями.
Для виконання завдання необхідно знати хімічні властивості металів. Метал може реагувати із сіллю, якщо він активніший за той метал, який входить до складу солі. Тобто в завданні за допомогою ряду активності металів, який є в тестовому зошиті (с. 16), необхідно порівняти метал Y і метал, який входить до складу солі X. Метал Y буде відновлювати метал із солі X, якщо метал Y активніший за метал, який входить до складу солі X.
Порівнюємо:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання визначення солей, класифікацію солей, уміння за хімічною формулою визначати кислу сіль.
Для виконання завдання необхідно знати визначення солі, кислої солі й за хімічною формулою визначати кислу сіль. Кислими називають солі, у яких кислотний залишок, тобто аніон, містить Гідроген. Якщо проаналізувати наведені формули солей, то бачимо, що Гідроген у складі аніона є лише у натрій гідроген карбонаті
Отже, правильна відповідь – В.
Відповідь: B.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині, уміти користуватися таблицею розчинності.
У завданні наведено карбонат-аніон
Отже, правильна відповідь – Б.
Відповідь: Б.
ТЕМА: Неорганічні речовини і їхні властивості. Солі. Середні й кислі солі. Ортофосфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про кислі й середні солі, способи добування солей для прогнозування складу продуктів хімічних реакцій.
Середня сіль – продукт повного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить лише катіони металічних елементів й аніони кислотних залишків.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить катіони металічних елементів, атоми Гідрогену, здатні до заміщення на катіони металічних елементів, й аніони кислотних залишків.
A |
|
Б |
|
B |
|
Г |
|
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Поняття ступінь окиснення, окисно-відновна реакція.
Завдання скеровано на перевірку знання особливостей термічного розкладання солей, розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
A |
|
Б |
|
B |
|
Г |
|
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання магній нітрату.
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Солі. Добування солей.
Завдання перевіряє розуміння утворення середніх і кислих солей залежно від мольного співвідношення речовин у реакціях між лугами і багатоосновними кислотами.
Для виконання завдання необхідно зіставити певні кількості речовин кислот і лугів. Ортофосфатна кислота трьохосновна, тому для утворення середньої солі при взаємодії з натрій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:3. Такого співвідношення немає. Сульфатна кислота двохосновна, тому для утворення середньої солі при взаємодії з калій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:2. Таке співвідношення наведено у варіанті Г.
Відповідь: Г.
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання типів хімічних реакцій, хімічних властивостей солей, зокрема карбонатів, хлоридів, нітратів.
Усі солі, назви яких наведено в завданні, розкладаються, але зі зміною ступеня окиснення – лише натрій нітрат
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій між неорганічними сполуками – представниками різних класів.
Сульфур(VI) оксид – кислотний, йому відповідає двоосновна сульфатна кислота. Тож сульфур(VI) оксид реагує з калій гідроксидом у водному розчині з утворенням калій сульфату й води:
Утворення калій гідрогенсульфату – кислої солі – неможливе, бо в калій гідроксид узято в надлишку.
Відповідь: B.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати рівняння електролітичної дисоціації.
| Речовина | |||
| Назва | Рівняння електролітичної дисоціації | ||
| 1 | нітратна кислота | A | |
| 2 | алюміній сульфат | Г | |
| 3 | барій хлорид | Б | |
| 4 | калій гідроксид | B | |
Відповідь: 1А, 2Г, 3Б, 4В.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди, основи, кислоти, солі.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів, основ, кислот, солей.
| Клас неорганічних сполук | Визначення | Речовина | |||
| Формула | Назва | ||||
| 1 | кислоти | Складні речовини, утворені атомами Гідрогену, сполученими з кислотними залишками. Валентність кислотного залишку дорівнює кількості атомів Гідрогену в молекулі кислоти | сульфатна кислота | B | |
| 2 | оксиди | Складні речовини, утворені двома елементами, одним із яких є Оксиген у ступені окиснення –2 | сульфур(VI) оксид | Д | |
| 3 | основи | Складні речовини, утворені катіонами металічних елементів й аніонами гідроксильних груп. Кількість гідроксильних груп у формулі основи дорівнює ступеню окиснення металічного елемента в ній | кальцій гідроксид | A | |
| 4 | солі | Складні речовини, йонні сполуки. Середні солі утворені катіонами металічних елементів або/та амонію й аніонами кислотних залишків | кальцій сульфат | Б | |
Відповідь: 1В; 2Д; 3А; 4Б.
ТЕМА: Загальна хімія. Солі. Класифікація солей. Кислі солі.
Завдання скеровано на перевірку вміння розпізнавати формули кислих солей.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Умову завдання задовольняє речовина, формула якої
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Кислоти. Солі.
Завдання скеровано на перевірку вміння складати формули багатоосновних оксигеновмісних кислот і відповідних кислих солей.
Проаналізувавши наведені формули речовин, можна дійти висновку, що йдеться про солі двохосновних оксигеновмісних кислот, утворених хімічним елементом, ступені окиснення атомів якого в них дорівнюють +4 і +6:
Умову завдання задовольняє Сульфур, який утворює двохосновні оксигеновмісні кислоти – сульфітну
Відповідь: B.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
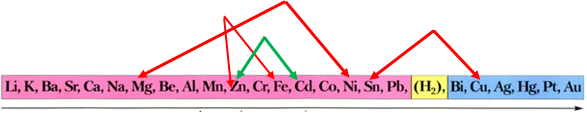
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що цинк витісняє із солі кадмій, оскільки в ряду активності він розташований лівіше від нього:
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати середні солі за їхніми хімічними формулами.
Кисла сіль – сіль, добута частковою нейтралізацією багатоосновної кислоти, тобто продукт неповного заміщення атомів Гідрогену в молекулі такої кислоти на атоми металічних елементів. Такі солі мають катіони Гідрогену, здатні заміщуватись на катіони металічних елементів.
Такими солями є солі, формули яких наведено у варіантах відповіді А, Б, Г.
У варіанті відповіді В наведено формулу середньої солі – амоній карбонату, у складі якого немає катіонів Гідрогену, здатних заміщуватися на атоми металічних елементів.
Відповідь: B.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
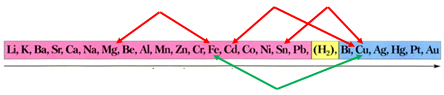
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що залізо витісняє із солі мідь, оскільки розташоване лівіше від нього:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Солі. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
У сполуках із неметалічними елементами Гідроген має ступінь окиснення +1, ступінь окиснення Оксигену зазвичай дорівнює -2.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
А
Б
В
Г
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання натрій нітрату.
Відповідь: B.
ТЕМА: Генетичні зв’язки між неорганічними й органічними речовинами.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості неорганічних й органічних речовин для прогнозування продуктів хімічних реакцій.
| 1 | продуктом реакції кальцій карбіду з водою є етин | Д |
| 2 | продуктом реакції алюміній карбіду з водою є метан | Г |
| 3 | продуктом реакції алюмінію з хлоридною кислотою є водень | В |
| 4 | продуктом реакції кальцій карбонату с водою є карбон(ІV) оксид | А |
Відповідь: 1Д, 2Г, 3В, 4А.
ТЕМА: Загальні відомості про металічні елементи й метали. Калій, кальцій, сполуки Калію і Кальцію.
Завдання скеровано на перевірку знання хімічних властивостей калію, кальцію, сполук Калію і Кальцію.
А у реакції з водою атоми Калію і Кальцію віддають електрони з утворенням катіонів, що мають однакову електронну конфігурацію:
Б взаємодія калію і кальцію з водою відбувається бурхливо з виділенням водню
В В у промисловості кальцій оксид добувають випалюванням вапняку
Г оксид і гідроксид Кальцію виявляють основні властивості
Відповідь: B.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
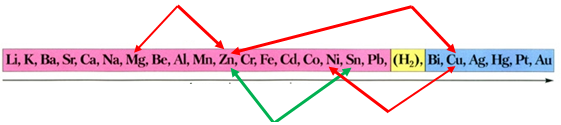
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що цинк витісняє із солі олово, оскільки розташований лівіше від нього:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини.
1
2
3
4
Відповідь: Б, А, Д, Б.
ТЕМА: Закон збереження маси речовин. Хімічні рівняння. Нітрати.
Завдання скеровано на перевірку знання продуктів термічного розкладання нітратів залежно від положення металу в ряду активності й уміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання рівнянь реакцій.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
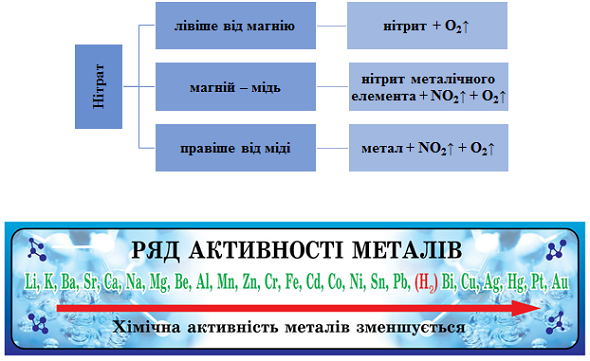
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів рівняння термічного розкладання купрум(ІІ) оксиду дорівнює
Відповідь: B.
ТЕМА: Солі.
Завдання скеровано на перевірку знання тривіальних назв деяких неорганічних речовин, зокрема солей.
Головний складник мармуру – кальцій карбонат, формула якого
Відповідь: B.
ТЕМА: Загальна хімія. Солі. Неорганічна хімія. Солі амонію.
Завдання скеровано на перевірку вміння розпізнавати формули солей амонію.
Катіон амонію утворюється внаслідок приєднання катіона Гідрогену до молекули амоніаку:
Умову завдання задовольняє формула амоній сульфату
Відповідь: Б.
ТЕМА: Загальна хімія. Солі.
Завдання скеровано на перевірку вміння розпізнавати формули кислих солей сульфатної кислоти.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Умову завдання задовольняє речовина, формула якої
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакції солі з кислотою.
Сильні й нелеткі кислоти витісняють із солей слабкі, леткі, нестійкі кислоти (рис. 1).
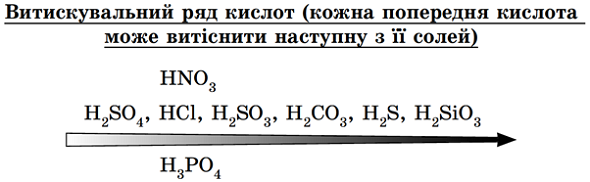
Рис. 1. Витискувальний ряд кислот
Із сильною хлоридною кислотою реагує сіль слабшої карбонатної кислоти – кальцій карбонат
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених пар «метал – сіль» лише залізо реагуватиме з купрум(ІІ) сульфатом у водному розчині, оскільки в ряду активності воно розташоване лівіше від міді:
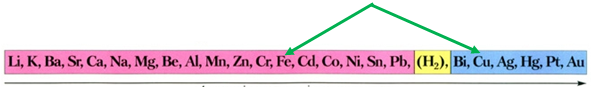
Рис. 1. Ряд активності металів
Відповідь: Б.
ТЕМА: Групи хімічних елементів.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі галогенів і їхніх сполук.
Хлор як активніший галоген витісняє менш активні галогени
Відповідь: A.
ТЕМА: Неорганічна хімія. Сульфур(ІV) оксид.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі сульфур(ІV) оксиду.
Сульфур(ІV) оксиду відповідає двохосновна сульфітна кислота, яка може утворювати як середні солі (сульфіти), так і кислі – гідрогенсульфіти. За мольного співвідношення сульфур(ІV) оксиду й натрій гідроксиду 1 : 1 хімічна реакція між ними відбувається за рівнянням:
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку знання тривіальних назв деяких солей.
Поташ – тривіальна назва калій карбонату, формула якого
Відповідь: Г.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння використовувати ряд активності металів для прогнозування можливості перебігу реакції між металом і сіллю в її розчині.

Рис. 1. Ряд активності металів
Що лівіше розташований метал в ряду активності, то більша його активність і відновні властивості.
Із-поміж металів, про які йдеться в завданні, активнішим за свинець є залізо, саме воно витіснятиме свинець із плюмбум(ІІ) нітрату в його водному розчині:
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку знання складу мінералів і їхніх назв.
1
2
3
4
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 бінарна сполука металічного елемента з неметалічним – середня сіль – Г.
2 продукт неповного заміщення атомів Гідрогену в молекулі карбонатної кислоти на атоми Натрію – кисла сіль – Д.
3 розчинна складна речовина утворена катіонами Калію і гідроксид-аніонами – В.
4 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену –2 – A.
Відповідь: 1Г, 2Д, 3В, 4А.
ТЕМА: Загальна хімія. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання властивостей солей карбонатної кислоти, взаємного перетворення карбонатів і гідрогенкарбонатів.
Натрій гідрогенкарбонат – кисла сіль, тому реагує з натрій гідроксидом:
Відповідь: Г.
ТЕМА: Загальна хімія. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули характерних для хімічного елемента сполук за його місцем у періодичній системі.
У завданні наведено формули двох кислих солей. Це солі, утворені двохосновними кислотами того самого хімічного елемента. Їхні хімічні формули
Це свідчить, що елемент
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що алюміній як активніший метал витіснятиме із солі мідь (рис. 1).

Рис. 1. Ряд активності металів
Відповідь: B.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати середні солі за їхніми хімічними формулами.
Солі – йонні сполуки, утворені катіонами металічних елементів або амонію й аніонами кислотних залишків. Кислі солі – продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони амонію або металічних елементів.
Середньою сіллю є калій перманганат (A).
Амоній гідрогенсульфат (Б) і калій дигідрогенфосфат (Г) – кислі солі, магній гідроксихлорид (В) – осно́вна сіль.
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й класифікувати неорганічні речовини за їхнім складом і властивостями (рис. 1, 2).
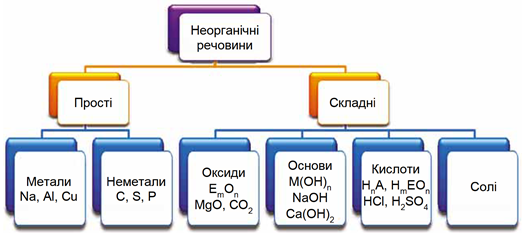
Рис. 1. Класифікація неорганічних речовин за складом. У наведених на схемі загальних формулах Е – елемент, М – металічний елемент, А – неметалічний елемент VI або VII групи періодичної системи хімічних елементів
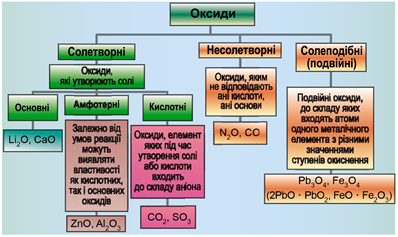
Рис. 2. Рис. 2. Класифікація оксидів
| 1 | несолетворний оксид | B | |
| 2 | кислота | Г | |
| 3 | кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти на атоми металічного елемента | Д | |
| 4 | кислотний оксид | Б |
Відповідь: 1B, 2Г, 3Д, 4Б.
ТЕМА: Неорганічна хімія. Кисень. Нітрати.
Завдання скеровано на перевірку знання способів добування кисню і вміння прогнозувати продукти реакцій термічного розкладання солей.
Один зі способів добування кисню в лабораторії – термічне розкладання нітратів, зокрема лужних елементів:
Відповідь: A.
ТЕМА: Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі хлоридної кислоти.
Хлоридна кислота є сильною леткою кислотою, тому реагує з амфотерним купрум(ІІ) оксидом (2), натрій силікатом (3) як сіллю слабкої кислоти, цинком (5) як металом, розташованим у ряду активності металів до водню (рис. 1).

Хлоридна кислота не реагує з міддю як металом, розташованим у ряду активності металів після водню, силіцій(IV) оксидом як кислотним і натрій сульфатом як сіллю сильної нелеткої кислоти.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що залізо не витіснятиме із солей барій, кальцій і цинк, оскільки в ряду активності воно розташоване лівіше від них:
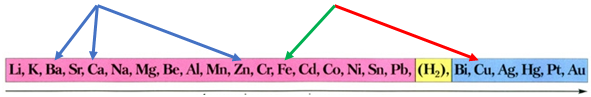
Залізо як активніший метал витісняє мідь із солі Купруму(ІІ):
Затим потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):

Вочевидь маса залізної пластинки збільшиться, якщо її занурити у водний розчин купрум(ІІ) нітрату.
Відповідь: Г.
ТЕМА: Загальна хімія. Солі.
Завдання скеровано на перевірку вміння розпізнавати хімічні формули солей.
Середні солі складаються з катіонів металічних елементів і/або амонію й аніонів кислотних залишків. Кислі солі окрім цього містять катіони Гідрогену.
Умову завдання задовольняють речовини, формули яких
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні речовини різних класів.
Речовина (1) утворена катіонами Кальцію і карбонат-аніонами – кальцій карбонат, сіль (Г).
Речовина (2) містить атоми Гідрогену й кислотний залишок силікат – силікатна кислота (В).
Речовина (3) утворена катіонами Алюмінію і гідроксид-аніонами – амфотерний алюміній гідроксид (Д).
Речовина (4) – сульфур(IV) оксид, бінарна сполука Сульфуру й Оксигену, у молекулах якої ступінь окиснення атомів Оксигену становить –2 (А).
Відповідь: 1Г, 2В, 3Д, 4А.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
1 натрій гідрогенкарбонат – питна сода (Б)
2 силіцій(IV) оксид – кварцовий пісок (Д)
3 натрій хлорид – кам’яна сіль (А)
4 кальцій гідроксид – гашене вапно (Г)
Відповідь: 1Б, 2Д, 3А, 4Г.
ТЕМА: Неорганічні речовини. Силікати.
Завдання скеровано на перевірку знання галузей застосування силікатів.
Розчинне скло – водний розчин силікатів Натрію і Калію – використовують як силікатний клей.
Відповідь: A.
ТЕМА: Неорганічні речовини. Солі амонію. Карбонати.
Завдання скеровано на перевірку знання застосування солей амонію і карбонатів.
Як розпушувач тіста в харчовій промисловості використовують амоній гідрогенкарбонат, який за нагрівання розкладається. Усі продукти його розкладання – гази, які розпушують тісто:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Ортофосфатна кислота.
Завдання скеровано на перевірку вміння прогнозувати склад продуктів реакції нейтралізації ортофосфатної кислоти лугом залежно від мольного відношення реагентів.
Ортофосфатна кислота триосновна.
Якщо натрій гідроксид й ортофосфатну кислоту взято в мольному відношенні 1 : 1, утворюється натрій дигідрогенортофосфат
За мольного відношення лугу й кислоти 2 : 1 утворюється натрій гідрогенортофосфат
За мольного відношення лугу й кислоти 3 : 1 утворюється натрій ортофосфат
Тож внаслідок поступової нейтралізації лугом ортофосфатної кислоти послідовно утворяться солі, формули яких
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
Речовина (1) утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, і кислотним залишком сульфітної кислоти – сульфітна кислота (Б).
Речовина (2) утворена катіонами Магнію й ортофосфат-аніонами – сіль магній ортофосфат (Д).
Речовина (3) утворена катіонами Кальцію й гідроксид-аніонами – розчинна основа кальцій гідроксид (Г).
Речовина (4) утворена катіонами Кальцію й аніонами Оксигену – основний кальцій оксид (В).
Відповідь: 1Б, 2Д, 3Г, 4В.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку знання тривіальних назв солей.
Гіпс (1) –
Алебастр (2) –
Негашене вапно (3) –
Кальцинована сода (4) –
Відповідь: 1В, 2А, 3Д, 4Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати формули кислих солей.
Кислі солі – електроліти, які у водному розчині дисоціюють на катіони металічних елементів, Гідрогену й аніони кислотного залишку.
Кислі солі можна розглядати як продукти неповного заміщення атомів Гідрогену багатоосновних кислот металом.
Умову завдання задовольняє натрій гідрогенкарбонат
Відповідь: B.
ТЕМА: Класифікація неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми хімічними формулами.
| 1 | середня сіль | Г | |
| 2 | кисла сіль | Д | |
| 3 | осно́вний оксид | B | |
| 4 | кислотний оксид | Б |
Відповідь: 1Г, 2Д, 3В, 4Б.
ТЕМА: Солі. Застосування солей.
Завдання скеровано на перевірку знання застосування солей.
Добрива – органічні й неорганічні речовини, які застосовують для поліпшення умов живлення культурних рослин з метою підвищення врожаю і поліпшення його якості. Вони містять поживні елементи – Нітроген, Фосфор, Калій. З-поміж солей, формули яких наведено у варіантах відповіді, умову завдання задовольняє амоній нітрат (амонійна селітра).
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати представників різних класів неорганічних сполук.
| 1 | барій сульфіт |
A |
| 2 | боратна кислота |
Г |
| 3 | амоній гідрогенкарбонат |
Д |
| 4 | кальцій оксид |
Б |
Відповідь: 1А, 2Г, 3Д, 4Б.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Порівнявши положення металів у ряду активності (рис. 1), можна дійти висновку, що цинк витіснятиме із солей свинець (В) і нікель (Г), оскільки в ряду активності він розташований лівіше:
Активніші метали – барій (А) і кальцій (Б), які в ряду активності розташовані лівіше за цинк, він із розчинів солей витіснити не зможе.

Рис. 1 Ряд активності металів
Атомна маса Плюмбуму більша за атомну масу Цинку, тому маса пластинки збільшилася.

Тобто умову завдання задовольняє лише плюмбум(ІІ) нітрат.
Відповідь: B.
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Неорганічна хімія. Термічне розкладання нітратів.
Завдання скеровано на перевірку знання властивостей нітратів і класифікації хімічних реакцій за кількістю і хімічним складом реагентів і продуктів.
Кисень із натрій нітрату добувають реакцією, рівняння якої
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами залишку силікатної кислоти – кислота – Г
2 розчинна складна речовина утворена катіонами барію і гідроксид-аніонами – луг – В
3 продукт неповного заміщення атомів Гідрогену в молекулі ортофосфатної кислоти на атоми Калію – кисла сіль – А
4 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену становить –2, реагує як із лугами, так і з кислотами – Б
Відповідь: 1Г, 2В, 3А, 4Б.
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
ТЕМА: Загальна хімія. Солі амонію.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовин для складання хімічних рівнянь.
Рівняння реакції розкладання амоній карбонату таке:
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що свинець не витіснятиме із солі залізо, залізо – алюміній, мідь – цинк (рис. 1).

Рис. 1. Ряд активності металів
Цинк як активніший метал витісняє cвинець із солі Плюмбуму(ІІ):
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку знання застосування солей.
Добрива – органічні й неорганічні речовини, які застосовують для поліпшення умов живлення культурних рослин із метою підвищення врожаю і поліпшення його якості. Вони містять поживні елементи – Нітроген, Фосфор, Калій. З-поміж солей, формули яких наведено у варіантах відповіді, умову завдання задовольняє калій нітрат (калійна селітра).
Барій сульфат і купрум(ІІ) сульфід нерозчинні, тому рослини не здатні їх засвоїти. Натрій хлорид згубно впливає на рослини.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 складна речовина, утворена катіонами металічного елемента й аніонами залишку хлорaтної кислоти – середня сіль – Б
2 складна речовина утворена катіонами Алюмінію і гідроксид-аніонами, яка реагує як із кислотами, так і з лугами, – амфотерний гідроксид – В
3 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену становить –2 – Г
4 продукт неповного заміщення атомів Гідрогену в молекулі сульфітної кислоти на атоми Натрію – кисла сіль – Д
Відповідь: 1Б, 2В, 3Г, 4Д.
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку вміння прогнозувати здатність галогенів витісняти один одного із солей у водних розчинах.
Окиснювальні властивості галогенів зменшуються в підгрупі зі збільшенням протонного числа. Хлор витісняє йод із калій йодиду у водному розчині:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати солі за їхніми хімічними формулами.
Солі – йонні сполуки, утворені катіонами металічних елементів або амонію й аніонами кислотних залишків. Кислі солі – продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони амонію або металічних елементів.
У завданні наведено формули солей – натрій етаноату (1), калій перманганату (4), амоній дигідрогенкарбонату (6).
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
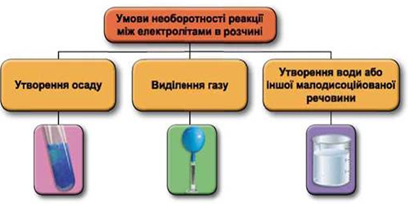
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє хлоридна кислота, яка не реагує з натрій сульфатом і реагує з натрій карбонатом:
Відповідь: B.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.

Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Продуктами термічного розкладання амоній нітрату є нітроген(І) оксид і вода.
Відповідь: 1А, 2В, 3Б, 4Г.
ТЕМА: Застосування органічних і неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
| Хімічна форула | Застосування речовини | ||
| 1 | Поліконденсацією 6-аміногексанової кислоти можна добути капрон | Д | |
| 2 | Натрій стеарат – мило | B | |
| 3 | Натрій флуорид, сіль, антикарієсна добавка до зубних паст | A | |
| 4 | Калій хлорид, сіль, катіони Калію і хлорид-аніони беруть участь у регулюванні водно-сольового обміну | Б |
Відповідь: 1Д, 2В, 3А, 4Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку вміння складати рівняння реакцій за участі неорганічних речовин.
Харчова сода – тривіальна назва натрій гідрогенкарбонату – сіль слабкої карбонатної кислоти. Під дією оцтової (етанової), яка сильніша за карбонатну, відбувається реакція:
Сума коефіцієнтів у цьому хімічному рівняння –
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Д | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | одноосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | B |
Відповідь: 1Д, 2А, 3Б, 4В.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
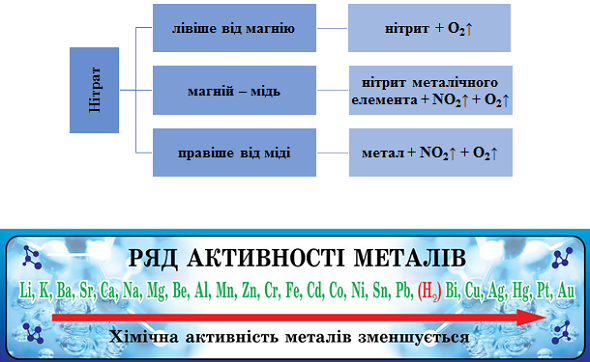
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів рівняння термічного розкладання аргентум(I) нітрату дорівнює
Відповідь: B.
ТЕМА: Неорганічна хімія. Солі.
Завдання скеровано на перевірку вміння класифікувати солі.
Формула питної соди
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати речовини за хімічним складом і властивостями.
| Речовина | |||||
| Формула | Хімічний склад | Назва | Природа | ||
| 1 | Бінарна сполука типового неметалічного елемента з Оксигеном, ступінь окиснення якого –2 | Сульфур(IV) оксид | Кислотний оксид | A | |
| 2 | Складна речовина, утворена катіонами лужного елемента й гідроксид-аніонами | Калій гідроксид | Луг | Г | |
| 3 | Складна речовина, утворена атомами Гідрогену, здатними до заміщення на атоми металічного елемента, і кислотним залишком | Сульфідна кислота | Двоосновна кислота | B | |
| 4 | Складна речовина, утворена катіонами металічного елемента й кислотним залишком | Натрій сульфіт | Сіль | Б | |
Відповідь: 1А, 2Г, 3В, 4Б.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
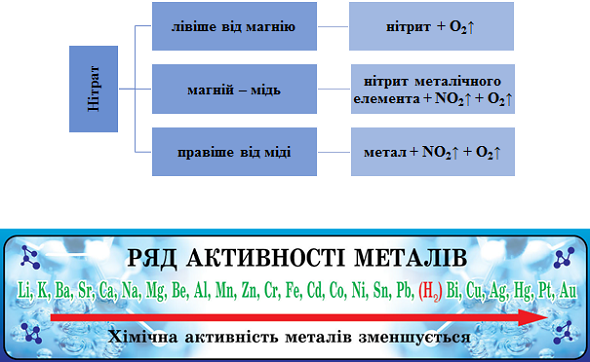
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів у правій частині рівняння термічного розкладання купрум(ІІ) оксиду дорівнює
Відповідь: B.
ТЕМА: Неорганічна хімія. Тривіальні назви неорганічних речовин.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
| Назва речовини | Хімічна формула | |||
| тривіальна | систематична | |||
| 1 | негашене вапно | кальцій оксид | B | |
| 2 | поташ | калій карбонат | Д | |
| 3 | гіпс | кальцій сульфат дигідрат | Г | |
| 4 | сухий лід | карбон(VІ) оксид | Б | |
Відповідь: 1В, 2Д, 3Г, 4Б.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених металів лише цинк реагуватиме з ферум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від заліза:
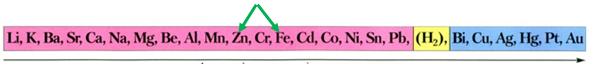
Рис. 1. Ряд активності металів
Відповідь: A.




