Розділ: Будова атома і періодична система хімічних елементів
Тема: Зовнішній енергетичний рівень атомів
Кількість завдань: 38
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Фізичний зміст номера періоду та номера групи. Неорганічна хімія. Хлор. Гідроген хлорид.
Завдання скеровано на перевірку вміння визначати хімічний елемент за його місцем у періоді й групі та знання хімічних властивостей гідроген хлориду.
Елемент третього періоду, в атомі якого міститься сім електронів, – Хлор. Водний розчин його леткої сполуки з Гідрогеном – хлоридна кислота. Під дією хлоридної кислоти універсальний індикаторний папірець набуде червоного кольору.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння природи хімічного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні. Будова зовнішнього енергетичного рівня.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішніх енергетичних рівнях атомів.
Номер групи (короткоперіодна форма періодичної системи хімічних елементів), у якій міститься хімічний елемент, збігається з кількістю електронів на зовнішньому енергетичному рівні його атома.
| Хімічний елемент | |||
| Назва | Номер групи в періодичній системі хімічних елементів (короткоперіодна форма) | Кількість електронів на зовнішньому енергетичному рівні атома | |
| Кальцій | IIA | 2 | Б |
| Силіцій | IVA | 4 | B |
| Фосфор | VA | 5 | Г |
| Бром | VIIA | 7 | A |
Відповідь: Б В Г А.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Сульфур | VI | Д | |
| 2 | Кальцій | II | B | |
| 3 | Натрій | I | Г | |
| 4 | Силіцій | IV | A |
Відповідь: 1Д, 2В, 3Г, 4А.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів VIIА групи зі збільшенням протонного числа збільшується кількість енергетичних рівнів. Флуор, Хлор, Бром, Йод, Астат – елементи другого, третього, четвертого, п’ятого, шостого періодів відповідно, а номер періоду дорівнює кількості енергетичних рівнів в атомі.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його оксиду становить
Тобто йдеться про Натрій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: B.
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
Сім електронів на зовнішньому енергетичному рівні міститься в атомах хімічних елементів VIIА групи – галогенів. Умову завдання задовольняє елемент із протонним числом
Відповідь: B.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи. Електронні формули атомів.
Завдання скеровано на перевірку вміння розпізнавати електронні формули лужноземельних елементів.
Лужноземельні елементи належать до головної підгрупи другої групи (ІІА групи), у їхніх атомах на зовнішньому енергетичному рівні два електрони.
Відповідь: Б.
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо будови її атома.
Завдання скеровано на перевірку вміння встановлювати зв’язок між місцем елемента в періодичній системі, будовою його атома, формулами найважливіших сполук хімічного елемента та аналізувати їх.
Дано:
Знайти:
Магній – елемент ІІА групи періодичної системи хімічних елементів, у його атомі на зовнішньому енергетичному рівні два електрони. Відповідно в атомі шуканого елемента на зовнішньому енергетичному рівні шість електронів, тож це елемент VІА групи третього періоду.
Умову завдання задовольняє Сульфур, формула його вищого оксиду –
Відповідь: 4.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Енергетичні рівні.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні атома за місцем хімічного елемента в періодичній системі.
В атомах елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи в короткоперіодній формі періодичної системи.
| Назва хімічного елемента | Номер групи | Кількість електронів на зовнішньому енергетичному рівні атома | |
| Натрій | ІА | 1 | B |
| Кальцій | ІІА | 2 | Б |
| Алюміній | ІІІА | 3 | A |
| Силіцій | IVА | 4 | Г |
Відповідь: В Б А Г.
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння поняття «валентні електрони» й уміння визначати валентні можливості атомів.
Валентний електрон – електрон, що може утворювати хімічні зв’язки, в атомі, а отже, визначає поведінку атома в хімічних реакціях.
Електронна конфігурація атома Сульфуру
Електронна конфігурація атома Хрому
Сульфур і Хром – елементи різних періодів, у їхніх атомах різна кількість енергетичних рівнів і валентних орбіталей.
У бінарних сполуках із Гідрогеном Сульфур(ІІ) і Хром(ІІ) мають різні ступені окиснення:
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати кількість електронів на зовнішньому енергетичному рівні атомів за місцем хімічних елементів у періодичній системі.
Кількість енергетичних рівнів в електронній оболонці атома збігається з номером періоду, до якого належить хімічний елемент.
| Символ хімічного елемента | Номер періоду | Кількість електронів на зовнішньому енергетичному рівні атома | |
| IA | 1 | Г | |
| VA | 5 | A | |
| VIA | 6 | B | |
| VIIA | 7 | Б |
Відповідь: Г, А, В, Б.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атомів хімічних елементів.
Кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп періодичної системи збігається з номером групи:
| Назва хімічного елемента | Номер групи | Електронна формула | ||
| 1 | Сульфур | VIА | B | |
| 2 | Хлор | VIIА | Б | |
| 3 | Магній | IIА | A | |
| 4 | Калій | IА | Г |
Відповідь: В, Б, А, Г.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів того самого періоду.
У періодах зі зростанням протонного числа збільшується кількість електронів на зовнішньому енергетичному рівні атомів хімічних елементів. Ця закономірність справедлива й для елементів 3 періоду (рис. 1).

Рис. 1. Будова зовнішнього енергетичного рівня атомів хімічних елементів 3 періоду
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову атома за місцем хімічного елемента в періодичній системі.
За кількістю електронів на зовнішньому енергетичному рівні можна дійти висновку, що йдеться про хімічний елемент ІІІА (13) групи. Тобто формула його гідроксиду
Відносна атомна маса елемента ІІІА (13) групи Алюмінію –
Його порядковий номер і, відповідно, протонне число, –
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число й будову зовнішнього енергетичного рівня атома за місцем хімічного елемента в періодичній системі.
За умовою в атомі хімічного елемента шість електронів на зовнішньому енергетичному рівні. Тобто це елемент 6А (16) групи періодичної системи.
Умову завдання з-поміж наведених задовольняє елемент із протонним числом 16 Сульфур.
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні атома.
Кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп збігається з номером групи елемента в періодичній системі (короткоперіодний варіант).
Хлор – хімічний елемент VІІА групи, Селен – VІА групи, Бор – ІІІА групи, Літій – ІА групи.
Відповідь: 1Г, 2В, 3Б, 4А.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, визначати формулу гідрату оксиду хімічного елемента за місцем елемента в періодичній системі.
Оскільки в атомі хімічного елемента на зовнішньому енергетичному рівні три електрони, можна дійти висновку, що це елемент ІІІ А підгрупи. Тобто хімічна формула його гідроксиду
Відносна атомна маса 27 в Алюмінію, його протонне число 13.
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів хімічних елементів однієї підгрупи періодичної системи.
A у цих елементів різні протонні числа, а тому й різна кількість електронів в атомах
Б це елементи однієї підгрупи (VIIА), тому в їхніх атомах однакова кількість (7) електронів на зовнішньому енергетичному рівні
B це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів
Г це елементи різних періодів, тому в їхніх атомах різна кількість енергетичних підрівнів
Електронна формула атома Хлору
Електронна формула атома Брому
Відповідь: Б.
ТЕМА: Неорганічні речовини. Періодична система хімічних елементів. Будова атома. Галогени.
Завдання скеровано на перевірку вміння характеризувати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хлор і Йод – елементи VІІ А групи періодичної системи хімічних елементів. Тому спільним у будові їхніх атомів є однакова кількість електронів на зовнішньому енергетичному рівні, яка збігається з номером групи:
Відповідь: B.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
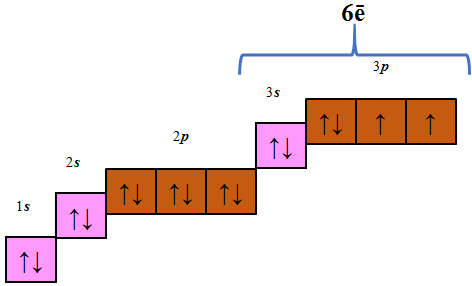
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Радіус атома.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і радіус атома.
У поданому ряду хімічних елементів збільшуються їхні протонні числа. Тому з огляду на електронейтральність атомів загальна кількість електронів на зовнішньому енергетичному рівні також збільшується.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи й у поданому ряду хімічних елементів збільшується.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується. Подані елементи належать до одного періоду, тому зі збільшенням протонного числа їхня електронегативність збільшується.
Атомний радіус – половина віддалі, на якій перебувають сусідні атоми в структурі простої речовини. Величина залежить від алотропної видозміни елемента. Також атомним радіусом називають половинну відстань між ядрами атомів того самого елемента, коли атоми зв’язані одинарним ковалентним зв’язком або перебувають у кристалі металу. У періодах зі збільшенням протонних чисел атомні радіуси зменшуються, у групах хімічних елементів – збільшуються (рис. 1). Подані елементи належать до одного періоду, тому зі збільшенням протонного числа збільшується електронегативність атомів.
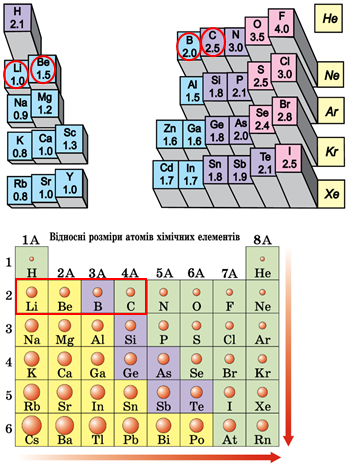
Рис. 1. Закономірності зміни електронегативності й радіуса атомів хімічних елементів у періодичній системі
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів.
Завдання скеровано на перевірку вміння порівнювати будову зовнішніх енергетичних рівнів атомів.
На зовнішньому енергетичному рівні в атомах лужних елементів (І А група) один s-електрон, в атомах лужноземельних (ІІ А група) – два s-електрони, в атомах галогенів (VІІ А група) – два s-електрони і п’ять p-електронів, в атомах інертних елементів (VІІІ А група) – два s-електрони і шість p-електронів (за винятком атома Гелію, у якому на зовнішньому енергетичному рівні два s-електрони).
Кількість електронів на зовнішньому енергетичному рівні збільшується в ряду
Відповідь: 1В, 2Г, 3А, 4Б.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
A Натрій – хімічний елемент І А, а Хлор – VII А групи періодичної системи, в атомі Натрію один, а в атомі Хлору – сім електронів на зовнішньому енергетичному рівні
Б Натрій і Хлор – хімічні елементи третього періоду періодичної системи, електрони в їхніх атомах перебувають на трьох енергетичних рівнях
В Натрій – s-елемент, а Хлор p-елемент, тому кількість енергетичних рівнів, на яких перебувають електрони в їхніх атомах, різна
Г у Натрію і Хлору різні протонні числа, і, відповідно, різні кількості електронів в атомах
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
В атомі хімічного елемента 17 електронів (6
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома. Кількість електронів на зовнішньому енергетичному рівні в атомі.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні в атомі.
Кількість електронів на зовнішньому енергетичному рівні в атомі, визначають за номером групи (короткоперіодна форма періодичної системи), у якій розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів тієї самої групи. З-поміж наведених це елементи з протонними числами
Відповідь: B.
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
Три електрони на зовнішньому енергетичному рівні міститься в атомах хімічних елементів IIІА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: B.
ТЕМА: Загальна хімія. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів за їхнім положенням у періодичній системі.
Фізичний зміст номера групи хімічного елемента в короткоперіодном варіанті періодичної системи – кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп.
Відповідь: B.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів. В атомах елементів побічних підгруп на зовнішньому енергетичному рівні два (зрідка – один) електрони, оскільки в них добудовується внутрішній d-підрівень.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Молібден | VI Б | Д | |
| 2 | Арсен | V А | A | |
| 3 | Манган | VІI Б | Г | |
| 4 | Йод | VІІ А | B |
Відповідь: 1Д, 2А, 3Г, 4В.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
Два електрони на зовнішньому енергетичному рівні міститься в атомах хімічних елементів IIА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні. Будова зовнішнього енергетичного рівня.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішніх енергетичних рівнях атомів.
Номер групи (короткоперіодна форма періодичної системи хімічних елементів), у якій міститься хімічний елемент, збігається з кількістю електронів на зовнішньому енергетичному рівні його атома.
| Хімічний елемент | |||
| Назва | Номер групи в періодичній системі хімічних елементів (короткоперіодна форма) | Кількість електронів на зовнішньому енергетичному рівні атома | |
| Калій | IA | 1 | Г |
| Фосфор | VA | 5 | Б |
| Оксиген | VIA | 6 | B |
| Хлор | VIIA | 7 | A |
Відповідь: Г Б В А.
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Сульфур | VI | Д | |
| 2 | Хлор | VII | Б | |
| 3 | Калій | I | Г | |
| 4 | Кальцій | II | A |
Відповідь: 1Д, 2Б, 3Г, 4А.
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів другого періоду послідовно збільшуються номери груп, до яких вони належать, і, відповідно, кількість електронів на зовнішньому енергетичному рівні їхніх атомів.
Відповідь: Г.
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його гідроксиду становить
Тобто йдеться про Кальцій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
П’ять електронів на зовнішньому енергетичному рівні міститься в атомах хімічних елементів VА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: Б.
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння аналізувати й порівнювати будову атомів з огляду на місце хімічних елементів у періодичній системі.
Кількість електронів на зовнішньому енергетичному рівні визначають за номером групи хімічного елемента в короткоперіодній формі періодичної системи.
| Символ хімічного елемента | ||||
| Номер групи | VIIA | VIA | IIIA | IA |
| Кількість електронів на зовнішньому енергетичному рівні | 7 | 6 | 3 | 1 |
Відповідь: Г В Б А.
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атомів.
Завдання скеровано на перевірку знання закономірностей зміни в періодичній системі кількості електронів на зовнішньому енергетичному рівні в атомах.
| Символ хімічного елемента | Номер групи в періодичній системі хімічних елементів (короткоперіодна форма) | Кількість електронів на зовнішньому енергетичному рівні атома | ||
| A | ІІІА | 3 | 3 | |
| Б | ІІА | 2 | 2 | |
| B | ІА | 1 | 1 | |
| Г | IVА | 4 | 4 |
Відповідь: В, Б, А, Г.




