Розділ: Мультитести
Тест: Тренувальний мультитест (4 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Хімічний елемент. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б три хімічні елементи (
В два хімічні елементи (
Г два хімічні елементи (
Відповідь: Б.
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
А
Б
В
Г
Натрій – лужний елемент, Берилій – металічний елемент, Ферум – металічний елемент (рис. 1).
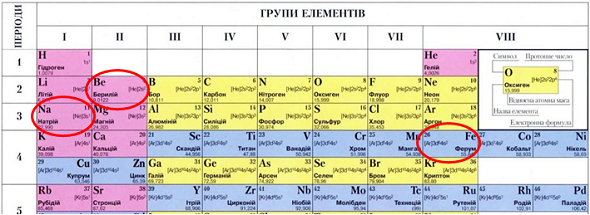
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
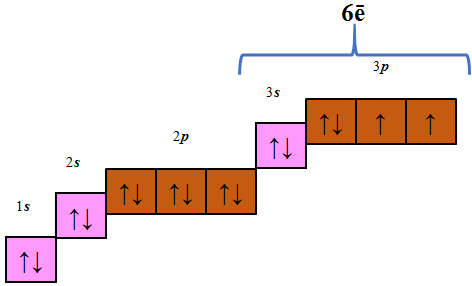
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони.
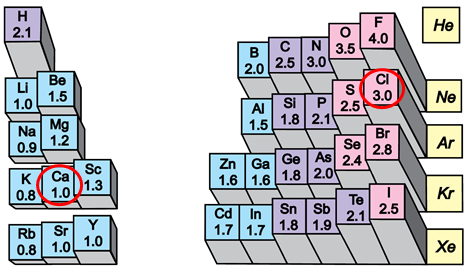
Рис. 1. Відносна електронегативність хімічних елементів
Умову завдання задовольняє кальцій хлорид. У вузлах кристалічних ґраток цієї солі містяться катіони Кальцію і хлорид-аніони.
Відповідь: B.
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, азоту, кисню, метану, бутану, гідроген хлориду, амоніаку, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (рис. 1).
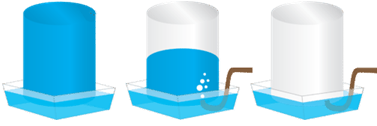
Рис. 1. Збирання газу витісненням води
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Тож умову завдання задовольняє варіант відповіді метан, кисень, азот, адже ці гази малорозчинні у воді.
Відповідь: Г.
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації.
Натрій сульфат – добре розчинна у воді середня сіль, яка дисоціює на катіони Натрію і сульфат-аніони:
Відповідь: B.
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
Умову завдання задовольняє реакція магнію (простої речовини) із сульфатною кислотою (складною речовиною). Продуктами реакції є магній сульфат (складна речовина) і водень (проста речовина). Атоми Магнію заміщують атоми Гідрогену в молекулах сульфатної кислоти.
Відповідь: A.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сульфур. Сірка. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей сполук Сульфуру, уміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Умову завдання задовольняє реакція між сульфур(IV) оксидом і киснем:
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Загальний принцип зміщення хімічної рівноваги полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, умісту реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги, компенсувавши дію впливу.
Серед наведених варіантів умову завдання задовольняє реакція
Ця реакція відбувається зі збільшенням об’єму. Тому підвищення тиску приведе до зміщення хімічної рівноваги в бік утворення реагенту.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених металів лише цинк реагуватиме з ферум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від заліза:
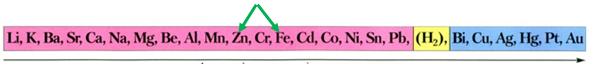
Рис. 1. Ряд активності металів
Відповідь: A.
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
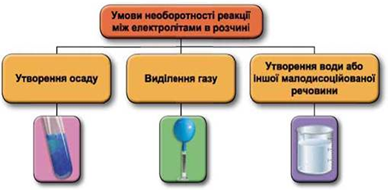
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій хлорид (А), на відміну від магній хлориду (Б), не реагує з натрій гідроксидом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
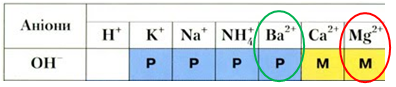
Рис. 2. Барій гідроксид – розчинна речовина, натомість магній гідроксид малорозчинний
Сильна й нелетка сульфатна кислота витісняє слабку й летку карбонатну з її солі (В), а сильна нітратна кислота – слабку сульфітну. Також можливе окиснення сульфітної кислоти до сульфатної (Г).
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
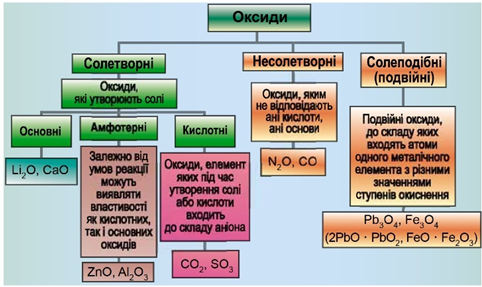
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg – Ra}\) ); - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише сульфур(VІ) оксид є кислотними, реагує з водою з утворенням сульфатної кислоти:
Відповідь: A.
ТЕМА: Неорганічна хімія. Металічні елементи. Магній. Сполуки Магнію.
Завдання скеровано на перевірку вміння класифікувати оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні оксиди.
Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рисунку 1.
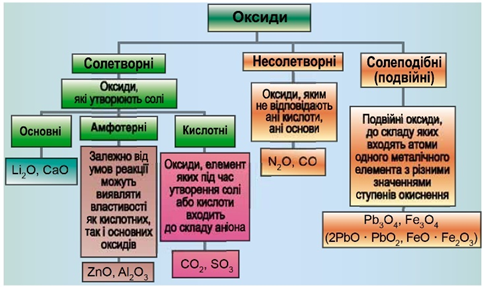
Рис. 1. Класифікація оксидів
Магній – типовий металічний елемент, його оксид
Відповідь: Б.
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Речовина
Із нітроген(ІV) оксиду добувають нітратну кислоту:
Відповідь: B.
ТЕМА: Органічна хімія. Вуглеводні. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку вміння розпізнавати молекулярні формули алканів.
Загальна формула алканів –
Відповідь: Г.
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей алкенів й уміння класифікувати хімічні реакції за їхньої участі.
Гідратація алкенів полягає в приєднанні молекули води до молекули алкену за місцем подвійного зв’язку.
Відповідь: A.
ТЕМА: Вуглеводні. Бензен. Генетичні зв’язки між вуглеводнями.
Завдання скеровано на перевірку знання хімічних властивостей і способів добування бензену, уміння встановлювати генетичні зв’язки між вуглеводнями.
Приєднання в бензені відбувається важче, ніж у ненасичених вуглеводнів – бромна вода не знебарвлюється.
І. Бензен не знебарвлює бромну воду.
ІІ. Бензен можна добути тримеризацією етину, а не етану:
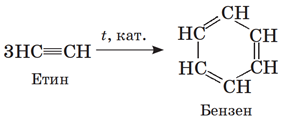
Відповідь: Г.
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
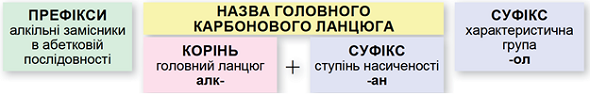
Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
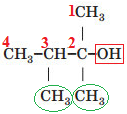
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу чотири атоми Карбону, із другим атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 2,3-диметилбутан-2-ол.
Відповідь: Г.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Хімічні властивості та визначення класів оксигеновмісних органічних сполук, їхньої будови.
Завдання перевіряє вміння за структурною формулою визначати, до якого класу органічних сполук належить речовина та знання хімічних властивостей цих речовин.
Для виконання завдання необхідно вміти визначати за функціональною (характеристичною) групою, до якого класу сполук належить речовина.
Речовина 1 (етанол) – насичений одноатомний спирт (насичений вуглеводневий радикал пов'язаний з гідроксильною групою), речовина 2 (фенол) – фенол (бензенове кільце безпосередньо пов’язане з гідроксильною групою), речовина 3 (етанова кислота) – насичена одноосновна карбонова кислота (насичений вуглеводневий радикал пов’язаний з карбоксильною групою), речовина 4 (метилметаноат) – естер (залишок кислоти пов'язаний з вуглеводневим радикалом).
Фенол (речовина 2) виявляє сильніші кислотні властивості у порівнянні з етанолом (речовина 1), тому І твердження є неправильним. Речовина 2 належить до класу фенолів, тому ІІ твердження також є неправильним. Фенол (речовина 2) і етанова кислота (речовина 3) виявляють кислотні властивості, тому й реагують з розчином натрій гідроксиду, ІІІ твердження є правильним. Етанова кислота (речовина 3) та метилметаноат (речовина 4) – міжкласові ізомери, тобто мають однаковий хімічний склад, але різну будову, тому ІV твердження є правильним. Етанова кислота (речовина 3) та метилметаноат (речовина 4) – різні класи органічних сполук, тому V твердження є неправильним.
Відповідь: B.
ТЕМА: Органічна хімія. Жири.
Завдання скеровано на перевірку знання способів добування і застосування жирів.
I. Жири – естери вищих карбонових кислот і триатомного спирту гліцеролу.
II. Гідруванням рідких ненасичених жирів добувають тверді насичені – маргарин.
У молекулах рідких жирів на відміну від твердих є подвійні карбон-карбонові зв’язки. За місцем подвійного зв’язку можлива реакція приєднання, у результаті чого ненасичена сполука перетворюється на насичену, зокрема рідкий жир – на твердий:
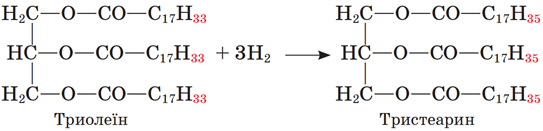
Відповідь: Б.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Анілін.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Умову завдання задовольняє нітробензен, відновленням якого добувають анілін – ароматичний амін:
Відповідь: A.
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки. Природні й синтетичні волокна.
Завдання скеровано на перевірку знання видів волокон.
Синтетичне волокно – капрон. Капрон можна розглядати як продукт внутрішньомолекулярних взаємодій карбоксильної групи й аміногрупи молекули 6-аміногексанової кислоти.
Відповідь: Г.
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії. Етанол.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі органічних сполук і класифікувати ці реакції.
Унаслідок внутрішньомолекулярної дегідратації (1) етанолу утворюється етен (Б) і вода:
Продуктом міжмолекулярної дегідратації (2) етанолу є діетиловий етер (Д):
Частковим окисненням (3) етанолу можна добути етаналь (В):
Відповідь: 1Б, 2Д, 3В.
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння аналізувати табличні дані й зіставляти їх із текстовою частиною завдання.
Проаналізуємо табличні дані й зіставимо їх із реченнями, щоб утворилося правильне твердження.
1. З підвищенням температури розчинність речовини … зменшується. Із даних таблиці видно, що лише розчинність речовини Г з підвищенням температури зменшується. Отже, 1Г.
2. За температури 40 °С в насиченому розчині речовини … її маса більша, ніж маса розчинника. Із даних таблиці видно, що за температури 40 °С лише маса речовини Б більша, ніж маса розчинника. Отже, 2Б.
3. Максимальна маса речовини …, яку можна розчинити у воді масою 150 г за температури 20 °С, становить 47,4 г. Маса води в 1,5 раза більше за наведену в таблиці масу води (розчинника), тому й маса солі має бути в 1,5 раза більше за масу розчиненої речовини і становитиме 47,4 г. Із даних таблиці зрозуміло, що за температури 20 °С речовини Б, Г, Д не задовольняють умову завдання (Г і Д набагато менше за вказану масу, Б набагато більше за вказану масу). Для речовини В 1,5 m(речовини) = 1,5 · 36 = 54, не задовольняє умову. Для речовини А 1,5 m(речовини) = 1,5 · 31,6 = 47,4 г, задовольняє умову. Отже, 3А.
Відповідь: 1Г, 2Б, 3А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
Знайти:
Відповідь: 180.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу газу за його відносною густиною.
Дано:
Знайти:
Відповідь: 64.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 40.
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси реагенту за відомим об’ємом іншого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу реагенту за відомим об’ємом іншого реагенту.
Дано:
Знайти:
Відповідь: 200.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати масу продукту реакції за відомими масою реагенту й масовою часткою чистої речовини в ньому.
Дано:
Знайти:
Відповідь: 21.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту, що містить домішки.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту, що містить домішки.
Дано:
Знайти:
Відповідь: 14.




