Розділ: Мультитести
Тест: Тренувальний мультитест (13 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Метали й неметали. Загальні відомості про неметалічні елементи й неметали. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння виявляти причиново-наслідкові зв’язки між хімічною активністю простих речовин і поширеністю їх як форми існування хімічного елемента в природі.
Прості речовини – це речовини, які складаються з атомів одного хімічного елемента. Прості речовини Натрію, Фосфору, Флуору мають порівняно високу реакційну здатність.
Фтор – найактивніший із неметалів, реагує з більшістю простих і складних речовин.
Натрій – представник лужних металів, які вирізняються високою хімічною активністю – реагують із водою, киснем тощо.
Хімічний елемент Фосфор утворює кілька простих речовин. Білий фосфор здатний до самозаймання, червоний менш активний, але також реагує з багатьма речовинами. Тому в природі Фосфор поширений у формі складних речовин.
У природі Фосфор є складником різних сполук, як-от апатити, фосфорити, фосфоліпіди тощо.
Молекула азоту – простої речовини Нітрогену – дуже стійка, тому реакційна здатність азоту низька. Саме тому Нітроген поширений у природі у формі простої речовини – азоту
Відповідь: A.
ТЕМА: Будова атома й періодична система хімічних елементів. Нукліди.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількість протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Нейтронне число
Умову завдання задовольняє варіант відповіді В.
| Нуклідний символ | ||||
| A | ||||
| Б | ||||
| B | ||||
| Г |
Відповідь: B.
ТЕМА: Будова атома й періодична система хімічних елементів. Групи й підгрупи хімічних елементів.
Завдання скеровано на перевірку вміння характеризувати хімічні елементи за їхнім місцем у періодичній системі.
А наведено символи хімічних елементів, що належать до різних груп:
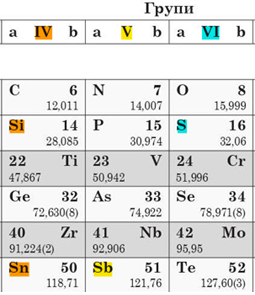
Б поміж цих елементів немає галогенів
В поміж цих елементів є металічний –
Г валентності елементів у вищих оксидах
Відповідь: Б.
ТЕМА: Речовина. Кристалічні ґратки.
Завдання скеровано на перевірку вміння аналізувати фізичні властивості речовини й визначати за ним тип кристалічних ґраток у ній.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Фенол – речовина молекулярної будови. Унаслідок слабких зв’язків між молекулами фенолу він має порівняно невисоку температуру плавлення і характерний запах, бо молекули фенолу дифундують у повітря внаслідок руйнування міжмолекулярних зв’язків.
Відповідь: Г.
ТЕМА: Речовина. Суміші речовин. Види сумішей.
Завдання скеровано на перевірку вміння аналізувати текстову й графічну інформацію, розрізняти чисті речовини, неоднорідні суміші, розчини – істині й колоїдні.
За результатами аналізу рисунка й наведених варіантів відповіді можна дійти висновку, що зображено випарювання водного розчину калій хлориду. Унаслідок нагрівання такого розчину у фарфоровій чашці за допомогою спиртового пальника вода випаровується, а калій хлорид кристалізується.
Водний розчин калій хлориду є істинним, оскільки це стійка рівноважна система частинок двох речовин – води і калій хлориду. Розміри молекул води, катіонів Калію і хлорид-аніонів не перевищують
Відповідь: B.
ТЕМА: Речовина. Реакції йонного обміну.
Завдання скеровано на перевірку розуміння суті електролітичної дисоціації та умов необоротності реакцій йонного обміну між електролітами у водних розчинах, уміння прогнозувати перебіг цих реакцій за допомогою таблиці «Poзчинність ocнов, амфотерних гідроксидів, кислот і солей у воді за
Умову завдання задовольняє пара йонів
Тому кількості цих йонів, а відповідно й кількості речовин цих йонів, зменшаться, бо йони з розчину перейдуть до складу нерозчинної солі.
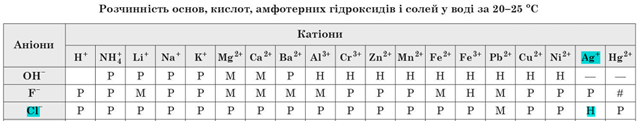
Відповідь: Б.
ТЕМА: Хімічна реакція. Класифікація хімічних реакцій за кількістю і складом реагентів і продуктів.
Завдання скеровано на перевірку знання хімічної реакції, на якій ґрунтується добування кисню з гідроген пероксиду, і вміння класифікувати хімічні реакції за кількістю і складом реактантів і продуктів.
Рівняння реакції добування кисню з гідроген пероксиду таке:
Складна речовина гідроген пероксид
Відповідь: A.
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння суті відновлення як приєднання електронів до атомів чи йонів.
Катіони – позитивно заряджені йони. Відновлення відбувається внаслідок приєднання електронів, унаслідок цього ступінь окиснення хімічного елемента зменшується.
Цю умову задовольняє варіант відповіді A – приєднання електрона до катіона Купруму (2+), який унаслідок цього перетворюється на катіон Купруму (+).
Відповідь: A.
ТЕМА: Хімічна реакція. Швидкість хімічних реакцій. Хімічна рівновага.
Завдання скеровано на перевірку вміння аналізувати рівняння оборотних реакцій і застосовувати принцип Ле Шательє для прогнозування напрямку зміщення хімічної рівноваги.
Система, що перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
Проаналізувавши наведене в умові завдання рівняння реакції можна дійти висновку, що перебіг прямої реакції – синтезу сульфур(VI) оксиду – відбувається з виділенням теплової енергії.
Тобто підвищення температури (В) має бути скомпенсоване зміщенням хімічної рівноваги вліво, адже розкладання сульфур(VI) оксиду – ендотермічний процес, під час якого теплота поглинається.
Щодо інших варіантів відповіді: з огляду на мольні (а отже й об’ємні) відношення газів збільшення концентрації сульфур(VI) оксиду (А) і зменшення концентрації кисню (Б) зміщуватиме хімічну рівновагу ліворуч.
Тиск сульфур(IV) оксиду й кисню сумарною кількістю речовини
Відповідь: Г.
ТЕМА: Неорганічна хімія. Метали й неметали. Загальні відомості про металічні елементи та метали.
Завдання скеровано на перевірку знання відмінностей у взаємодії сульфатної кислоти різної концентрації з металами й уміння прогнозувати продукти реакцій залежно від активності металу й концентрації кислоти.
У завданні йдеться про дуже розведений водний розчин сульфатної кислоти й метал середньої активності – залізо. Продуктами цієї реакції є сіль – ферум(ІІ) сульфат і водень:
Відповідь: A.
ТЕМА: Неорганічна хімія. Метали й неметали. Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей амоніаку й гідроген хлориду.
Гідроген хлорид й амоніак добре розчиняються у воді, тому додавання навіть незначної її кількості зумовить зменшення кількості цих газів у колбах і приведе до зниження тиску в них.
Середовище водного розчину амоніаку лужне, тому фенолфталеїн набуде в ньому малинового забарвлення.
Середовище водного розчину гідроген хлориду кисле, тому фенолфталеїн у ньому залишиться безбарвним.
Тож правильним із-поміж наведених є лише перше твердження.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку знання хімічних властивостей оксидів лужноземельних хімічних елементів і вміння вирізняти їх поміж інших оксидів.
Умову завдання задовольняє кальцій оксид, формула якого
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Амфотерні сполуки.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна реакція. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі з огляду на її здатність до гідролізу.
Натрій карбонат – сіль сильної основи (натрій гідроксиду) і слабкої карбонатної кислоти. Реакція середовища її водного розчину лужна, тож фенолфталеїн набуде в ньому малинового кольору.
З-поміж солей, назви яких наведено у варіантах відповіді, сіллю сильної основи і слабкої кислоти є барій сульфід, тож середовище його водного розчину лужне, а фенолфталеїн у ньому набуде малинового кольору:
Відповідь: Б.
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Органічні речовини: приклади.
Завдання скеровано на перевірку вміння розпізнавати органічні й неорганічні речовини.
З-поміж речовин, назви яких наведено, неорганічною речовиною є кисень. Сахароза, оцтова кислота (карбонова кислота) й етиловий спирт – оксигеновмісні органічні сполуки Карбону.
Відповідь: A.
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати реакції за участю органічних речовин і розпізнавати реакції різних типів.
Хімічну реакцію між двома речовинами, унаслідок якої утворюється одна сполука, в органічній хімії називають реакцією приєднання.
Умову завдання задовольняє варіант відповіді В:
перетворення
Відповідь: B.
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Гомологія.
Завдання скеровано на перевірку розуміння суті гомології в органічній хімії і вміння розпізнавати гомологи бензену.
Гомологiя – систематична змiна фiзичних властивостей i подiбнiсть хімiчних властивостей послiдовних членiв гомологiчного ряду. Послiдовний ряд сполук, кожен член у якому вiдрiзняється вiд сусiднього на однаковий атом чи ланку, зокрема на ланку
Умову завдання задовольняє варіант відповіді Г.
Відповідь: Г.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти. Феноли.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей оксигеновмісних органічних речовин – одно-, триатомного спирту, фенолу.
З-поміж наведених варіантів відповіді правильним є варіант Б – унаслідок гідролізу жирів утворюються гліцерол і вищі карбонові кислоти. Фенол та етанол не належать до продуктів гідролізу жирів.
Відповідь: Б.
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку вміння тлумачити інформацію, подану в графічній формі, і класифікувати хімічні реакції за участю органічних сполук.
У лівій частині рівняння реакції зображено моделі молекул естеру етилетаноату й води, у правій – етанової кислоти й етанолу. Тобто йдеться про реакцію гідролізу естеру з утворенням відповідних карбонової кислоти та одноатомного спирту.
Відповідь: B.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання формул найважливіших вуглеводів, уміння тлумачити рівняння реакцій за їхньою участю і застосовувати закон збереження маси, на основі якого складають хімічні рівняння.
Умову завдання задовольняє варіант відповіді B. Адже молекула сахарози, формула якої
Відповідь: B.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей аніліну, уміння порівнювати їх із хімічними властивостями бензену.
Анілін у воді виявляє слабші основні властивості, ніж амоніак. Це зумовлено впливом електронодефіцитного бензенового кільця на аміногрупу, унаслідок чого електронна густина на ній зменшується.
Бензен стійкий до дії брому, розчиненого у воді. Натомість анілін, симетрія розподілу електронної густини у фрагменті
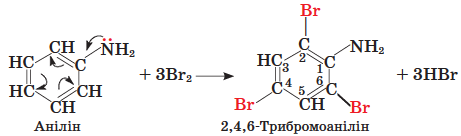
Відповідь: Б.
ТЕМА: Органічна хімія. Природні й синтетичні високомолекулярні речовини. Полімерні матеріали.
Завдання скеровано на перевірку розуміння суті реакції полімеризації алкенів як послідовного приєднання їхніх молекул за місцем подвійного зв’язку:
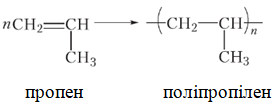
Відповідь: Б.
ТЕМА: Органічна хімія. Вуглеводні. Оксигеновмісні органічні сполуки. Альдегіди.
Завдання скеровано на перевірку знання хімічних властивостей алканів й альдегідів, уміння прогнозувати продукти реакцій за їхньою участю.
Унаслідок ізомеризації пентану (1) утворюється
Унаслідок дегідрування
Унаслідок часткового окиснення бутаналю (3) утворюється бутанова кислота (Д).
Відповідь: 1Г, 2А, 3Д.
ТЕМА: Загальна хімія. Речовина. Якісні реакції на катіони й аніони.
Завдання скеровано на перевірку вміння аналізувати реакції йонного обміну між електролітами у водних розчинах і прогнозувати зовнішні ефекти їхнього перебігу.
Умову завдання задовольняють натрій карбонат (В) в посудині
Унаслідок дії на натрій карбонат
Унаслідок дії на нітратну кислоту
Унаслідок дії на барій гідроксид
Узагальнено:
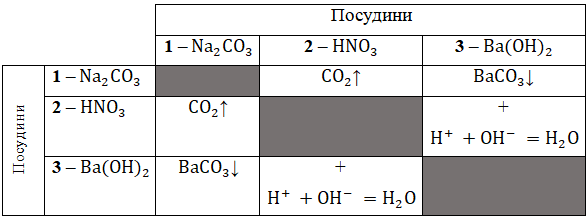
Відповідь: 1В, 2Г, 3Б.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку розуміння взаємозв’язку між кількістю (моль), масою й об’ємом речовини, умінням застосовувати закон Авогадро.
Дано:
Знайти:
Розв’язання
Відповідь: 5.
ТЕМА: Обчислення в хімії. Розв’язування задач за формулами речовин: комбіновані задачі.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й застосовувати розуміння взаємозв’язку між кількістю (моль), масою і молярною масою речовини.
Дано:
Знайти:
Розв’язання
Відповідь: 2.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння аналізувати криві розчинності солей у воді й обчислювати масу розчину за даними щодо його складників.
За кривою розчинності рубідій нітрату за
Маса розчину дорівнює сумі мас розчинника й розчиненої речовини й становить
Відповідь: 270.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Із хлоридною кислотою реагують і магній гідроксид, і магній карбонат, однак карбон(IV) оксид утворюється лише внаслідок реакції з магній карбонатом:
Відповідь: 10.
ТЕМА: Обчислення в хімії. Розв’язування задач із визначення формул сполук. Визначення формули речовини: комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Відповідь: 16.
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Відповідь: 20.




