Розділ: Мультитести
Тест: Тренувальний мультитест (3 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння тлумачити хімічні формули речовин.
| Хімічна формула | Молекулярна формула | Відношення кількостей атомів елементів |
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Хімічна формула.
Завдання скеровано на перевірку розуміння терміну «лужні елементи» й уміння використовувати періодичну систему хімічних елементів як довідкову.
Елементи першої групи періодичної системи (за винятком Гідрогену) називають лужними.
У всіх них зовнішня електронна оболонка
З-поміж наведених варіантів умову завдання задовольняють елементи Літій, Натрій, Калій, хімічні символи яких
Відповідь: Г.
ТЕМА: Будова атома. Періодична система хімічних елементів. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння використовувати періодичну систему хімічних елементів як довідкову для складання електронних формул атомів.
| Назва хімічного елемента | Електронна формула | Кількість електронів в атомі | |
| Карбон | |||
| Неон | |||
| Магній | |||
| Сульфур | |||
Відповідь: B.
ТЕМА: Хімічний зв’язок. Електронна формула молекули.
Завдання скеровано на перевірку розуміння суті ковалентного зв’язку й уміння аналізувати й тлумачити електронні формули.
В утворенні ковалентних зв’язків атома
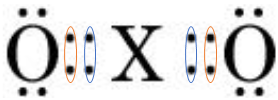
Відповідь: Б.
ТЕМА: Хімічний зв’язок. Електронна формула молекули.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад.
Ділильна лійка – скляна посудина циліндричної (як на рисунку) або конічної форми. Ділильну лійку використовують у лабораторії для розділення рідин, що не змішуються.
Рідина з більшою густиною утворює нижній шар, тому її можна випустити краном в іншу посудину (на рисунку – хімічний стакан).
Виноградний цукор (глюкоза), оцтова (етанова) кислота й кухонна сіль (натрій хлорид) утворюють з водою істинні розчини.
Умову завдання задовольняє лише суміш води й соняшникової олії. Адже ці рідини не змішуються, густина олії менша від густини води.
Після змішування і відстоювання вода й соняшникова олія розшаруються. Воду можна злити через кран у посудину (див. рисунок).
Відповідь: Г.
ТЕМА: Електролітична дисоціація кислот. Водневий показник рН.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння електролітичної дисоціації кислот.
Проаналізувавши природу кислот, про які йдеться в завданні, і рівняння їхньої електролітичної дисоціації, можна дійти висновку, що:
1) сульфатна й нітратна кислоти як сильні електроліти в розведених розчинах майже повністю дисоціюють на йони, кількість катіонів Гідрогену в їхніх розчинах із зазначеними кількістями кислот однакова, тому значення показника рН цих розчинів однакові;
2) етанова кислота – слабкий електроліт, навіть у розведених розчинах дисоціює лише частково, тобто кількість катіонів Гідрогену в її розчині менша за зазначену кількість кислоти. Що менша концентрація катіонів Гідрогену, то більше значення водневого показника рН розчину.
Відповідно значення водневого показника рН розчину етанової кислоти більше порівняно з розчинами сульфатної і нітратної кислот:
| Рівняння електролітичної дисоціації кислоти | Кількість речовини (моль) у водному розчині об’ємом 1 л | |
| кислота | катіони Гідрогену | |
Відповідь: Г.
ТЕМА: Закон збереження маси. Хімічні рівняння.
Завдання скеровано на перевірку вміння добирати коефіцієнти хімічного рівняння за законом збереження маси речовини в хімічних реакціях.
За законом збереження маси кількість атомів того чи того хімічного елемента в лівій і правій частинах хімічного рівняння та сама:
| Кількість атомів | |||||
| до реакції | після реакції | ||||
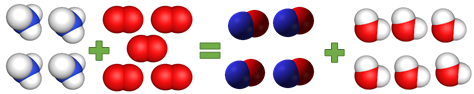
Відповідь: Г.
ТЕМА: Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, добирати коефіцієнти рівняння окисно-відновної реакції, визначати окисники й відновники.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Відповідно
Відповідь: B.
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Для розв’язання завдання потрібно застосувати загальний принцип зміщення хімічної рівноваги, сформульований Ле Шательє. Принцип полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, концентрації реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги, компенсувавши дію впливу.
У реакції, рівняння якої
для зміщення хімічної рівноваги в бік утворення метанолу потрібно підвищити тиск і знизити температуру. На протидію цьому рівновага в системі зміститься в бік утворення метанолу, адже синтез метанолу відбувається зі зменшенням об’єму і виділенням теплової енергії.
Відповідь: B.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів, розуміння, за яких умов метал реагує із сіллю, уміння прогнозувати можливість перебігу між металом і сіллю у водному розчині.
За довідковою таблицею «Ряд активності металів» (див. рисунок) можна визначити, що з-поміж наведених пар метал – сіль лише цинк реагуватиме з купрум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від міді:
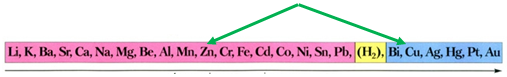
Ряд активності металів
Відповідь: A.
ТЕМА: Неорганічна хімія. Загальні відомості про неметалічні елементи та неметали. Властивості летких сполук неметалічних елементів із Гідрогеном.
Завдання скеровано на перевірку вміння застосовувати знання про властивості гідроген хлориду, амоніаку, метану.
Метан – малорозчинна у воді сполука, тому додавання кількох крапель водно-спиртового розчину фенолфталеїну в колбу з метаном не вплине на тиск цього газу всередині неї.
Натомість гідроген хлорид й амоніак добре розчиняються у воді, тому додавання навіть незначної її кількості зумовить зменшення кількості цих газів у колбах і приведе до зниження тиску в них.
Середовище водного розчину амоніаку лужне, тому фенолфталеїн набуде в ньому малинового забарвлення.
Середовище водного розчину гідроген хлориду кисле, тому фенолфталеїн у ньому залишиться безбарвним.
Тому правильним із-поміж наведених є лише перше твердження.
Відповідь: A.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати формули осно́вних оксидів і застосовувати знання про їхні хімічні властивості.
Умову завдання задовольняє осно́вний магній оксид:
Карбон(ІІ) оксид – несолетворний, силіцій(ІV) оксид – кислотний, тож із хлоридною кислотою не реагують.
Цинк оксид амфотерний, реагує і з хлоридною кислотою, і з натрій гідроксидом:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Амфотерні сполуки.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння розпізнавати формули амфотерних оксидів і гідроксидів.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості.
З кислотами алюміній оксид і цинк гідроксид реагують як основні, із лугами – як кислотні, тобто виявляють амфотерні властивості:
Відповідь: A.
ТЕМА: Загальна хімія. Електролітична дисоціація. Умови необоротності реакцій обміну між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати необоротність реакцій йонного обміну між електролітами у водних розчинах.
Умову завдання задовольняють барій сульфат й аргентум(І) хлорид:
Відповідь: B.
ТЕМА: Органічна хімія. Вуглеводні. Алкани.
Завдання скеровано на перевірку вміння визначати молекулярну формулу й назву алкану за загальною формулою вуглеводнів гомологічного ряду алканів і відносною молекулярною масою вуглеводню.
За загальною формулою алканів обчислюємо кількість атомів Карбону в молекулі шуканого алкану:
Назва алкану з п’ятьма атомами Карбону в молекулі – пентан.
Відповідь: A.
ТЕМА: Органічна хімія. Вуглеводні. Алкени.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів, зокрема реакцій приєднання за участю алкенів.
А Гідруванням етену добувають не етин, а етан.
Б Продуктом каталітичної гідратації етену є не етаналь, а етанол.
В Гідролізом кальцій ацетиленіду добувають не етен, а етин.
Г Етен реагує з гідроген хлоридом з утворенням 1-хлороетану:
Відповідь: Г.
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Арени.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів, зокрема алканів й аренів.
У молекулах вуглеводнів А, Б, Г є кратні зв’язки, за місцем яких можливе приєднання однієї чи кількох молекул брому в м'яких умовах, тому ці вуглеводні знебарвлюють бромну воду.
Вуглеводень B є ареном, тому бромну воду не знебарвлює.
Відповідь: B.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти. Феноли. Карбонові кислоти.
Завдання скеровано на перевірку вміння аналізувати склад і будову молекул органічних сполук, порівнювати їхні властивості.
За посиленням кислотних властивостей водних розчинів речовини розташовано в рядку етанол, фенол, етанова кислота.
Етанол не реагує з натрій гідроксидом.
Фенол виявляє дуже слабкі кислотні властивості й реагує з натрій гідроксидом:
Етанова кислота є слабкою карбоновою кислотою і реагує з натрій гідроксидом:
Відповідь: B.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й прогнозувати хімічні властивості речовин.
Речовина
Речовина
Умову завдання задовольняє метанова кислота, у молекулі якої (див. рисунок) є і карбоксильна, і карбонільна групи.
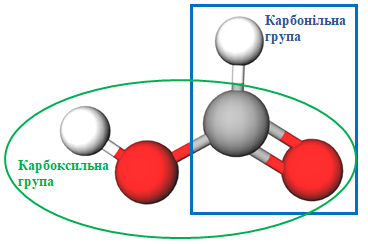
Відповідь: Б.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Жири.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й прогнозувати хімічні властивості речовин.
З-поміж речовин, назви яких наведено в умові завдання, ненасиченою сполукою, здатною реагувати з йодом, є триолеат. Це жир, утворений ненасиченою олеїновою кислотою. Решта сполук – насичені, їхнє йодне число дорівнює нулю.
Відповідь: Б.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти.
Завдання скеровано на перевірку вміння аналізувати хімічні формули амінокислот і прогнозувати склад трипептидів, які вони можуть утворити.
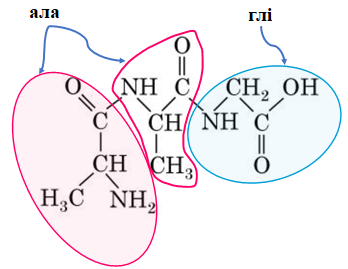
Відповідь: B.
ТЕМА: Органічна хімія. Природні й синтетичні високомолекулярні речовини, полімерні матеріали на їхній основі.
Завдання скеровано на перевірку вміння аналізувати хімічні формули мономерів і прогнозувати склад полімерів, які вони можуть утворити.
Полівінілхлорид є продуктом полімеризації вінілхлориду:
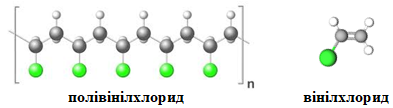
Відповідь: A.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Обчислення маси речовини за її кількістю (моль) і молярною масою.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
Знайти:
Розв’язання
Відповідь: 400.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Об’ємні відношення газів у хімічних реакціях.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Розв’язання
Відповідь: 5.
ТЕМА: Обчислення в хімії. Обчислення маси розчинника за відомими масою і масовою часткою в розчині розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу складника розчину.
Дано:
Знайти:
Розв’язання
Відповідь: 340.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Визначення формули речовини.
Завдання скеровано на перевірку вміння визначати формулу речовини.
Дано:
Знайти:
Розв’язання
Відповідь: 8.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Відповідь: 29.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Розв’язання
Відповідь: 65.
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами та типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участю органічних сполук.
1. Перетворення бутану на ізобутан – реакція ізомеризації (В).
2. Бромування ізобутану – реакція заміщення (Д).
3. Перетворення 2-бромо-2-метилпропану на 2-метилпроп-1-ен – реакція відщеплення (Б).
Відповідь: 1В, 2Д, 3Б.
ТЕМА: Загальна хімія. Електролітична дисоціація кислот, лугів, солей у водних розчинах. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати тип середовища водних розчинів електролітів.
1. Кисле середовище у водних розчинах хлоридної кислоти та алюміній хлориду – солі сильної кислоти та слабкої основи (А).
2. Нейтральне середовище у водних розчинах натрій хлориду та натрій сульфату – солей сильної основи й сильних кислот (Г).
3. Лужне середовище у водних розчинах натрій гідроксиду й натрій сульфіду – солі сильної основи та слабкої кислоти (В).
Відповідь: 1А, 2Г, 3В.




