Розділ: Мультитести
Тест: Тренувальний мультитест (6 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – умовний запис її якісного й кількісного складу за допомогою хімічних символів й індексів.
Молекулярна формула фенолу
У ній записано символи трьох хімічних елементів – Карбону
Праві підрядкові індекси біля хімічних символів у формулі показують кількість атомів відповідного хімічного елемента. Тобто в молекулі фенолу шість атомів Карбону, шість атомів Гідрогену й атом Оксигену – у сумі тринадцять атомів.
Відповідь: Б.
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою енергетичних рівнів їхніх атомів.
В атомах d-елементів заповнюється електронами зовнішній d-підрівень (рис. 1).
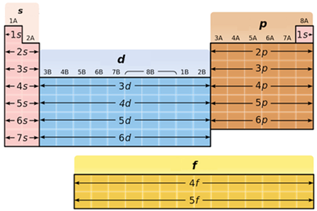
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Відповідь: Б.
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Згідно з наведеною в завданні схемою на зовнішньому енергетичному рівні атома елемента
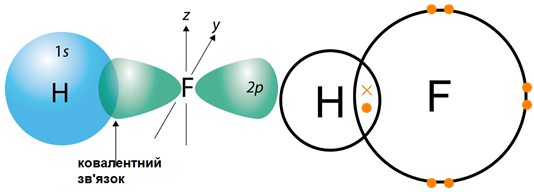
Рис. 1. Утворення ковалентного полярного зв’язку в молекулі гідроген флуориду
Відповідь: Б.
ТЕМА: Суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад і розпізнавати зображення способів розділення сумішей.
Перегонка (дистиляція) – очищення рідин від розчинних у ній нелетких сумішей або розділення сумішей рідин на фракції, які відрізняються складом, способом випарювання і подальшої конденсації утвореної пари.
Відповідь: B.
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками калій гідрогенкарбонату є однозарядні катіони Калію та Гідрогену, двозарядні карбонат-аніон:
Згідно з принципом електронейтральності речовини сума зарядів складників дорівнює нулю.
Відповідь: Г.
ТЕМА: Органічна хімія. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей амінів і вміння складати реакції повного окиснення цих сполук.
Продуктами окиснення етанаміну є карбон(IV) оксид, вода й азот:
Відповідь: В.
ТЕМА: Неорганічна хімія. Калій. Водень. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей водню і калію та вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Калію менша за електронегативність Гідрогену (рис. 1).
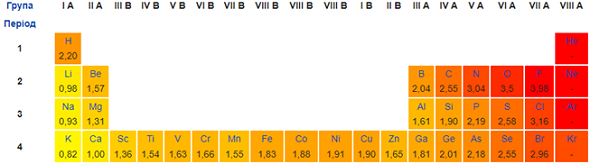
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тож калій виявлятиме відновні властивості в реакції з воднем:
Відповідь: B.
ТЕМА: Хімічна реакція. Хімічна рівновага. Принцип Ле Шательє.
Завдання скеровано на перевірку знання понять оборотна реакція, хімічна рівновага й розуміння впливу різних чинників на хімічну рівновагу.
Хімічна рівновага – стан, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічна рівновага є динамічною. На зміщення рівноваги впливає концентрація реагентів і продуктів реакції, тиск і температура. Вплив цих чинників описує принцип Ле Шательє: якщо змінити одну з умов, за якої система перебуває в рівновазі (концентрацію, тиск або температуру), то рівновага зміщується в бік тієї реакції, яка протидіє цій зміні. Відповідно до принципу Ле Шательє, підвищення тиску зміщує рівновагу в бік менших об’ємів (тиск знижується), а зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується); підвищення температури зміщує рівновагу в бік ендотермічної реакції (температура знижується), а зниження температури зміщує рівновагу в бік екзотермічної реакції (температура підвищується); збільшення концентрації реагентів зміщує рівновагу в бік продуктів реакції.
У завданні необхідно визначити, як змінити тиск і температуру для зміщення рівноваги в бік утворення метанолу (пряма реакція).
Проаналізуймо рівняння оборотної реакції, наведеної в завданні. Пряма реакція (утворення метанолу) супроводжується зменшенням тиску (із трьох об’ємів газів утворюється один, об’єм зменшується) і підвищенням температури (екзотермічна реакція,
Відповідь: B.
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза.
Продуктом реакції заліза з хлором є ферум(ІІІ) хлорид (А).
Продуктом реакції заліза з хлоридною кислотою є ферум(ІІ) хлорид (Б).
Залізо як менш активний метал не може витіснити активніші метали натрій і кальцій із їхніх солей у водних розчинах.
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
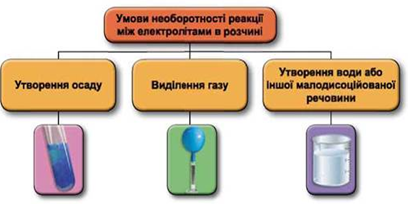
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою аргентум(І) нітрат і калій хлорид, одним із продуктів реакції є осад аргентум(І) хлориду:
Відповідь: Г.
ТЕМА: Неорганічна хімія. Металічні елементи. Сполуки Кальцію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук металічних елементів.
Негашене вапно – тривіальна назва кальцій оксиду
Відповідь: A.
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(ІV) оксиду.
Карбон(ІV) оксид добувають дією кислот, сильніших за карбонатну, на її солі:
Відповідь: Г.
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей алканів.
Реакція між метаном і хлором – реакція заміщення:
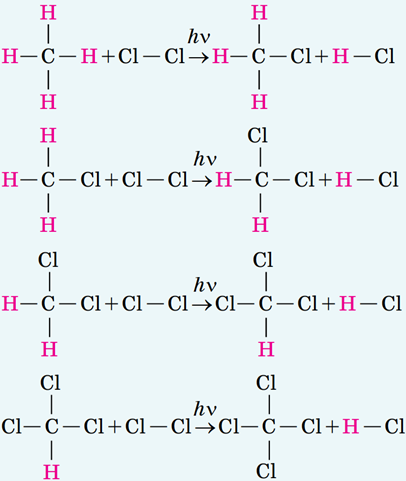
Відповідь: B.
ТЕМА: Органічні речовини. Гомологи.
Завдання скеровано на перевірку вміння визначати належність вуглеводню до певного гомологічного ряду.
Бут-1-ен належить до гомологічного ряду алкенів. Загальна формула вуглеводнів цього ряду –
Відповідь: Б.
ТЕМА: Органічні речовини. Ароматичні вуглеводні. Бензен.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі бензену.
Рівняння реакції бензену з воднем, продуктом якої є циклогексан:
Відповідь: B.
ТЕМА: Органічна хімія. Багатоатомні спирти.
Завдання скеровано на перевірку знання властивостей гліцеролу.
Гліцерол – насичений триатомний спирт. У молекулі гліцеролу три гідроксильні групи, тому він вступає в реакцію естерифікації. Гліцерол взаємодіє зі свіжоосадженим купрум(ІІ) гідроксидом з утворенням яскраво-синього прозорого розчину.
Відповідь: B.
ТЕМА: Загальна хімія. Основні хімічні поняття. Оксигеновмісні органічні сполуки. Етери.
Завдання перевіряє знання якісного й кількісного складу речовин, уміння аналізувати структурні формули й визначати належність речовини до класу естерів.
Для виконання завдання необхідно проаналізувати структурні формули. І 1, і 2 формули містять Карбон, Гідроген і Оксиген, тому якісний склад однаковий. Для визначення кількісного складу необхідно порахувати число атомів елементів у кожній формулі. Молекулярні формули і 1, і 2 речовини
Аналізуємо друге твердження. Естери – це речовини, які мають таку загальну формулу
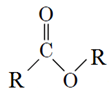
Цій загальній формулі відповідає лише структурна формула 1 речовини, тому ІІ твердження неправильне.
Отже, правильна відповідь – А.
Відповідь: А.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери. Жири. Класифікація реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі жирів.
Рідкі жири перетворюють на тверді гідруванням (приєднанням водню):
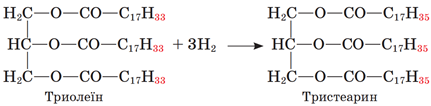
Відповідь: B.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей амінів.
Аміни – органічні основи. Вони реагують з кислотами з утворенням солей, метанамін, наприклад, взаємодіє з гідроген хлоридом:
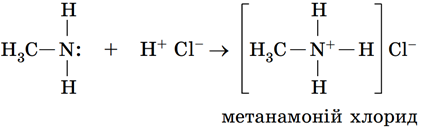
Відповідь: В.
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку знання складу найпоширеніших полімерів.
У завданні наведено формулу продукту полімеризації пропену – поліпропілен.
Відповідь: Г.
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати реакції різних типів за участі органічних сполук.
1. Від молекули пропану відщеплюється молекула водню й утворюється молекула пропену, це реакція дегідрування.
2. До молекули пропену приєднується молекула води, це реакція гідратації.
3. Унаслідок реакції естерифікації зі спирту й карбонової кислоти утворюється естер.
Відповідь: 1В, 2Г, 3А.
ТЕМА: Загальна хімія. Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння ідентифікувати речовини за допомогою якісних реакцій на йони в їхньому складі.
Для правильного розв’язання завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
1 |
Під дією хлоридної кислоти на калій силікат (В) утвориться осад силікатної кислоти. Унаслідок реакції калій силікату з барій хлоридом у розчині утвориться осад барій силікату. |
2 |
Магній сульфат (А) у розчині не реагує ні з хлоридною кислотою, ні з барій хлоридом, усі ці речовини перебувають у розчині у формі йонів. |
3 |
Натрій карбонат (Б) реагує з хлоридною кислотою з виділенням газу. Унаслідок взаємодії з барій хлоридом у розчині утворюється осад барій карбонату. |
Відповідь: 1В, 2А, 3Б.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
Знайти:
Відповідь: 180.
ТЕМА: Обчислення в хімії. Обчислення за рівнянням реакції об’єму газуватого реагенту за масою іншого реагенту.
Завдання скеровано на перевірку вміння обчислювати за рівнянням реакції об’єм газуватого реагенту за масою іншого реагенту.
Дано:
Знайти:
Відповідь: 3080.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 4.
ТЕМА: Обчислення в хімії. Розв’язування комбінованих задач.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Унаслідок гідрування залишки ненасиченої олеїнової кислоти в молекулі жиру перетворюються на залишки насиченої стеаринової. Кислотний залишок олеїнової кислоти приєднує молекулу водню. Тобто на гідрування залишків кількістю речовини 1 моль буде витрачено водень кількістю речовини 1 моль або об’ємом 22,4 л (н. у.). Тобто якщо на гідрування жиру кількістю речовини 0,1 моль витрачено водень об’ємом 4,48 л (н. у.), то в молекулі жиру два залишки олеїнової кислоти. Відповідно із жиру кількістю речовини 2 моль можна добути олеїнову кислоту кількістю речовини 4 моль.
Відповідь: 4.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за хімічним рівнянням, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
Етанова кислота в надлишку.
Відповідь: 37.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу реагенту за об’ємом газуватого продукту реакції.
Дано:
Знайти:
Відповідь: 450.




