Розділ: Мультитести
Тест: Тренувальний мультитест (7 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Хімічні формули.
Завдання скеровано на перевірку вміння інтерпретувати хімічні формули речовин.
У хімічній формулі кількість хімічних елементів визначають за кількістю їхніх символів.
| Формула речовини | Кількість хімічних елементів (видів атомів), якими утворена речовина |
| 1 ( |
|
| 2 ( |
|
| 3 ( |
|
| 2 ( |
Відповідь: B.
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи металічних елементів | ||
| A | ||
| Б | ||
| B | – | |
| Г | ||
Відповідь: Б.
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
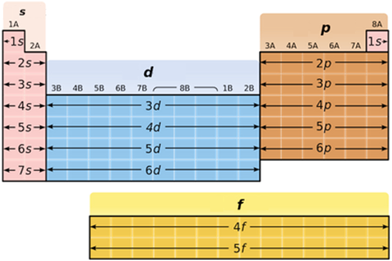
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
| n = | 2, | 3, | 4 |
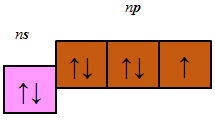
Відповідь: Г.
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Протонне число 9 в елемента Флуору, 11 – у Натрію, тобто в завданні йдеться про натрій флуорид.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони (рис. 2).
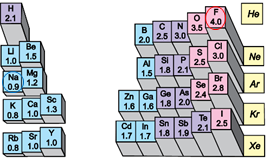
Рис. 1. Відносна електронегативність атомів хімічних елементів
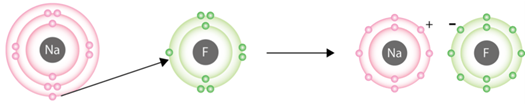
Рис. 2. Утворення йонів Натрію і Флуору
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Йонні кристали утворюють більшість солей неорганічних і органічних кислот, луги, основні й амфотерні оксиди й гідроксиди.
У кристалічних ґратках натрій флуориду містяться катіони Натрію і флуорид-аніони, тобто кристалічні ґратки в натрій флуориді йонні.
Відповідь: B.
ТЕМА: Загальна хімія. Суміші.
Завдання скеровано на перевірку вміння класифікувати суміші, розпізнавати емульсії.
Емульсії – дисперсні системи, які утворені рідинами, що не змішуються. Тобто емульсії належать до неоднорідних сумішей.
У молоці краплі молочного жиру розподілені у водному середовищі. Тож молоко є емульсією. Про це свідчить і розшарування молока: із часом крапельки жиру спливають угору й утворюють на поверхні молока суцільний шар.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах.
Завдання скеровано на перевірку знання властивостей речовин, уміння прогнозувати їхню здатність реагувати з водою, забарвлення індикатора в розчині.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Середовище водного розчину амоніаку лужне внаслідок перебігу реакції за схемою
Гідроксид-аніони у водному розчині амоніаку зумовлюють лужну реакцію середовища в ньому.
Натрій хлорид – сіль сильної основи й сильної кислоти – не зазнає гідролізу, тож середовище його водного розчину нейтральне.
Водний розчин гідроген сульфіду – слабка сульфідна кислота.
Сульфур(IV) оксид – кислотний, унаслідок його змішування з водою утворюється слабка сульфітна кислота.
Відповідь: A.
ТЕМА: Органічна хімія. Повне окиснення органічних сполук.
Завдання скеровано на перевірку розуміння суті повного окиснення органічних речовин, уміння визначати їхній склад за продуктами повного окиснення на основі закону збереження маси речовин під час хімічних реакцій.
У правій частині хімічного рівняння дев’ять атомів Оксигену – шість у трьох молекулах карбон(ІV) оксиду й три – у трьох молекулах води.
У лівій частині хімічного рівняння вісім атомів Оксигену у чотирьох молекулах кисню.
Тобто в молекулі речовини X один атом Оксигену. Цю умову задовольняє речовина B.
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, умінь визначати ступені окиснення атомів хімічних елементів за формулами речовин, окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У процесі відновлення Нітрогену беруть участь вісім електронів.
Відповідь: Г.
ТЕМА: Хімічна реакція. Хімічна рівновага. Принцип Ле Шательє.
Завдання скеровано на перевірку знання понять оборотна реакція, хімічна рівновага й розуміння впливу різних чинників на хімічну рівновагу.
Оборотна реакція – це реакція, яка відбувається в прямому і зворотному напрямках. Хімічна рівновага – стан, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічна рівновага є динамічною. На зміщення рівноваги впливає концентрація реагентів і продуктів реакції, тиск і температура. Вплив цих чинників описує принцип Ле Шательє: якщо змінити одну з умов, за якої система перебуває в рівновазі (концентрацію, тиск або температуру), то рівновага зміщується в бік тієї реакції, яка протидіє цій зміні. Відповідно до принципу Ле Шательє, підвищення тиску зміщує рівновагу в бік менших об’ємів (тиск знижується), а зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується); підвищення температури зміщує рівновагу в бік ендотермічної реакції (температура знижується), а зниження температури зміщує рівновагу в бік екзотермічної реакції (температура підвищується); збільшення концентрації реагентів зміщує рівновагу в бік продуктів реакції.
За умовою завдання необхідно проаналізувати рівняння оборотних реакцій і вказати рівняння реакції, у якій зниження тиску зумовить зміщення хімічної рівноваги праворуч, тобто в бік прямої реакції. Відповідно до принципу Ле Шательє, зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується).
Отже, необхідно визначити, у якій оборотній реакції пряма реакція відбувається зі збільшенням об’ємів.
Лише в оборотній реакції
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі заліза.
Ферум(ІІІ) хлорид є продуктом реакції заліза з хлором:
Для перетворення ферум(ІІІ) хлориду на ферум(ІІІ) гідроксид потрібно на сіль подіяти лугом у водному розчині:
Відповідь: Б.
ТЕМА: Неорганічні речовини. Карбонатна кислота та її солі.
Завдання скеровано на перевірку знання хімічних властивостей карбонатів як солей слабкої та нестійкої карбонатної кислоти.
Солі карбонатної кислоти реагують із кислотами. Характерною ознакою перебігу таких реакцій є виділення вуглекислого газу. Столовий оцет – водний розчин етанової кислоти. Тож між нею і карбонатами Магнію і Кальцію відбуваються такі реакції:
Відповідь: A.
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(IV) оксиду.
Карбон(IV) оксид добувають дією хлоридної кислоти на мармур, головним складником якого є кальцій карбонат:
Відповідь: Б.
ТЕМА: Неорганічна хімія. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі неорганічних речовин різних класів.
З-поміж речовин, назви яких наведено в завданні, потрібно вибрати ту, яка реагує з карбон(IV) оксидом і не реагує з киснем. Цим умовам відповідає натрій гідроксид:
Відповідь: B.
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між сполуками Кальцію.
Схемі перетворень відповідає кальцій гідроксид:
Відповідь: A.
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості оксидів. Алкани. Хімічні властивості алканів.
Завдання перевіряє знання хімічних властивостей кислотних оксидів і алканів.
Для виконання завдання необхідно вміти порівнювати дію наведених реагентів на пропан і вуглекислий газ. Пропан не буде взаємодіяти з жодним з наведених реагентів, а карбон(IV) оксид у водному розчині буде реагувати лише з вапняною водою з утворенням осаду:
Відповідь: Б.
ТЕМА: Органічна хімія. Алкени й алкіни.
Завдання скеровано на перевірку знання властивостей алкенів й алкінів, уміння порівнювати їх.
1 етен й етин є малорозчинними речовинами
2 продуктом гідратації етену є етанол, етину – етаналь
3 з амоніачним розчином аргентум(І) оксиду реагує етин і не реагує етен
4 з бромною водою реагують як етен, так й етин
5 етен й етин здатні до полімеризації, а не поліконденсації
Відповідь: Б.
ТЕМА: Органічна хімія. Арени. Бензен.
Завдання скеровано на перевірку знання властивостей бензену й уміння встановлювати генетичні зв’язки між класами органічних сполук.
Бензен не можна добути гідруванням циклогексану, навпаки – гідрування бензену можна добути циклогексан:
Тримеризація етину – один зі способів добування бензену:
Відповідь: Б.
ТЕМА: Органічна хімія. Систематична номенклатура органічних сполук.
Завдання скеровано на перевірку вміння розпізнавати органічні сполуки різних класів і називати їх за систематичною номенклатурою.
У завданні наведено структурну формулу насиченого одноатомного спирту. Називати спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
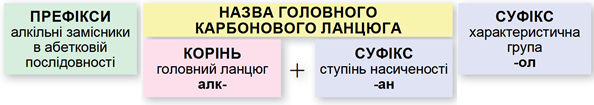
Рис. 1. Алгоритм побудови назв спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то його нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоби замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
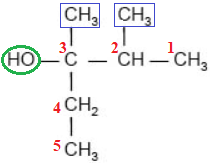
Назва спирту – 2,3-диметилпентан-3-ол.
Відповідь: B.
ТЕМА: Органічна хімія. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації і гідролізу естеру, уміння аналізувати склад і будову речовини за її хімічною формулою.
Речовини, структурні формули яких наведено в умові завдання, належать до естерів і є продуктами реакції між відповідними спиртами й карбоновими кислотами. Загальну формулу естерів наведено на рисунку 1.
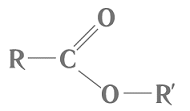
Рис. 1. Загальна формула естерів
Структурні формули етанової і пропанової кислот, метанолу й етанолу зображено на рисунку 2.
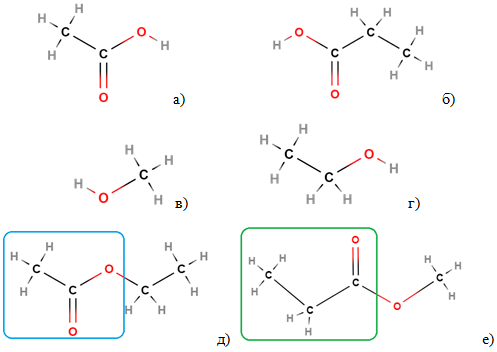
Рис. 2. Структурні формули етанової (а) і пропанової кислот (б), метанолу (в) й етанолу (г), етилетаноату (д) і метилпропаноату (е)
Вочевидь єдиним правильним твердженням із-поміж наведених є те, що етанова кислота – продукт кислотного гідролізу лише речовини 1 – етилетаноату.
Відповідь: A.
ТЕМА: Органічна хімія. Естери. Жири.
Завдання скеровано на перевірку знання хімічного складу й властивостей естерів і жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот. Естери вищих одноосновних карбонових кислот і вищих одноатомних спиртів, про які йдеться в завданні, є основою природних восків. Тобто це твердження неправильне.
Одним із продуктів кислотного гідролізу етилметаноату є метанова кислота, яку можна окиснити амоніачним розчином аргентум(І) оксиду:
Відповідь: Б.
ТЕМА: Органічна хімія. Амінокислоти.
Завдання скеровано на перевірку знання хімічних властивостей амінокислот, уміння аналізувати хімічний склад пептидів за їхніми структурними формулами, виявляти пептидні зв’язки.
Пептидний зв’язок – це амідний зв’язок у молекулах білків, що утворився внаслідок взаємодії карбоксильної групи однієї амінокислоти з амiногрупою іншої (з вилученням води),
За умовою завдання в утворенні пептидних зв’язків беруть участь як карбоксильна, так й аміногрупа молекули валіну. Тобто її фрагмент має бути в центрі трипептиду (рис. 1).
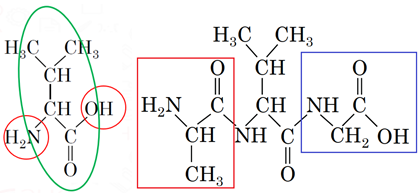
Рис. 1. Характеристичні групи в молекулі валіну, які беруть участь в утворенні пептидних зв’язків
Аміногрупа гліцину прореагує з карбоксильною групою валіну, а карбоксильна група аланіну – з аміногрупою валіну.
Цим умовам задовольняє варіант відповіді В.
Відповідь: B.
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки. Природні й синтетичні волокна.
Завдання скеровано на перевірку знання видів волокон.
Волокно природного походження – вовна, головним складником якого є білки. Капрон – синтетичне волокно.
Відповідь: A.
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
ТЕМА: Органічна хімія. Вуглеводні.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів.
У завданні необхідно доповнити кожне речення так, щоб утворилося правильне твердження.
Проаналізуємо речення і встановимо відповідність.
1. Ізомери – речовини, які мають однаковий склад, але різну будову, а тому різні властивості, тобто «Продуктом ізомеризації бутану є речовина Б».
2. З бромною водою можуть реагувати речовини, які мають кратний зв'язок (подвійний чи потрійний), тож «З бромною водою реагує як речовина В, так і речовина Г».
3. Масова частка елементів у різних речовин може бути однаковою, якщо якісний склад однаковий, а індекси в хімічній формулі, що відображають кількісний склад, кратні тому самому числу. Тому «Масова частка Карбону в речовині Г (
Відповідь: 1Б, 2Г, 3Д.
ТЕМА: Обчислення в хімії. Кількість речовини. Моль. Молярна маса.
Завдання перевіряє вміння обчислювати масу речовини за певною кількістю цієї речовини.
Для виконання завдання необхідно знати формулу для розрахунку маси речовини.
Відповідь: 490.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 252.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Відповідь: 26.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єми газуватих продуктів і реагентів за хімічними рівняннями.
Дано:
Знайти:
Відповідь: 36.
ТЕМА: Обчислення в хімії. Комбіновані задачі.
Завдання скеровано на перевірку вміння застосовувати закон об’ємних відношень газів під час розв’язування комбінованих задач.
Дано:
Знайти:
Відповідь: 80.
ТЕМА: Обчислення в хімії. Об’ємні відношення газів у хімічних реакціях.
Завдання скеровано на перевірку вміння застосовувати закон об’ємних відношень газів під час розв’язування задач.
Дано:
Знайти:
Відповідь: 15.




