Розділ: Мультитести
Тест: Тренувальний мультитест (8 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – умовний запис її якісного й кількісного складу за допомогою хімічних символів й індексів.
Молекулярна формула метилметаноату
У ній записано символи трьох хімічних елементів – Карбону
Праві підрядкові індекси біля хімічних символів у формулі показують кількість атомів відповідного хімічного елемента. Тобто в молекулі метилметаноату два атоми Карбону, чотири атоми Гідрогену й два атоми Оксигену – у сумі вісім атомів.
Відповідь: A.
ТЕМА: Метали.
Завдання скеровано на перевірку вміння порівнювати активність металів.
Для порівняння активності металів потрібно використати їхній ряд активності (рис. 1).

Рис. 1. Ряд активності металів
Мідь у цьому ряду розташована правіше за інші метали, про які йдеться в завданні.
Відповідь: Б.
ТЕМА: Періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
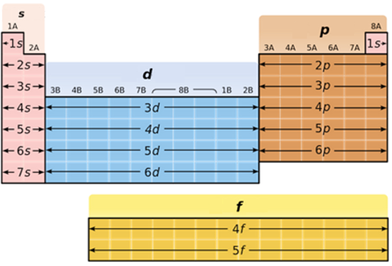
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Алюміній належить до p-елементів, будова зовнішнього енергетичного рівня його атома така:
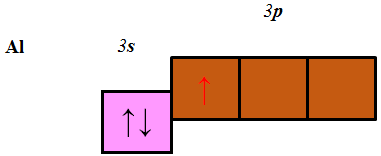
Відповідь: Б.
ТЕМА: Загальна хімія. Валентність. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати валентність хімічних елементів за формулою речовини чи йона.
Валентність – здатність атомів вступати в хімічний зв’язок лише з певною кількістю інших атомів, що здійснюється в результаті взаємодії електронів верхніх електронних оболонок.
Кількісною мірою валентності атома є кількість атомів елемента, валентність якого вважають відомою, що їх здатний приєднати даний атом.
Зазвичай валентність атома визначають за максимальною кількістю одновалентних атомів (історично це атоми
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона
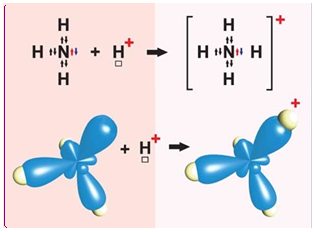
Рис. 1. Утворення катіона амонію
Відповідь: B.
ТЕМА: Дисперсні системи.
Завдання скеровано на перевірку вміння розпізнавати дисперсні системи, що трапляються в повсякденному житті.
Дим – природне явище, стійка дисперсна система з дрібних твердих частинок, завислих у повітрі або в інших газах. Дим — типовий аерозоль із розмірами частинок від
Відповідь: Б.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Електролітична дисоціація лугів.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування продуктів електролітичної дисоціації лугів.
Унаслідок дисоціації у водному розчині натрій гідроксиду утворюються катіони Натрію і гідроксид-аніони:
Відповідь: Б.
ТЕМА: Загальна хімія. Закон збереження маси. Хімічні рівняння.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси для складання хімічних рівнянь.
Під час хімічних реакцій кількості атомів хімічних елементів не змінюються, тому маса реагентів дорівнює масі продуктів реакції. В умові завдання наведено схему перетворення, що спрощено відображає хімізм виробництва скла стопленням карбонатів Натрію і Кальцію з кварцовим піском. Газуватим продуктом цієї реакції є карбон(ІV) оксид:
Відповідь: Б.
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів, розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A
Б
B
Г
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
1 Зменшення концентрації газуватого метанолу в суміші зумовить зміщення рівноваги в праву частину рівняння.
2 Зміщенню рівноваги в бік утворення карбон(ІІ) оксиду сприятиме зменшення концентрації водню. Оскільки система намагатиметься компенсувати це зменшення, то рівновага зміститься в бік утворення водню і, відповідно, карбон(ІІ) оксиду.
3 Ця реакція екзотермічна, тому підвищення температури приведе до зсування хімічної рівноваги в бік розкладання метанолу на водень і карбон(ІІ) оксид.
4 Підвищення тиску зсуватиме хімічну рівновагу вправо, бо внаслідок прямої реакції об’єм газу зменшується, тож зменшується і тиск, який він справляє:
Відповідь: B.
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння використовувати ряд активності металів для прогнозування можливості перебігу реакції між металом і сіллю в її розчині.

Рис. 1. Ряд активності металів
Що лівіше розташований метал в ряду активності, то більша його активність і відновні властивості.
Із-поміж металів, про які йдеться в завданні, активнішим за свинець є залізо, саме воно витіснятиме свинець із плюмбум(ІІ) нітрату в його водному розчині:
Відповідь: B.
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
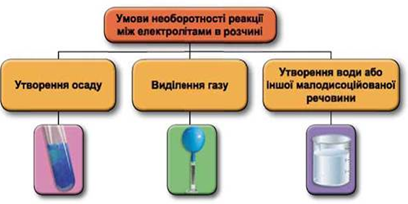
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів натрій карбонату та барій хлориду утвориться осад барій карбонату:
Відповідь: Б.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
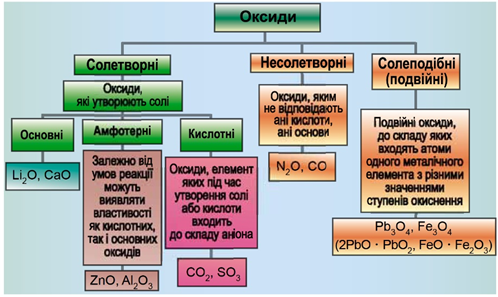
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості. Цинк оксид й алюміній оксид – амфотерні.
Магній оксид – основний, алюміній оксид – амфотерний, хлор(VІІ) оксид – кислотний.
Відповідь: Г.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
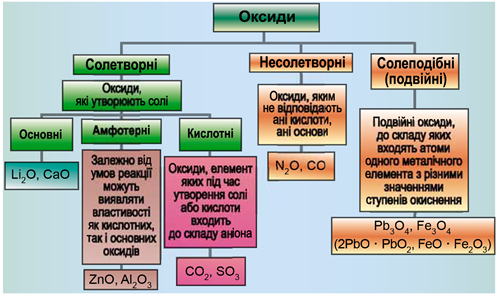
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
З-поміж оксидів, формули яких наведено в завданні, лише основний магній оксид реагує з хлоридною кислотою і не реагує з натрій гідроксидом.
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Генетичні зв’язки між речовинами, що належать до різних класів неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати реагенти й продукти реакцій за участі неорганічних речовин.
Умові завдання відповідає купрум(ІІ) хлорид:
Відповідь: B.
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку розуміння суті гомології.
Речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Загальна формула алканів
До алкaнів належить вуглеводень, формула якого
Відповідь: A.
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії. Способи добування алкенів.
Завдання скеровано на перевірку знання способів добування алкенів і вміння класифікувати хімічні реакції за участі оксигеновмісних органічних сполук.
Етен є продуктом внутрішньомолекулярної дегідратації етанолу:
Відповідь: A.
ТЕМА: Органічна хімія. Алкани. Циклоалкани. Бензен.
Завдання скеровано на перевірку знань про хімічний склад і властивості, будову молекул гексану, циклогексану, бензену (рис. 1).
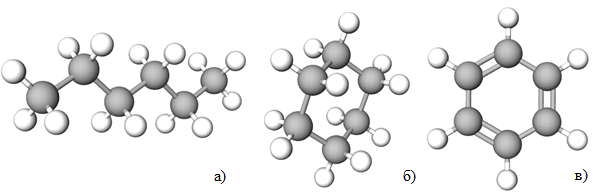
Рис. 1. Моделі молекул гексану (а), циклогексану (б), бензену (в)
З-поміж наведених в умові завдання правильними є такі твердження:
Бензен належить до вуглеводнів циклічної будови (I).
Каталітичним дегідруванням циклогексану можна добути бензен (ІІІ).
Гексан вступає в реакцію ізомеризації (VІ).
Відповідь: Б.
ТЕМА: Органічні речовини. Генетичні зв’язки між класами органічних речовин.
Завдання скеровано на перевірку вміння визначати реагенти й прогнозувати продукти реакцій за участі органічних речовин.
Речовина
Відповідь: Б.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння аналізувати склад і будову молекул органічних сполук за їхніми структурними формулами.
A |
і в молекулі речовини 1, і в молекулі речовини 2 є гідроксильна група |
Б |
речовина 1 є фенолом, а речовина 2 – ароматичним спиртом |
B |
фенол 1, так само як і ароматична карбонова кислота 3 реагують із натрій гідроксидом |
Г |
ароматична карбонова кислота 3 є продуктом гідролізу естеру 4, молекула якого утворена залишками молекул цієї кислоти й метанолу |
Відповідь: Б.
ТЕМА: Органічна хімія. Жири.
Завдання скеровано на перевірку знання хімічних властивостей жирів.
У молекулах рідких жирів на відміну від твердих є подвійні карбон-карбонові зв’язки. За місцем подвійного зв’язку можлива реакція приєднання, зокрема Гідрогену, – гідрування. У результаті цієї реакції ненасичена сполука перетворюється на насичену, а рідкий жир – на твердий:
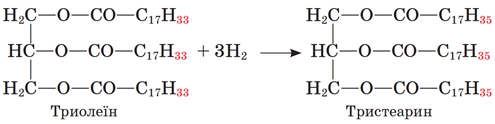
Відповідь: A.
ТЕМА: Органічна хімія. Хімічні властивості алканів, алкенів, фенолу, аніліну.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості органічних сполук для прогнозування можливості перебігу реакцій за їхньої участі.
Пропен, фенол й анілін знебарвлюють бромну воду:
Бутан – насичений вуглеводень, із бромною водою не реагує.
Відповідь: Б.
ТЕМА: Органічні речовини. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку вміння прогнозувати склад продукту полімеризації за хімічною формулою мономера.
Мономер – низькомолекулярна речовина, продуктом полімеризації якої є високомолекулярна речовина – полімер.
Відповідь: Б.
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії та вміння визначати формули речовин-ізомерів.
Ізомерія – явище iснування ізомерів – сполук, однакових за хімічним складом i молекулярною масою (тобто з тією самою молекулярною формулою), але рiзних за будовою.
Порівнявши кількості атомів Карбону й Гідрогену у формулах, наведених в завданні, можна визначити структурні ізомери речовин, назви яких зазначено в умові.
Відповідь: 1В, 2Г, 3Д.
ТЕМА: Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин.
Розбавлена хлоридна кислота не реагує з міддю, а концентрована нітратна – реагує.
Натрій сульфат на відміну від натрій нітрату реагує з барій хлоридом.
Унаслідок реакції з лугом алюміній хлориду і магній хлориду у водному розчині утворюються осади відповідних гідроксидів. Однак осад алюміній гідроксиду, на відміну від осаду магній гідроксиду, розчиняється в надлишку лугу.
Відповідь: 1А, 2Б, 3Д.
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки.
Завдання перевіряє знання формули для обчислення маси речовини за її кількістю і вміння застосувати форму для розрахунку; уміння обчислювати молярну масу речовини.
Для розв’язання завдання необхідно застосувати формулу для розрахунку маси речовини за її кількістю.
Відповідь: 210.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 60.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 45.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за хімічним рівнянням і відомим об’ємом іншого газу – продукту чи реагенту.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 27.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
За рівнянням реакції
За рівнянням реакції
Відповідь: 20.
ТЕМА: Обчислення в хімії. Виведення формули речовини за продуктами згоряння.
Завдання перевіряє вміння виводити формулу речовини за продуктами згоряння.
Для виконання завдання необхідно вміти записувати загальне рівняння реакції горіння алкену.
Відповідь: 56.




