Розділ: Мультитести
Тест: Тренувальний мультитест (9 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Хімічний елемент. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б два хімічні елементи (
В три хімічні елементи (
Г два хімічні елементи (
Відповідь: A.
Тема: Класифікація хімічних елементів.
Завдання скеровано на перевірку розуміння ознак класифікації хімічних елементів на металічні й неметалічні, знання місцеположення металічних і неметалічних елементів у періодичній системі.
Місцеположення металічних елементів у періодичній системі відображено на рисунку 1.
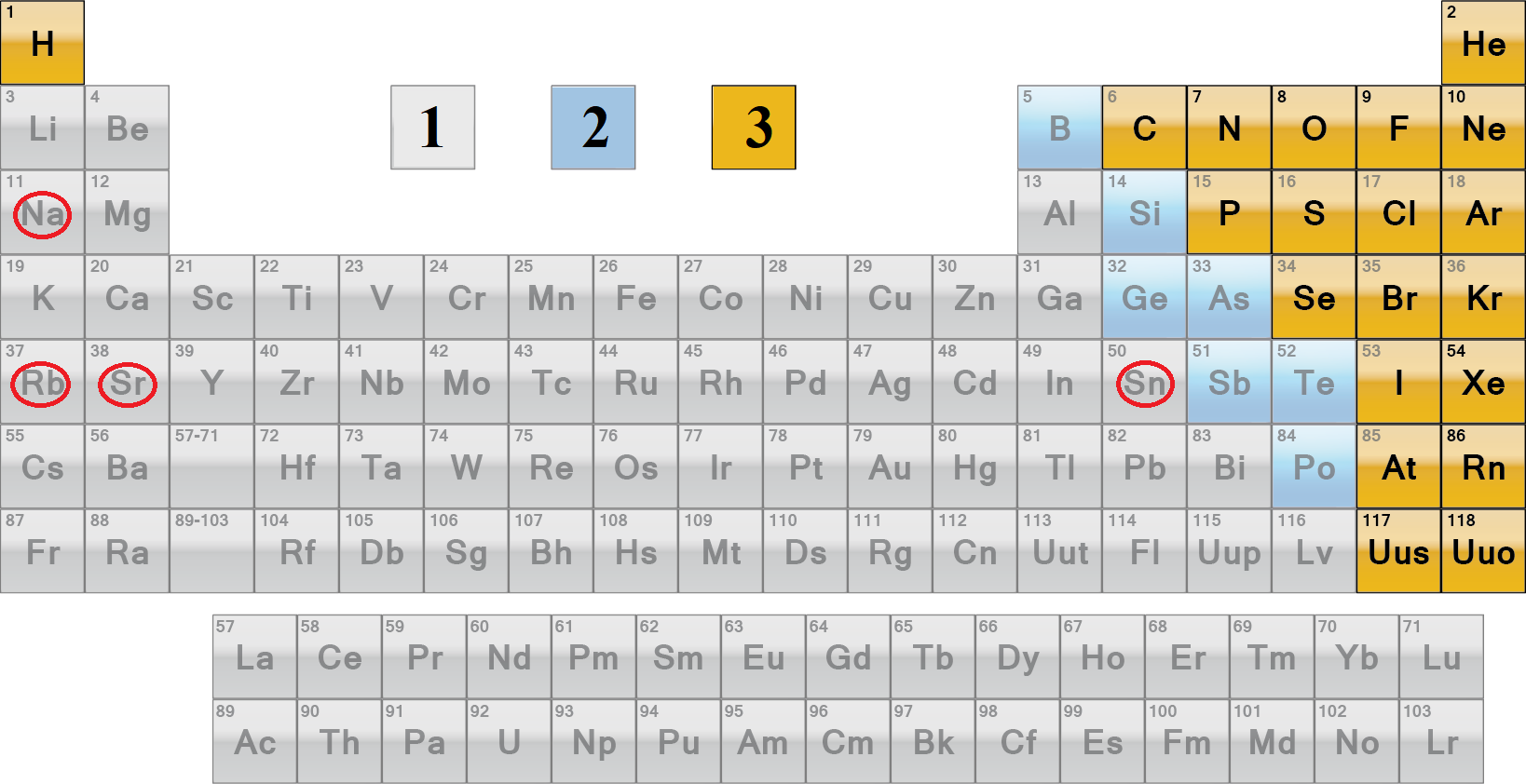
Рис. 1. Місцеположення в періодичній системі хімічних елементів – металічних (1), перехідних між металічними й неметалічними (2), неметалічних (3)
A Na, Ne, N
Б Cl, Sr, Sn
B P, As, Si
Г C, Br, Rb
Відповідь: Б.
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння визначати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хімічні елементи класифікують на
Берилій, Кальцій, Магній – елементи 2 А групи періодичної системи хімічних елементів. В їхніх атомах на зовнішньому енергетичному рівні перебувають два
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді Б, В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей, у варіанті Г – атоми того самого неметалічного елемента. Натомість у натрій оксиді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Натрію й аніонами Оксигену.
Відповідь: A.
ТЕМА: Суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на властивості її складників.
Морська вода – розчин солей. Суміш можна розділити дистилюванням: вода внаслідок нагрівання випаровується і конденсується, а розчинені в ній солі – ні.
Відповідь: A.
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація. Електролітична дисоціація солей.
Завдання скеровано на перевірку вміння використовувати таблицю «Розчинність кислот, основ, амфотерних гідроксидів і солей у воді за температури 20–25 °С» для прогнозування продуктів електролітичної дисоціації солей.
Унаслідок дисоціації у водному розчині барій хлориду утворюються катіони Барію і хлорид-аніони:
Відповідь: B.
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей бензену й уміння складати хімічні реакції за його участі.
Гідрування бензену полягає в приєднанні молекул водню до молекули бензену:
Відповідь: B.
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
Проаналізувавши рівняння оборотної реакції
Відповідь: Г.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
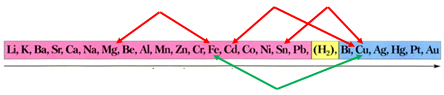
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що залізо витісняє із солі мідь, оскільки розташоване лівіше від нього:
Відповідь: Б.
ТЕМА: Основні класи неорганічних сполук. Дія основних класів сполук на індикатор.
Завдання перевіряє знання кольору універсального індикаторного папірця залежно від середовища та дії на індикатор водневих сполук неметалічних елементів і оксидів неметалічних елементів за наявності води.
Для виконання завдання необхідно знати, що універсальний індикаторний папірець змінює колір на синій у лужному середовищі. Із наведених сполук лужне середовище в присутності води дає лише
Відповідь: B.
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація оксидів.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Несолетворними називають оксиди, які не взаємодіють ні з кислотами, ні з основами і солей не утворюють. До таких належить нітроген(ІІ) оксид
Відповідь: Г.
ТЕМА: Неорганічні речовини і їхні властивості. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання хімічних властивостей гідрогенкарбонатів.
Питна сода – тривіальна назва натрій гідрогенкарбонату – кислої солі слабкої нестійкої карбонатної кислоти. Оцтова (етанова) кислота витісняє слабшу карбонатну з її солі, нестійка карбонатна кислота розкладається на карбон(IV) оксид і воду:
Відповідь: Г.
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
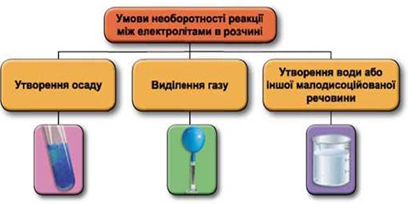
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Реакція у водному розчині відбудеться між натрій сульфатом і барій нітратом:
Відповідь: Б.
ТЕМА: Органічна хімія. Вуглеводні. Алкани.
Завдання скеровано на перевірку вміння аналізувати структурні формули алканів й обґрунтовувати залежність між їхніми температурами кипіння, відносними молекулярними масами та будовою молекул.
У гомологічному ряду алканів температури кипіння знижуються зі зменшенням довжини карбонового ланцюга, а температури кипіння ізомерних алканів зменшуються зі збільшенням його розгалуженості.
Найкоротший і найбільш розгалужений карбоновий ланцюг у 2,2‑диметилбутану, довший і менш розгалужений порівняно з ним – у 2‑метилпентану. У гексану й гептану карбоновий ланцюг не має відгалужень, довжина ланцюга гексану менша, а температура кипіння нижча порівняно з гексаном (рис. 1).
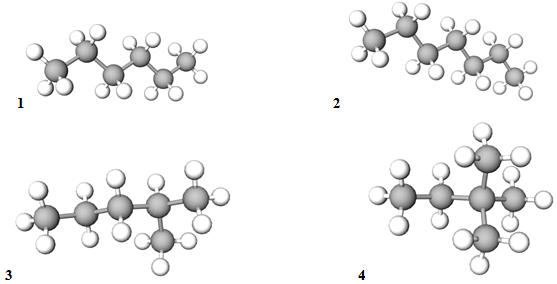
Рис. 1. Моделі молекул гексану (1), гептану (2), 2-метилпентану (3),
2,2-диметилбутану (4)
Відповідь: Б.
ТЕМА: Органічна хімія. Вуглеводні. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей етану, етену, бензену, уміння класифікувати хімічні реакції за їхньої участі.
А як етан, так й етен вступають у реакції заміщення
Б як молекули бензену, так і молекули етену здатні приєднувати молекули водню
В тримеризація етину – один зі способів добування бензену
Г молекула бензену дуже стійка, тому бензен не реагує з бромною водою
Відповідь: Г.
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Алкіни.
Завдання скеровано на перевірку знання хімічних властивостей алканів й алкінів.
І етан
Відповідь: Б.
ТЕМА: Органічна хімія. Хімічні властивості спиртів. Способи добування альдегідів. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі спиртів.
Продуктом окиснення етанолу купрум(ІІ) гідроксидом є етаналь:
Відповідь: B.
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів.
Крохмаль – полісахарид. Його молекули утворені залишками молекул глюкози. Тож гідролізом крохмалю добувають глюкозу:
Відповідь: Б.
ТЕМА: Органічні речовини. Естери. Жири.
Завдання скеровано на перевірку знання хімічних властивостей жирів.
Олії – рідкі ненасичені жири, гідруванням їх перетворюють на тверді насичені жири. Тобто правильним є лише друге твердження, бо внаслідок гідролізу жирів утворюються гліцерол і вищі карбонові кислоти.
Відповідь: Б.
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти. Білки.
Завдання скеровано на перевірку знання складу молекул білків.
Білки – біополімери. Молекули білків утворені залишками амінокислот. Унаслідок гідролізу білок розщеплюється на амінокислоти, із залишків яких він побудований.
Відповідь: Г.
ТЕМА: Органічні речовини. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку знання хімічного складу тефлону й уміння визначати структурну ланку цього полімеру.
Тефлон – полімер 1,1,2,2-тетрафлуороетену:
Відповідь: Б.
ТЕМА: Органічна хімія. Спирти. Феноли. Альдегіди.
Завдання скеровано на перевірку знання функціональних (характеристичних) груп і розуміння належності органічної сполуки до того чи іншого класу сполук.
Для виконання завдання необхідно знати характеристичні групи спиртів і альдегідів, визначення фенолів.
Альдегіди – органічні сполуки, які містять характеристичну (функціональну) групу 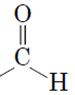 ;
;
феноли – це органічні сполуки, у яких гідроксильна група безпосередньо сполучена з бензеновим кільцем 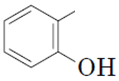 ;
;
спирти – органічні сполуки, у яких гідроксильна група сполучена з вуглеводневим замісником 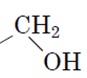 .
.
Відповідь: 1В, 2Д, 3Г.
ТЕМА: Неорганічна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1. Продуктом гідратації кальцій оксиду є одна складна речовина – кальцій гідроксид.
2. Унаслідок розкладання кальцій карбонату утворюються дві складні речовини – оксиди Кальцію і Карбону(IV).
3. Унаслідок розкладання гідроген пероксиду утворюються вода (складна речовина) і кисень (проста речовина).
Відповідь: 1В, 2Б, 3А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
Знайти:
Відповідь: 230.
ТЕМА: Обчислення в хімії. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 23.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за масою реагенту і його відносним виходом.
Дано:
Знайти:
Відповідь: 120.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати хімічну формулу речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
Дано:
Знайти:
Відповідь: 15.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
Знайти:
Відповідь: 4.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
Знайти:
Відповідь: 7.




