Розділ: Мультитести
Тест: Тренувальний мультитест (10 варіант)
Блок: Хімія
Кількість завдань: 30
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б два хімічні елементи (
В три хімічні елементи (
Г два хімічні елементи (
Відповідь: B.
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
ТЕМА: Загальні відомості про металічні елементи й метали. Алюміній, сполуки Алюмінію.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, сполук Алюмінію.
I Алюміній належить до p-елементів, в його атомі заповнюється електронами p-підрівень:
II Алюміній гідроксид за нагрівання розкладається:
III У йона
IV Для добування водню в лабораторії можна використати алюміній і хлоридну кислоту:
Відповідь: Г.
ТЕМА: Кристалічні ґратки. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип кристалічних ґраток у речовині.
Протонні числа хімічних елементів збігаються з їхніми протонними числами. У завданні йдеться про воду (протонне число Гідрогену 1, Оксигену – 8). Кристалічні ґратки у воді молекулярні – у їхніх вузлах містяться її молекули.
Відповідь: A.
ТЕМА: Чисті речовини і суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад.
На рисунку схематично зображено розділення суміші двох рідин із різною густиною за допомогою ділильної лійки. Густина бензену менша за густину води, тому в ділильній лійці після розшаровування цих рідин шар бензену буде зверху, а води – знизу. Його можна видалити, відкривши кран ділильної лійки.
Відповідь: B.
ТЕМА: Загальна хімія. Кислоти. Електролітична дисоціація кислот.
Завдання скеровано на перевірку розуміння електролітичної дисоціації кислот.
Універсальний індикаторний папір змінює забарвлення на червоне в кислому середовищі. Тобто в досліджуваному розчині є катіони Гідрогену.
Відповідь: A.
ТЕМА: Неорганічні речовини і їхні властивості. Луги.
Завдання скеровано на перевірку знання хімічних властивостей натрію, уміння класифікувати хімічні реакції за різними ознаками.
Натрій – проста речовина, вода – складна. Продуктами реакції є водень – проста речовина – і натрій гідроксид – складна. Унаслідок перебігу реакції Натрій і Гідроген змінюють ступені окиснення:
Відповідь: A.
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Ця реакція ендотермічна, відбувається зі збільшенням об’єму. Тому з-поміж наведених варіантів зміщенню рівноваги в бік утворення кисню сприятиме зниження тиску.
Відповідь: Г.
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває у стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
Проаналізувавши наведене в умові завдання рівняння реакції
можна дійти висновку, що перебіг прямої реакції – синтезу сульфур(VI) оксиду – відбувається з виділенням теплової енергії (
Тобто підвищення температури має бути компенсоване зміщенням хімічної рівноваги вліво, адже розкладання сульфур(VI) оксиду – ендотермічний процес, під час якого теплота поглинається.
Щодо інших варіантів відповіді:
А з огляду на мольні (а отже й об’ємні) відношення газів підвищення тиску зміщуватиме хімічну рівновагу праворуч. Адже тиск сульфур(IV) оксиду й кисню сумарною кількістю речовини 3 моль вищий за тиск сульфур(VI) оксиду, кількість речовини якого за рівнянням реакції становить 2 моль;
В, Г збільшення концентрації кисню або сульфур(IV) оксиду приведе до зміщення хімічної рівноваги праворуч, адже під час прямої реакції ці гази реагують між собою, тобто їхня концентрація зменшується.
Відповідь: Б.
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що у водному розчині цинк як активніший метал витіснить залізо з ферум(ІІ) хлориду, залізо – свинець, кадмій – мідь, а нікель як менш активний метал не витіснить цинк.
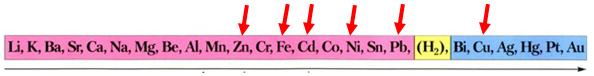
Активність металів зменшується
Рис. 1. Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Зрозуміло, що лише маса залізної пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) етаноату, бо атомна маса Плюмбуму більша за атомну масу Феруму.
Відповідь: Б.
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Реакції обміну між електролітами.
Завдання перевіряє вміння аналізувати взаємодію речовин у водному розчині.
Для виконання завдання необхідно вміти застосувати знання про реакції обміну між електролітами в розчині. Магній сульфат і магній нітрат – солі магнію, тому відрізнити їх можна лише за аніоном. Сульфат від нітрату у водному розчині можна відрізнити катіонами барію, із запропонованих речовин це водний розчин барій хлориду. Магній сульфат у водному розчині вступає в реакцію з барій хлоридом, а магній нітрат – ні.
Відповідь: B.
ТЕМА: Кислотні оксиди. Кислоти. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між неорганічними сполуками, установлювати генетичні зв’язки між ними.
Сульфатну кислоти можна добути реакцією сульфур(VІ) оксиду з водою:
Відповідь: A.
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
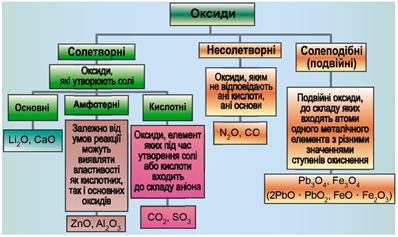
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Літій оксид – основний, цинк оксид – амфотерний, карбон(IV) оксид – кислотний.
Відповідь: Б.
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
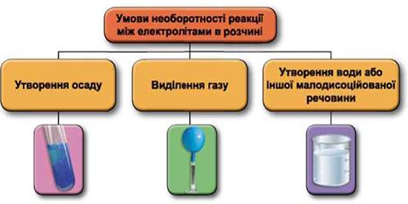
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: B.
ТЕМА: Органічна хімія. Хімічні властивості алканів. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості алканів для прогнозування типів і продуктів реакцій за їхньої участі.
Бутан є насиченим вуглеводнем, тому
А вступає в реакції відщеплення водню з утворенням
Б ізомеризується у 2-метилпропан
В НЕ ВСТУПАЄ в реакції приєднання
Г вступає в реакції заміщення з хлором за освітлення
Відповідь: B.
ТЕМА: Органічна хімія. Загальна формула алкенів.
Завдання скеровано на перевірку знання загальної формули алкенів.
Загальна формула алкенів –
Відповідь: Г.
ТЕМА: Органічна хімія. Вуглеводні. Алкіни.
Завдання перевіряє знання про хімічні властивості алкінів.
Для виконання завдання необхідно знати хімічні властивості алкінів. Етин – ненасичений вуглеводень гомологічного ряду алкінів. Унаслідок каталітичної гідратації етина утворюється етаналь.
Відповідь: Б.
ТЕМА: Органічна хімія. Альдегіди.
Завдання скеровано на перевірку знання хімічних властивостей альдегідів, генетичних зв’язків між альдегідами й карбоновими кислотами.
Продуктами часткового окиснення альдегідів є карбонові кислоти. Продуктом окиснення пропаналю є пропанова кислота.
Відповідь: A.
ТЕМА: Органічна хімія. Вуглеводи. Целюлоза.
Завдання скеровано на перевірку знання хімічних властивостей і застосування целюлози.
Целюлоза зазнає гідролізу під час нагрівання з розведеними кислотами й перетворюється на глюкозу:
Відповідь: B.
ТЕМА: Органічні речовини. Естери. Жири.
Завдання скеровано на перевірку знання хімічної природи жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот.
Відповідь: Б.
ТЕМА: Органічна хімія. Нітрогеновмісні сполуки. Амінокислоти. Білки.
Завдання скеровано на перевірку знання хімічних властивостей білків.
Білки – біополімери. Їхні молекули утворені залишками амінокислот. Амінокислоти – продукти повного гідролізу білків.
Відповідь: B.
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку вміння визначати структурну ланку полімеру.
Полімери – високомолекулярні сполуки, молекули яких (макромолекули) складаються з великої кількості однакових угруповань, з’єднаних хімічними зв’язками. Ці групи атомів, які повторюються і становлять основу хімічної будови полімерного ланцюга, називають елементарними структурними ланками полімерів.
Поліпропілен є продуктом полімеризації пропену:
Відповідь: Б.
ТЕМА: Органічна хімія. Вуглеводні. Ізомерія.
Завдання скеровано на перевірку знання загальних формул вуглеводнів різних гомологічних рядів, розуміння суті ізомерії, реакції ізомеризації.
1 |
Ізомером речовини A є речовина B з такою самою молекулярною формулою |
2 |
Продуктом ізомеризації бутану є речовина Б з такою самою молекулярною формулою |
3 |
Загальній формулі |
Відповідь: 1В, 2Б, 3Д.
ТЕМА: Розчини. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Під час розв’язування завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20‑25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
У першій пробірці містився розчин солі карбонатної кислоти, оскільки під дією сильної сульфатної кислоти виділився газ – карбон(IV) оксид:
У другій пробірці містився розчин солі Магнію, бо внаслідок дії водного розчину натрій гідроксиду утворився осад магній гідроксиду:
У третій пробірці був розчин солі Барію, бо внаслідок дії водного розчину сульфатної кислоти утворився осад барій сульфату:
Відповідь: 1Б, 2Д, 3А.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
Знайти:
Відповідь: 2.
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого реагенту за відомою масою продукту реакції.
Дано:
Знайти:
Відповідь: 672.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати задачі на встановлення хімічної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 8.
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна густина газів.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її відносною густиною.
Дано:
Знайти:
Відповідь: 64.
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини хімічного елемента за масою сполуки.
Дано:
Знайти:
Відповідь: 3.
ТЕМА: Обчислення в хімії. Визначення молекулярної формули речовини за масовими частками хімічних елементів у ній.
Завдання скеровано на перевірку вміння визначати істинну формулу речовини за масовими частками хімічних елементів у ній і відносною густиною за воднем.
Дано:
Знайти:
Істинна формула вуглеводню
Відповідь: 8.




