ЗНО онлайн 2018 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2018 року з хімії
ТЕМА: Основні хімічні поняття. Хімічна і графічна формули. Масова частка елемента у сполуці.
Завдання перевіряє розуміння молекулярної і структурної формул речовини та розуміння масової частки елементів без проведення обчислень масової частки кожного хімічного елемента, який входить до складу речовини.
І. Перше твердження є правильним. Для відповіді на це запитання необхідно порахувати число атомів кожного елемента в структурній формулі й зіставити з молекулярною формулою у твердженні І. Формули однакові.
ІІ. Друге твердження є неправильним. Масова частка елемента – це відношення маси атомів елемента в молекулі речовини до молекулярної маси речовини. Тобто
Під час розрахунку масової частки кожного елемента необхідно масу атомів елемента в молекулі речовини поділити на відносну молекулярну масу речовини, тобто знаменник буде однаковим, і тому достатньо порівняти чисельник. Чисельником є маса атомів елемента в молекулі речовини. Отже, завдання зводиться до того, щоб порівняти маси атомів елемента в молекулі речовини:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє розуміння зміни електронегативності, радіуса атома елементів в групі та залежність властивостей елементів від радіуса атома. Зверніть увагу на виділення в умові «ПОМИЛКОВИМ»!
Необхідно розуміти, що в групі радіус атома збільшується, тому електронегативність і окисні властивості зменшується. Номер періоду показує число енергетичних рівнів в атомі. Оксиген (2 період) і Сульфур (3 період) – елементи різних періодів. Тому «ПОМИЛКОВИМ» є твердження Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Склад атомних ядер. Поняття нуклід, нуклонне і протонне число, число нейтронів.
Завдання перевіряє знання протонного і нуклонного чисел, уміння визначати за протонним і нуклонним числами число нейтронів.
Нуклонне число (А) – відносна атомна маса, протонне число (Z) – порядковий номер елемента. Число нейтронів (N) визначається як різниця між нуклонним і протонним числами. Отже, у нукліда Ферум-56,
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв'язок. Основні типи хімічного зв’язку.
Завдання на розуміння основних типів хімічного зв’язку.
Йонна сполука має йонний зв’язок, який зазвичай виникає між металічними й неметалічними елементами. Для виконання завдання необхідно вміти відрізняти за періодичною системою хімічних елементів Д.І. Менделєєва металічні та неметалічні елементи.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Поняття окисник, відновник, окиснення, відновлення, ступінь окиснення.
Завдання на розуміння понять ступінь окиснення, окиснення, відновлення та вміння визначати ступінь окиснення елементів в речовині.
Для виконання завдання достатньо визначити ступінь окиснення Нітрогену в сполуках, які містять Нітроген.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основи. Лужні та лужноземельні метали.
Завдання перевіряє розуміння з опису досліду типів хімічних реакцій, дії лугів на індикатор, фізичних і хімічних властивостей лужних металів.
Речення «Він плавиться, перетворюючись на кульку, яка швидко рухається поверхнею води» говорить про те, що реакція є екзотермічною. Натрій – лужний метал, а лужні метали з водою утворюють луг і при цьому виділяється водень. Про утворення лугу свідчить те, що розчин поступово набуває малинового кольору. Отже, із наведених тверджень правильними є І і ІV.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Йонно-молекулярне рівняння. Реакції обміну між електролітами у розчині.
Завдання перевіряє вміння визначати можливість перебігу реакції обміну між електролітами в розчині
Реакція обміну між електролітами в розчині відбувається за умов утворення осаду, або виділення газу, або утворення слабкого електроліту (води). Бажано написати рівняння хімічних реакцій:
Аналіз рівнянь показує, що осад випадає лише в одній реакції.
Відповідь: Б
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Дія основних класів сполук на індикатор.
Завдання перевіряє знання кольору універсального індикаторного папірця залежно від середовища та дії на індикатор водневих сполук неметалічних елементів і оксидів неметалічних елементів за наявності води.
Для виконання завдання необхідно знати, що універсальний індикаторний папірець змінює колір на синій у лужному середовищі. Із наведених сполук лужне середовище в присутності води дає лише
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості солетворних оксидів.
Завдання перевіряє знання визначення кислотних і основних оксидів, хімічних властивостей солетворних оксидів.
Для виконання завдання необхідно вміти розрізняти кислотні й основні оксиди і знати, що вони реагують між собою. Кислотні і основні оксиди наведено в парах під номерами 1 і 3.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Основи. Хімічні властивості, способи добування основ.
Завдання перевіряє знання хімічних властивостей і способів добування основ.
Купрум(ІІ) гідроксид – нерозчинна у воді основа (див. таблицю розчинності в тестовому зошиті), яка за нагрівання легко розкладається (властивість нерозчинних основ), і яку добувають реакцією обміну між розчинною сіллю й лугом. Тому з наведених варіантів відповіді правильний лише Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Кислоти. Хімічні властивості кислот.
Завдання перевіряє знання хімічних властивостей кислот, зокрема сульфатної кислоти як сильної кислоти, уміння розрізняти основні класи неорганічних сполук.
Сульфатна кислота як сильна кислота реагує (із наведеного у завданні переліку речовин) з солями слабких кислот і основами і не реагує з кислотними оксидами. Тому з наведених варіантів правильним є лише А.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання типів хімічних реакцій, хімічних властивостей солей, зокрема карбонатів, хлоридів, нітратів.
Усі солі, назви яких наведено в завданні, розкладаються, але зі зміною ступеня окиснення – лише натрій нітрат
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Амфотерні сполуки.
Завдання перевіряє знання хімічних властивостей сполук амфотерних елементів і вміння складати рівняння реакцій взаємодії солей амфотерних елементів з лугами в розчині.
Для виконання завдання необхідно знати, що алюміній хлорид – сіль амфотерного елемента й розуміти, що солі амфотерних елементів реагують з лугом з утворенням осаду, який розчиняється в надлишку лугу.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Хімічні властивості і добування солей.
Завдання перевіряє знання хімічних властивостей і добування солей.
Для виконання завдання необхідно знати за якої умови солі реагують між собою у водному розчині й вміти користуватися таблицею розчинності, яка є в тестовому зашиті. Дві солі можуть реагувати за умови, якщо вихідні солі розчинні у воді, а одна із солей, що утворюється, не розчина у воді. Розчинна чи нерозчинна сіль у воді – визначають за таблицею розчинності. Таким умовам з наведеного переліку назв речовин відповідає лише барій нітрат.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Лужні та лужноземельні елементи. Твердість води.
Завдання перевіряє знання визначення твердості води.
Твердість води зумовлена вмістом у воді катіонів Кальцію
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Алюміній
Завдання перевіряє знання фізичних і хімічних властивостей алюмінію.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи та метали. Хімічні властивості металів. Ряд активності металів.
Завдання перевіряє застосування знань про хімічні властивості металів і ряд активності металів у конкретній дослідницькій задачі.
Для розв’язання задачі краще взяти три елементи, які відповідають літерам у завданні
У першій пробірці
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Хімічні властивості та добування солей.
Завдання перевіряє знання хімічних властивостей і способів добування солей.
Для виконання завдання необхідно скористатися рядом активності металів. За рядом активності металів визначаємо, що
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Енергетичні рівень і підрівень, радіус атома. Електронегативність.
Завдання перевіряє знання понять період, енергетичний рівень, електронегативність, зміну властивостей хімічних елементів і їхніх сполук у періодах і групах.
Для виконання завдання необхідно розуміти, як змінюється електронегативність елементів у періодах і групах, як змінюються хімічні властивості елементів і простих речовин у періодах і групах, як визначити число енергетичних рівнів в атомах. Число енергетичних рівнів визначається номером періоду. У завданні представлені елементи однієї групи за збільшенням порядкового номера, а тому збільшення числа енергетичних рівнів в атомах.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Оксиген і Сульфур. Способи добування кисню. Нітроген і Фосфор. Хімічні властивості нітратів.
Завдання перевіряє знання способів добування кисню в лабораторних умовах або розкладання нітратів.
Для виконання завдання необхідно знати як розкладають гедрогенкарбонати, карбонати, силікати та нітрати. Із наведених сполук з виділенням кисню розкладається лише калій нітрат:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Добування солей.
Завдання перевіряє розуміння утворення середніх і кислих солей залежно від мольного співвідношення речовин у реакціях між лугами і багатоосновними кислотами.
Для виконання завдання необхідно зіставити певні кількості речовин кислот і лугів. Ортофосфатна кислота трьохосновна, тому для утворення середньої солі при взаємодії з натрій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:3. Такого співвідношення немає. Сульфатна кислота двохосновна, тому для утворення середньої солі при взаємодії з калій гідроксидом необхідне мольне співвідношення кислоти і лугу 1:2. Таке співвідношення наведено у варіанті Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості оксидів. Алкани. Хімічні властивості алканів.
Завдання перевіряє знання хімічних властивостей кислотних оксидів і алканів.
Для виконання завдання необхідно вміти порівнювати дію наведених реагентів на пропан і вуглекислий газ. Пропан не буде взаємодіяти з жодним з наведених реагентів, а карбон(IV) оксид у водному розчині буде реагувати лише з вапняною водою з утворенням осаду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Алкани. Номенклатура алканів.
Завдання перевіряє знання номенклатури IUPAC.
Для виконання завдання необхідно дати назву речовині за номенклатурою IUPAC. Для цього вибираємо найдовший карбоновий ланцюг, нумеруємо атоми карбону з того боку, де ближче знаходиться характеристична (функціональна група) група
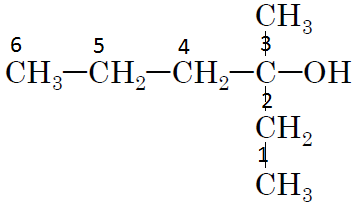
Починаємо назву з положення вуглеводневого замісника
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Теоретичні основи органічної хімії. Класифікація хімічних реакцій в органічній хімії.
Завдання перевіряє знання класифікації хімічних реакцій в органічній хімії.
Для виконання завдання необхідно знати, що дегідрування – це реакція відщеплення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Теоретичні основи органічної хімії. Явище гомології. Гомологи.
Завдання перевіряє знання поняття гомологи, уміння визначати гомологи вуглеводнів та їхніх похідних.
Для виконання завдання необхідно знати поняття гомологи та вміти за назвою речовини визначити гомологи. Гомологи – це речовини, які подібні за будовою, але відрізняються на одну або декілька груп
то бачимо, що на групу
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алкінів.
Завдання перевіряє знання хімічних властивостей алкінів.
Для виконання завдання необхідно розуміти, котра з речовин, формули яких наведено, реагує як з бромною водою, так і з амоніачним розчином арґентум(І) оксиду. З бромною водою реагують усі речовини, тому що всі є ненасиченими вуглеводнями. З амоніачним розчином арґентум(І) оксиду з ненасичених реагують лише алкіни, у яких атом Карбону з одного боку містить потрійний зв’язок, а з іншого – атом Гідрогену, здатний заміщуватися на атом металу. Тому правильна відповідь – Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алканів, алкенів і ароматичних вуглеводнів.
Завдання перевіряє вміння порівнювати хімічні властивості ароматичних вуглеводнів з алканами та алкенами.
Для виконання завдання необхідно знати хімічні властивості насичених, ненасичених і ароматичних вуглеводнів і вміння порівнювати їхні властивості. Насичені вуглеводні, гексан у тому числі, і бензен не реагують з калій перманганатом. Тому перше твердження неправильне. Бензен, на відміну від гекс-1-ену (алкен), не знебарвлює бромну воду, тому ці речовини можна відрізнити за допомогою бромної води. Отже, друге твердження правильне.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти.
Завдання перевіряє вміння класифікувати спирти за природою атомів Карбону, з якими сполучена гідроксильна група, – первинні, вторинні, третинні спирти.
Для виконання завдання необхідно знати, що третинний спирт – спирт, у якому гідроксильна група сполучена з атомом Карбону, який своєю чергою сполучений із трьома іншими атомами Карбону. У речовині 2,3-диметилпентан-2-ол 2-й атом Карбону є третинним, тому що сполучається з 1-м, 3-м і біля нього є ще радикал метил. Саме з 2-м атомом Карбону сполучена гідроксильна група (-2-ол), тому ця відповідь і буде правильною.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти.
Завдання перевіряє знання якісної реакції на багатоатомні спирти.
Для виконання завдання необхідно знати, що прозорий розчин темно-синього кольору з купрум(ІІ) сульфатом дають багатоатомні спирти. Із запропонованих варіантів відповіді це етан-1,2-діол (двоатомний спирт).
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол. Способи добування фенолу.
Завдання перевіряє властивості й способи добування фенолу.
Для виконання завдання необхідно знати, що фенол є дуже слабкою кислотою. Фенол є навіть слабкішою кислотою, ніж карбонатна. Для добування слабких кислот на їхні солі діють більш сильною кислотою.
Із запропонованих варіантів по-перше, необхідно вибрати рядок, де є фенолят (сіль фенолу). Таких рядків два – Б і Г. По-друге, у рядку має бути кислота, сильніша за фенол. Це рядок – Г, а кислота –
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Естери. Хімічні властивості естерів.
Завдання перевіряє знання хімічних властивостей естерів та вміння застосовувати ці знання для визначення естерної групи і відповідно до цього продуктів кислотного гідролізу.
Для виконання завдання необхідно визначити естерну групу в формулі
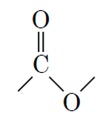
і зрозуміти за радикалом ліворуч
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Класифікація вуглеводів.
Завдання перевіряє вміння розрізняти моно-, ди- та полісахариди.
Для виконання завдання необхідно знати, що глюкоза і фруктоза – це моносахариди, сахароза – дисахарид, а целюлоза і крохмаль – полісахариди.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни. Класифікація, будова та властивості амінів.
Завдання перевіряє розуміння класифікації амінів за кількістю заміщених атомів Гідрогену (первинні, вторинні, третинні аміни), порівняння осно́вних властивостей аніліну й насичених амінів, знання хімічних властивостей аніліну.
Для виконання завдання необхідно знати класифікацію та хімічні властивості амінів, уміти порівнювати властивості ароматичних і насичених амінів.
Анілін – ароматичний амін первинної будови (варіант А неправильний). Бензенове кільце послаблює осно́вні властивості аміногрупи у порівнянні з аліфатичними амінами, тому анілін не може бути сильнішою органічною основою, ніж діетиламін і не змінює забарвлення універсального індикатора (варіант Б, Г неправильний). З іншого боку під впливом аміногрупи бензенове кільце стає більш активним у реакціях заміщення на відміну від бензену, анілін реагує з бромною водою з утворенням білого осаду 2,4,6-трибромоаніліну.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени та алкіни. Хімічні властивості алкенів і алкінів.
Завдання перевіряє вміння порівнювати хімічні властивості алкенів і алкінів на прикладі етену й етину.
Для виконання завдання необхідно знати й уміти порівнювати хімічні властивості алкенів і алкінів. Гідрування – це приєднання водню, тому гідруванням етину (містить потрійний зв’язок) можна добути етен (містить подвійний зв’язок) (твердження І правильне).
Етен і етин – ненасичені вуглеводні, молекули яких містять відповідно подвійний і потрійний зв’язки, тому як етен, так і етин реагують із бромною водою (твердження ІІІ неправильне) й окиснюються розчином калій перманганату (твердження ІІ правильне). У реакції гідратації вступають по-різному. Унаслідок гідратації етена утворюється спирт, а етину – етаналь (ацетальдегід) (твердження ІV неправильне).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Хімічні властивості та добування оксигеновмісних органічних сполук.
Завдання перевіряє вміння за структурною формулою визначати, до якого класу органічних сполук належить речовина, та знання хімічних властивостей і добування спиртів, альдегідів, карбонових кислот, естерів.
Для виконання завдання необхідно вміти застосувати знання про хімічні властивості оксигеновмісних органічних сполук.
Спирти окиснюються до альдегідів, альдегіди окиснюються до карбонових кислот, карбонові кислоти реагують зі спиртами з утворенням естерів.
За схемою перетворень: спирт
Отже, речовина Х – естер.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Хімічні властивості та визначення класів оксигеновмісних органічних сполук, їхньої будови.
Завдання перевіряє вміння за структурною формулою визначати, до якого класу органічних сполук належить речовина та знання хімічних властивостей цих речовин.
Для виконання завдання необхідно вміти визначати за функціональною (характеристичною) групою, до якого класу сполук належить речовина.
Речовина 1 (етанол) – насичений одноатомний спирт (насичений вуглеводневий радикал пов'язаний з гідроксильною групою), речовина 2 (фенол) – фенол (бензенове кільце безпосередньо пов’язане з гідроксильною групою), речовина 3 (етанова кислота) – насичена одноосновна карбонова кислота (насичений вуглеводневий радикал пов’язаний з карбоксильною групою), речовина 4 (метилметаноат) – естер (залишок кислоти пов'язаний з вуглеводневим радикалом).
Фенол (речовина 2) виявляє сильніші кислотні властивості у порівнянні з етанолом (речовина 1), тому І твердження є неправильним. Речовина 2 належить до класу фенолів, тому ІІ твердження також є неправильним. Фенол (речовина 2) і етанова кислота (речовина 3) виявляють кислотні властивості, тому й реагують з розчином натрій гідроксиду, ІІІ твердження є правильним. Етанова кислота (речовина 3) та метилметаноат (речовина 4) – міжкласові ізомери, тобто мають однаковий хімічний склад, але різну будову, тому ІV твердження є правильним. Етанова кислота (речовина 3) та метилметаноат (речовина 4) – різні класи органічних сполук, тому V твердження є неправильним.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна реакція. Поняття окиснення, відновлення.
Завдання перевіряє вміння визначати число електронів за схемою процесу відновлення.
Для виконання завдання необхідно вміти визначати ступінь окиснення елементів у йонах і число електронів за схемою відновлення.
Схемі 1
cхемі 2
cхемі 3
cхемі 4
Відповідь: 1А, 2Д, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук.
Для виконання завдання необхідно знати хімічні властивості основних класів неорганічних сполук і вміти їх застосувати задля встановлення відповідності між реагентами та продуктами хімічної реакції.
Відповідь: 1Д, 2В, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Класифікація хімічних реакцій в органічній хімії.
Завдання перевіряє вміння класифікувати реакції за участю органічних сполук.
Для виконання завдання необхідно вміти установлювати зв’язки між будовою молекул органічних сполук та їх здатністю вступати в реакції певного типу.
Схема 1: із бутану утворюється ізобутан, тому це реакція ізомеризації – В.
Схема 2: вихідна речовина містить насичений радикал, а продукт – ненасичений, тому це реакція відщеплення – Г.
Схема 3: із алкену утворюється бромоалкен, тому це реакція заміщення – А.
Схема 4: із алкіну утворюється дибромоалкен, тому це реакція приєднання – Б.
Відповідь: 1В, 2Г, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Класифікація органічних сполук за будовою карбонового ланцюга і наявністю характеристичних (функціональних) груп.
Завдання перевіряє вміння класифікувати органічні речовини за характеристичною (функціональною) групою.
Для виконання завдання необхідно вміти застосовувати знання з класифікації органічних речовин за характеристичною (функціональною) групою. Зайвою є структурна формула речовини, яка позначена літерою A, тому що ця речовина належить до класу фенолів, а фенолів серед наведених класів органічних сполук немає. За визначенням у фенолів гідроксильна група безпосередньо пов’язана з бензеновим кільцем.
|
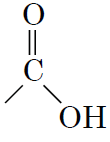
1Карбонові кислоти містять карбоксильну групу
|
В
 |
|
2Альдегіди – альдегідну групу
|
Д
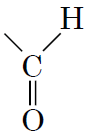 |
|
3Спирти – гідроксильну групу
|
Б
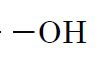 |
|
4Естери – естерну групу
|
Г
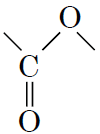 |
Відповідь: 1В, 2Д, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Явище ізомерії. Структурна ізомерія.
Завдання перевіряє вміння розрізняти структурні ізомери.
Для виконання завдання необхідно вміти визначати ізомери за структурними формулами та встановлювати відповідність між назвою речовини та формулою її структурного ізомеру.
Ізомери – речовини, які мають однаковий склад, але різну будову. У колонках з назвою речовини і формулою структурного ізомеру можна написати молекулярні формули і тоді легко побачити відповідність.
Відповідь: 1А, 2Б, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості та добування органічних сполук.
Завдання перевіряє знання хімічних властивостей і добування органічних сполук.
Для виконання завдання необхідно знати хімічні властивості та добування органічних сполук і вміти застосовувати ці знання задля встановлення відповідністі між хімічною реакцією та одним з її продуктів.
Унаслідок ізомеризації пентану утворюється ізопентан, сполука, яка має такий самий склад, але іншу будову (Г). Унаслідок дегідрування 2-метилпропану утворюється 2-метилпроп-1-ен (А). Унаслідок часткового окиснення бутаналю утворюється бутанова кислота (Д). Унаслідок лужного гідролізу 2-бромопропану утворюється пропан-2-ол (Б).
Відповідь: 1Г, 2А, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки.
Завдання перевіряє знання формули для обчислення маси речовини за її кількістю і вміння застосувати форму для розрахунку; уміння обчислювати молярну масу речовини.
Для розв’язання завдання необхідно застосувати формулу для розрахунку маси речовини за її кількістю.
Відповідь: 210.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки.
Завдання перевіряє вміння обчислювати середню молярну масу суміші газів.
Для розв’язання завдання необхідно знати, що молярна маса суміші – це відношення маси суміші до кількості речовин у суміші:
Якщо об’ємне співвідношення 3:1, то і мольне співвідношення таке саме 3:1.
Нехай кількість речовини кисню становить 3 моль
1) обчислюємо загальну кількість речовин у суміші:
2) обчислюємо маси речовин кисню і азоту і масу суміші:
3) обчислюємо молярну масу суміші:
Відповідь: 31.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання перевіряє вміння виконувати обчислення для добування розчину певної масової частки розчиненої речовини.
Для розв’язання завдання необхідно розуміти, що при змішуванні розчину і води маса розчиненої речовини не змінюється, тобто маса речовини в концентрованому і розбавленому розчинах однакова.
1) обчислюємо масу розчиненої речовини (сульфатної кислоти) в розчині, який необхідно добути:
2) обчислюємо масу першого розчину:
Відповідь: 60.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші). Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння обчислювати масову частку розчиненої речовини в розчині та розв’язувати задачі за рівнянням хімічної реакції.
Для виконання завдання необхідно знати хімічні властивості оснóвних оксидів і вміти розраховувати масову частку речовини за масою з рівняння хімічної реакції.
1) Обчислюємо масу літій гідроксиду у вихідному розчині:
2) Обчислюємо масу літій оксиду, який добавили до розчину:
3) Обчислюємо масу утвореного розчину лугу:
4) Якщо до розчину літій гідроксиду добавити літій оксид, то між літій оксидом і водою, яка є в розчині, відбувається хімічна реакція. За реакцією визначаємо кількість, а після цього масу літій гідроксиду, який утворився із літій оксиду:
5) Обчислюємо масу літій гідроксиду в утвореному розчині:
6) Обчислюємо масову частку літій гідроксиду в розчині, що утворився:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші).
Завдання перевіряє вміння обчислювати об’ємну частку речовини в суміші.
Для виконання завдання необхідно знати хімічні властивості насичених вуглеводнів і амінів і вміти розраховувати об’ємну частку речовини в суміші.
1) унаслідок пропускання суміші, що складається з етану та етанаміну, крізь склянку з бромідною кислотою, маса склянки збільшується, тому що етанамін реагує з бромідною кислотою. На скільки збільшилася маса склянки, стільки етанаміну вступає в реакцію, тобто
2) обчислюємо кількість етанаміну:
3) обчислюємо об’єм етанаміну:
4) обчислюємо об’ємну частку етанаміну в суміші:
Відповідь: 40.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за хімічними формулами і на виведення формули сполуки. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння виводити молекулярну формулу речовини за продуктами згоряння.
Для виконання завдання необхідно розуміти, що продуктами повного окиснення (згоряння) вуглеводнів є вуглекислий газ (карбон(ІV) оксид) і вода, знати властивості фосфор(V) оксиду та лугів.
Унаслідок пропускання продуктів окиснення вуглеводню через першу склянку з фосфор(V) оксидом, маса склянки збільшилася за рахунок того, що фосфор(V) оксид є водопоглинаючою речовиною. Тобто маса води становить 3,6 г. Із продуктів окиснення залишається лише вуглекислий газ. Унаслідок подальшого пропускання карбон(ІV) оксиду крізь концентрований розчин лугу, маса склянки збільшилась за рахунок того, що луг у розчині реагує з карбон(ІV) оксидом. Тобто маса карбон(ІV) оксиду становить 8,8 г.
1) Обчислюємо кількості речовин води і карбон(ІV) оксиду:
2) Знаходимо за рівнянням реакції кількість атомів Карбону і Гідрогену в молекулі вуглеводню:
Отже, формула речовини
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння розв’язувати розрахункові задачі за рівняннями хімічних реакцій.
Для виконання завдання необхідно знати властивості кислотних оксидів і розчинних у воді основ, розуміти як із середньої солі утворюється кисла сіль.
1) обчислюємо кількість речовини кальцій гідроксиду
За умовою задачі кількість речовини кальцій гідроксиду становить 0,2 моль, а кількість речовини карбон(IV) оксиду – 0,25 моль. Унаслідок пропускання карбон(IV) оксиду крізь вапняну воду утворюється середня сіль:
За рівнянням реакції кальцій гідроксид кількістю речовини 0,2 моль реагує з карбон(IV) оксидом кількістю речовини 0,2 моль з утворенням кальцій карбонату кількістю речовини 0,2 моль.
2) надлишок карбон(IV) оксиду кількістю речовини 0,05 моль у водному розчині реагує з кальцій карбонатом з утворенням кислої солі:
За рівнянням реакції на утворення кислої солі витрачається кальцій карбонат кількістю речовини 0,05 моль, тому кількість речовини кальцій карбонату (середньої солі), що залишається, становить 0,15 моль, а маса – 15 г.
Відповідь: 15.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння виконувати обчислення, якщо зразок речовини містить певну частку домішок.
Для виконання завдання необхідно розуміти що таке домішки та вміти визначати масову частку чистої речовини в зразку.
1) обчислюємо кількість карбон(ІV) оксиду, який утворився внаслідок спалювання кам’яного вугілля:
2) за рівнянням хімічної реакції обчислюємо кількість речовини і масу Карбону в зразку вугілля:
3) обчислюємо масову частку Карбону в зразку вугілля:
Відповідь: 96.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання перевіряє вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Для виконання завдання необхідно вміти визначати окисник і відновник і складати електронний баланс.
Відновник в окисно-відновних реакціях віддає електрони. Відповідно до електронного балансу віддає електрони Сульфур, тому він і є відновником. Коефіцієнт перед формулою відновника – 5.
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Масова частка компонента в суміші. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння визначати за рівняннями хімічних реакцій масу речовини в суміші і обчислювати масову частку цієї речовини в суміші.
Для виконання завдання необхідно вміти проводити розрахунки за рівняннями хімічних реакцій і розуміти що означає масова частка речовини в суміші.
1) за умовою задачі в реакції відновлення вступає водень кількістю речовини
2) за рівняннями реакцій визначаємо кількість речовини, а за формулами масу та масову частку купрум(І) оксиду в суміші:
Відповідь: 90.
Знайшли помилку? Пишіть на




