ЗНО онлайн 2018 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2018 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Молекулярна формула – запис, що показує тип і кількість атомів у молекулі.
За наведеною в умові завдання структурною формулою можна визначити молекулярну, підрахувавши загальну кількість атомів кожного хімічного елемента. Молекулярна формула речовини –
Масова частка хімічного елемента – відношення маси хімічного елемента в речовині до маси речовини. Найпростіша формула цієї речовини –
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі. Електронегативність. Радіус атома.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах зі збільшенням протонних чисел (зверху вниз) радіус атомів хімічних елементів збільшується (рис. 1, 1), а електронегативність (рис. 1, 2) і, відповідно, окисні властивості зменшуються.
Флуор і Хлор – елементи однієї групи, але різних періодів, тому в їхніх атомах різна кількість енергетичних рівнів (рис. 1, 1).
Тобто помилковим є твердження, наведене в рядку A.
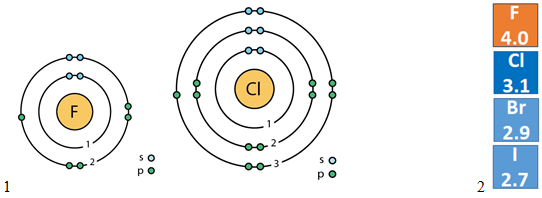
Рис. 1. 1. Будова атомів Флуору і Хлору. 2. Електронегативність галогенів
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони.
Протонне число
Кількість нейтронів
Порядковий номер Кобальту в періодичній системі – 27, тобто
Масове (нуклонне) число Кобальту – 59, тобто
Тож можна обчислити кількість нейтронів у ядрі нукліда

Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
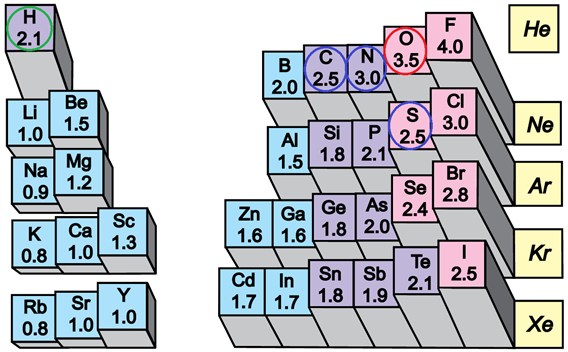
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементамипро сполуки яких ідеться, тому і зв’язок
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно. Ступінь окиснення Нітрогену в молекулі амоніаку й катіоні амонію дорівнює –3. З огляду на це можна визначити ступені окиснення Цирконію:
Вочевидь ступінь окиснення жодного хімічного елемента не змінився.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі неорганічних речовин, класифікувати хімічні реакції за різними ознаками.
Натрій бурхливо реагує з водою з виділенням великої кількості теплоти й утворенням водню і натрій гідроксиду. Тобто ця реакція є екзотермічною:
Як реагентами, так і продуктами в цій реакції є одна проста й одна складна речовини. Атоми Натрію заміщують атоми Гідрогену в молекулі води.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді калій нітрат, натрій карбонат і кальцій хлорид дисоціюють на йони:
З-поміж йонів, які утворюються внаслідок електролітичної дисоціації речовин, про які йдеться в завданні, осад утворюється лише внаслідок взаємодії катіонів Кальцію і карбонат-аніонів:
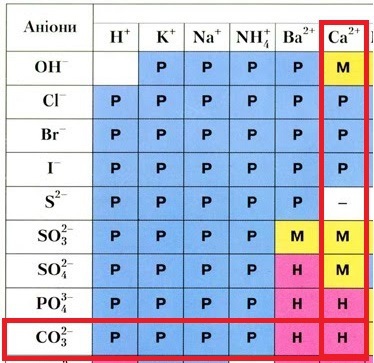
Тому осад випаде лише в пробірці ІІ.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Аналіз скороченого йонного рівняння дає змогу дійти висновку, що як реагенти, так і продукти реакції – розчинні речовини, а реакція необоротна, бо внаслідок її перебігу утворюється вода – неелектроліт.
Розчинними є обидва реагенти (нітратна й сульфатна кислоти, барій гідроксид) лише у варіантах відповіді Б і В.
Однак у варіанті відповіді Б один з продуктів реакції – барій сульфат – нерозчинна речовина, що не відповідає скороченому йонному рівнянню.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння застосовувати знання про властивості осно́вних і кислотних оксидів, зокрема їхньої здатності реагувати між собою (рис. 1).
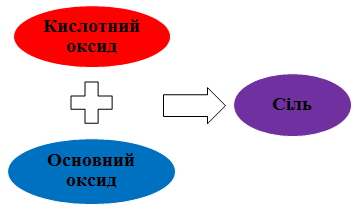
Рис. 1. Взаємодія основних і кислотних оксидів
Натрій оксид і кальцій оксид основні, карбон (IV) оксид, силіцій(IV) оксид, фосфор(V) оксид – кислотні. Тож реагуватимуть між собою натрій оксид і фосфор(V) оксид .
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад, будову й загальні властивості лугів для прогнозування властивостей представників цієї групи неорганічних сполук.
Калій гідроксид – добре розчинна у воді речовина йонної будови, термічно стійка, тому як його водний розчин, так і розплав проводить електричний струм. Є продуктом реакції калію з водою:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Поняття ступінь окиснення, окисно-відновна реакція.
Завдання скеровано на перевірку знання особливостей термічного розкладання солей, розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
A |
|
Б |
|
B |
|
Г |
|
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання магній нітрату.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння аналізувати й прогнозувати результати дослідження, робити висновки.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк оксид реагує як осно́вний, із лугами – як кислотний. Тобто амфотерні властивості цинк оксиду описані перетвореннями, наведеними в рядку Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знання властивостей сульфатної кислоти, уміння аналізувати реагенти й прогнозувати продукти реакції, робити висновки.
У сульфатній кислоті Ступінь окиснення атома Сульфуру дорівнює +6, тобто максимально можливий для цього хімічного елемента. Тому з киснем сульфатна кислота не реагує.
Так само сульфатна кислота не реагує з кислотним карбон(IV) оксидом.
Вона реагує з осно́вним магній оксидом і з амоніаком:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей, визначати можливість перебігу реакції обміну між електролітами в розчині.
Проаналізувавши умову завдання, можна дійти висновку, що її задовольнить речовина, яка у водному розчині дисоціює з утворенням:
- аніонів, які осаджують катіони Калію і Барію;
- катіонів, які утворюють осад із гідроксид- і хлорид-аніонами.
Цю умову з-поміж наведених варіантів відповіді задовольняє лише магній сульфат:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку розуміння закономірностей розташування металів у ряду активності для прогнозування можливості перебігу реакції металу із сіллю в її водному розчині.

Ряд активності металів
Що лівіше розташований метал в ряду активності, то більша його активність і відновні властивості. Згідно експериментальних даних метал
Відповідно найсильніші окисні властивості з-поміж наведених катіонів виявляють катіони
Як менш активний метал
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку знання властивостей неорганічних речовин і способів їхнього добування.
Газуватим продуктом реакції міді з концентрованою сульфатною кислотою є сульфур(ІV) оксид.
Манган(ІV) оксид каталізує реакцію розкладання гідроген пероксиду на кисень і воду.
Газуватим продуктом взаємодії кальцій карбіду з водою є етин.
Унаслідок реакції кальцію з водою утворюються кальцій гідроксид і газуватий водень:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання властивостей будови атома Алюмінію, властивостей алюмінію і сполук Алюмінію, способів їхнього добування.
A |
У хімічних реакціях атоми Алюмінію віддають електрони й окиснюються |
Б |
У йона Алюмінію така сама (10 електронів) електронна конфігурація, як в атома Неону |
B |
алюміній гідроксид не добувають реакцією алюміній оксиду з водою. Його добувають реакцією обміну між сіллю алюмінію і лугом у водному розчині |
Г |
оксид і гідроксид Алюмінію амфотерні, тому можуть реагувати як із кислотами, так і з лугами, зокрема з натрій гідроксидом |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ). Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а зі слабкими (катіони Гідрогену в хлоридній кислоті) – сполуки Феруму(ІІ). У реакціях із сильними відновниками (залізом) сполуки Феруму(ІІІ) відновлюються до сполук Феруму(ІІ). У реакціях обміну з ферум(ІІІ) оксиду утворюється ферум(ІІІ) хлорид.
1
2
3
4
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Розчини. Йонно-молекулярне рівняння. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей і умови необоротності реакцій обміну між електролітами в розчині для прогнозування можливості перебігу хімічних реакцій, їхніх продуктів.
Солі, про які йдеться в завданні, утворені катіоном Магнію i різними аніонами – хлорид-аніоном і нітрат-аніоном. З-поміж йонів, назви яких наведено у варіантах відповіді, два катіони й два аніони. Тобто для розрізнення розчинів магній хлориду й магній нітрату потрібно використати певний катіон, який осаджуватиме або нітрат-, або хлорид-аніон.
Скориставшись таблицею розчинності, легко дійти висновку, що цю умову задовольняє катіон Аргентуму(І):
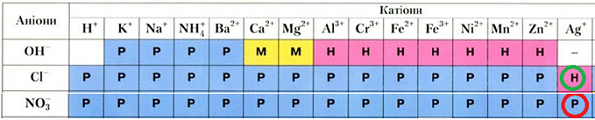
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Солі. Середні й кислі солі. Ортофосфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про кислі й середні солі, способи добування солей для прогнозування складу продуктів хімічних реакцій.
Середня сіль – продукт повного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить лише катіони металічних елементів й аніони кислотних залишків.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в багатоосновній кислоті йонами металічних елементів, містить катіони металічних елементів, атоми Гідрогену, здатні до заміщення на катіони металічних елементів, й аніони кислотних залишків.
A |
|
Б |
|
B |
|
Г |
|
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів другого і третього періодів.
Завдання скеровано на перевірку вміння визначати за формулами речовин ступені окиснення атомів хімічних елементів, прогнозувати їхні окисно-відновні властивості.
A |
|
Б |
|
B |
|
Г |
|
Сульфур – елемент VІа групи, у його атомі на зовнішньому енергетичному рівні 6 електронів. Тобто максимальний ступінь окиснення атомів Сульфуру становить +6 (збігається з номером групи), а мінімальний дорівнює –2 (різниця між номером групи й числом 8).
Тобто атом Сульфуру зі ступенем окиснення +6 може лише приймати електрони й виявляти окисні властивості, а атом Сульфуру зі ступенем окиснення -2 може лише віддавати електрони й виявляти відновні властивості.
Атом Сульфуру зі ступенем окиснення +4 може як віддавати електрони, так і приймати їх:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Силіцій(ІV) оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості оксидів для прогнозування можливості хімічних реакцій за їхньої участі.
Силіцій(ІV) оксид – вищий оксид Силіцію, кислотний. Тому з киснем силіцій(ІV) оксид не реагує.
Так само кислотний силіцій(ІV) оксид не реагує з кислотним фосфор(V) оксидом і сульфатною кислотою.
Силіцій(ІV) оксид реагує з осно́вним натрій оксидом:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура амінів.
Завдання скеровано на перевірку вміння називати аміни за систематичною номенклатурою.
Алгоритм називання амінів за систематичною номенклатурою зображено на рисунку 1.
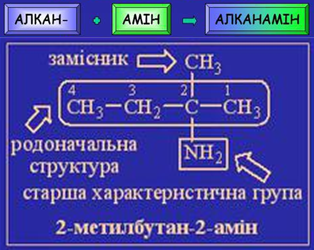
Рис. 1. Алгоритм називання амінів за систематичною номенклатурою
Назва органічної сполуки, структурну формулу якої наведено в завданні,
‑4‑метилпентан‑2‑амін (рис. 2).
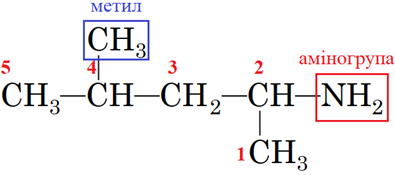
Рис. 2. Структурна формула 4‑метилпентан‑2‑аміну
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фізичні властивості алканів.
Завдання скеровано на перевірку вміння аналізувати структурні формули речовин i фізичні властивості алканів.
Вочевидь найвища температура кипіння в гептану
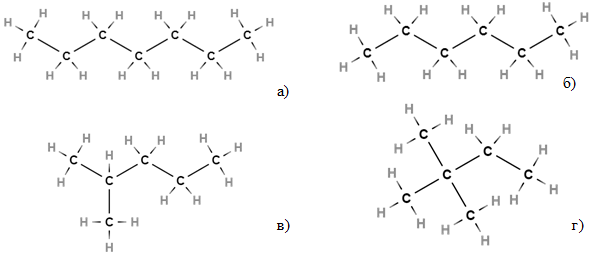
Рис. 1. Структурні формули гептану
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій. Алкени.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості алкенів для визначення типів реакцій зa їхньої участі.
Взаємодія пропену з бромом полягає в приєднанні молекули брому до молекули пропену за місцем подвійного зв’язку з утворенням молекули 1,2‑дибромопропану:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни.
Завдання скеровано на перевірку вміння аналізувати структурні формули алкінів і прогнозувати результати перебігу реакцій за їхньої участі.
Зв’язок
Тому бут-1-ин на відміну від бут-2-ину реагує з амоніачним розчином аргентум(І) оксиду.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на органічні сполуки.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних сполук і прогнозувати результати перебігу реакцій за їхньої участі.
Приєднання молекул брому за місцем кратних зв’язків характерне для алкенів й алкінів. Ці вуглеводні знебарвлюють бромну воду. Натомість бензенове ядро стійке до дії бромної води.
У молекулах речовин, формули яких наведено у варіантах відповіді А, Б, Г є подвійні і/або потрійні зв’язки в алкільних замісниках. Тому можливе приєднання до них молекул брому і, як наслідок, знебарвлення бромної води.
У молекулі речовини В вуглеводневий замісник феніл сполучений із насиченим вуглеводневим замісником етилом. Між атомами Карбону немає кратних зв’язків, до яких за м’яких умов можуть приєднатися молекули брому. Тож бромну воду етилбензен не знебарвлює.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Первинні, вторинні, третинні спирти.
Завдання скеровано на перевірку вміння розпізнавати спирти вторинної будови за їхніми структурними формулами.
Первинним є атом Карбону, сполучений з іншим атомом Карбону одним простим зв’язком, вторинним – з’єднаний із двома атомами Карбону двома простими зв’язками, третинним – сполучений із трьома атомами Карбону трьома простими зв’язками.
Залежно від положення гідроксигрупи (її розташування біля первинного, вторинного чи третинного атома Карбону) розрізняють спирти первинної, вторинної, третинної будови.
Умові завдання відповідає спирт, назва якого 2‑метилпентан‑3‑ол (див. рисунок).
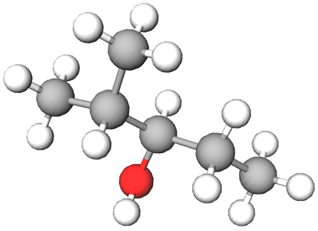
Рис. 1. Модель молекули 2‑метилпентан‑3‑олу
У варіантах відповіді B наведено структурну формулу спирту первинної будови, у варіантах А і Г – третинних спиртів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол.
Завдання скеровано на перевірку знання хімічної природи й властивостей фенолу.
1 фенол не належить до насичених одноатомних спиртів, бо в його молекулі гідроксигрупа безпосередньо сполучена з бензеновим кільцем
2 фенол – слабша кислота, ніж карбонатна, оскільки остання витісняє його з феноляту. Тому з натрій гідрогенкарбонатом у водному розчині фенол не взаємодіє.
3 фенол виявляє сильніші кислотні властивості порівняно з етанолом
Вуглеводневий замісник і характеристична група в молекулі фенолу взаємовпливають. Електрони бензенового кільця вступають у взаємодію з неподіленою електронною парою атома Оксигену, залучають її до своєї сфери й відтягують на себе. Унаслідок цього полярність зв’язку
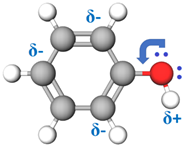
Рис. 1. Розподілення електронної густини в молекулі фенолу
4 під впливом атома Оксигену гідроксильної групи електронна густина в бензеновому кільці фенолу підвищується (рис. 1). Фенол значно легше за бензен вступає в реакції заміщення. Унаслідок добавляння бромної води до водного розчину фенолу миттєво утворюється білий осад 2,4,6‑трибромофенолу. Ця реакція є якісною на фенол:
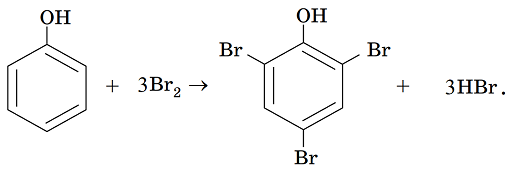
Тобто правильними є твердження 3 і 4.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Альдегіди. Карбонові кислоти.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості альдегідів, систематичну номенклатуру і способи добування карбонових кислот для прогнозування продуктів реакції.
Речовина, із якою за умовою завдання реагує купрум(ІІ) гідроксид, належить до альдегідів. Унаслідок окиснення альдегідів утворюються карбонові кислоти.
Унаслідок окиснення 2‑метилпропаналю утворюється 2‑метилпропанова кислота:
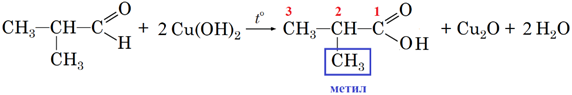
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння аналізувати за хімічними формулами склад органічних речовин і прогнозувати їхні хімічні властивості з огляду на характеристичні групи в їхніх молекулах.
Молекула речовини, структурну формулу якої наведено в умові завдання, містить структурний фрагмент фенолу (рис. 1, a).
Також у її молекулі є карбоксильна (рис. 1, б). Тож ця речовина може вступати в реакцію естерифікації як за гідроксигрупою фрагмента фенолу, так і за карбоксильною групою.
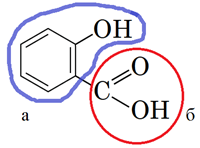
Рис. 1. Склад і будова молекули речовини: а) фрагмент фенолу; б) карбоксильна група
Тож обидва твердження є правильними.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку знання складу і властивостей амінів, уміння порівнювати її.
Первинним є атом Нітрогену, сполучений із атомом Карбону одним простим зв’язком, вторинним – з’єднаний із двома атомами Карбону двома простими зв’язками, третинним – сполучений із трьома атомами Карбону трьома простими зв’язками.
Тобто як етиламін, так і анілін є амінами первинної будови.
2 молекули як етиламіну, так і аніліну містять аміногрупу й реагують із сульфатною кислотою з утворенням солей
3 анілін на відміну від етиламіну не діє на універсальний індикатор
4 за тиску 109 Па температура кипіння етиламіну становить 16,6 °C, температура тверднення аніліну становить –6 °C. Тож за температури 0 °C (н. у.) обидві речовини перебуватимуть у рідкому стані.
Тобто правильні варіанти відповіді – 1, 2; 1, 4.
Відповідь: А, Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації і гідролізу естеру, уміння аналізувати склад і будову речовини за її хімічною формулою.
Речовина, структурну формулу якої наведено в умові завдання, належить до естерів і є продуктом реакції між спиртом і карбоновою кислотою. Загальну формулу естерів наведено на рисунку 1.
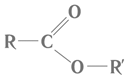
Рис. 1. Загальна формула естерів
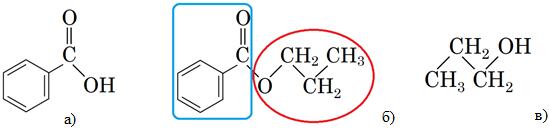
Рис. 2. Структурні формули бензоатної кислоти (а), пропан‑1‑олу (в) й естеру, утвореного ними (б)
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії і зумовленості властивостей речовин їхньою хімічною будовою.
У речовин, структурні формули яких наведено в умові завдання, та сама молекулярна формула
2 – естером.
Температури кипіння цих речовин різні, бо різна будова їхніх молекул.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Циклоалкани. Бензен.
Завдання скеровано на перевірку знань про хімічний склад і властивості, будову молекул гексану, циклогексану, бензену (рис. 1).
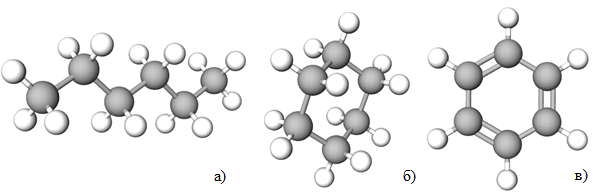
Рис. 1. Моделі молекул гексану (а), циклогексану (б), бензену (в)
З-поміж наведених в умові завдання правильними є такі твердження:
Бензен належить до вуглеводнів циклічної будови (I).
Каталітичним дегідруванням циклогексану можна добути бензен (ІІІ).
Гексан вступає в реакцію ізомеризації (VІ).
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні.
Завдання скеровано на перевірку знань про хімічний склад і властивості, будову й ізомерію вуглеводнів різних гомологічних рядів.
І Вид ізомерії, зумовлений взаємним просторовим розміщенням атомів, називають геометричною ізомерією або цис-, транс-ізомерією (від лат. cis – по цей бік, trans – по різні боки). Цис-, транс-ізомерія можлива в тому разі, якщо біля атомів Карбону, сполучених подвійним зв’язком, є різні замісники.
ІІ Речовина 3 на відміну від бензену реагує з бромною водою. Це зумовлено тим, що у вуглеводневому заміснику, сполученому з безеновим кільцем, є потрійний зв’язок.
ІІІ Речовини 2 і 3 реагують з амоніачним розчином аргентум(І) оксиду. Зв’язок
ІV Пропен і бензен – вуглеводні різних гомологічних рядів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння аналізувати окисно-відновні процеси.
1
2
3
4
Відповідь: 1Д, 2В, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічні речовини. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку вміння застосовувати знання про неорганічні речовини для прогнозування продуктів їхньої взаємодії.
1
2
3
4
Відповідь: 1Б, 2А, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати речовини за їхніми структурними формулами.
Належність речовини до певного класу органічних сполук можна встановити, проаналізувавши їхні структурні формули й виокремивши характеристичні групи – естерну, альдегідну, карбоксильну, етерну.
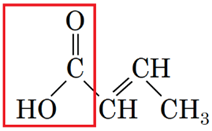
1 естер Г
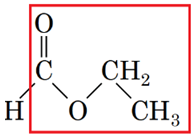
2 альдегід Б
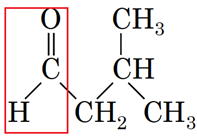
3 карбонова кислота A
4 етер Д
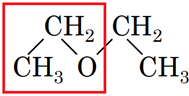
Відповідь: 1Г, 2Б, 3А, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук. Номенклатура. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії, уміння визначати формули ізомерів за структурними формулами сполук.
Ізомери – речовини з однаковою молекулярною формулою, але різною будовою молекул.
Тобто для правильного розв’язання завдання потрібно за назвою речовини визначити її молекулярну формулу й вибрати речовину з такою самою структурною формулою поміж наведених.
1
2
3
4
Відповідь: 1А, 2Б, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук. Класифікація хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку розуміння генетичних зв’язків між класами органічних сполук і вміння визначати типи хімічних реакцій за участі органічних речовин.
1 перетворення бутану на 2-метилпропан – речовину з такою самою молекулярною формулою, але іншою будовою молекули – реакція ізомеризації (B)
2 перетворення 2-метилпропану на 2-бромо-2-метилпропан унаслідок взаємодії з бромом – реакція заміщення (A)
3 перетворення 2-бромо-2-метилпропану на 2-метилпроп-1-ен відбувається внаслідок відщеплення молекули гідроген броміду (Г)
4 2-метилпроп-1-ен унаслідок приєднання за місцем подвійного молекули води перетворюється на 2-метилпропан-2-ол (Б)
Відповідь: 1В, 2А, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук. Класифікація хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку розуміння генетичних зв’язків між класами органічних сполук і вміння визначати типи хімічних реакцій за участі органічних речовин.
1 продуктом каталітичної гідратації етину є етаналь (B)
2 продуктом часткового окиснення метанолу є метанова кислота (Б)
3 продуктом міжмолекулярної дегідратації метанолу є диметиловий етер (Г)
4 продуктом міжмолекулярної дегідратації етанолу є етен (A)
Відповідь: 1В, 2Б, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
Знайти:
Відповідь: 4.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’ємну частку складника в газовій суміші.
Дано:
Знайти:
Відповідь: 60.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 90.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 64.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
За рівнянням реакції
За рівнянням реакції
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати задачі на встановлення хімічної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 60.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
За рівнянням реакції
Коефіцієнт перед формулою окисника – 5.
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 4.
Знайшли помилку? Пишіть на




