ЗНО онлайн 2019 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2019 року з хімії
ТЕМА: Основні хімічні поняття. Хімічна і графічна формули. Масова частка елемента у сполуці.
Завдання перевіряє розуміння молекулярної, структурної і найпростішої формул речовини. Розуміння масової частки елементів, не проводячи обчислень масової частки хімічного елемента, який входить до складу речовини.
І. Перше твердження є правильним. Для ствердження або спростування цього твердження необхідно порахувати число атомів кожного елемента в структурній формулі
ІІ. Друге твердження є неправильним. Масова частка елемента – це відношення маси атомів елемента в молекулі речовини до молекулярної маси речовини. Тобто
Під час розрахунку масової частки кожного елемента необхідно масу атомів елемента в молекулі речовини поділити на відносну молекулярну масу речовини, тобто знаменник буде однаковим, і тому достатньо порівняти чисельник. Чисельником є маса атомів елемента в молекулі речовини. Гідроген має найменшу відносну атомну масу
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Поняття нуклід, нуклонне число, протонне число. Формули атомів і простих йонів.
Завдання перевіряє розуміння понять нуклідного символу, простих йонів, уміння визначати кількість електронів за формулою нуклідного символу.
Порядковий номер Магнію – 12, кількість електронів також – 12, у катіона із зарядом +2 на два електрони менше, тому – 10.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Склад атомних ядер. Поняття нуклід, нуклонне і протонне число, число нейтронів.
Завдання перевіряє знання протонного і нуклонного чисел, уміння визначати за протонним і нуклонним числами число нейтронів.
Ізотопи – це елементи з однаковим числом протонів, тому твердження А неправильне. Нуклонне число – це сума протонів і нейтронів. У ядер атомів X та Y однакова сума протонів і нейтронів, а тому й однакове нуклонне число – 19. Твердження Б правильне. Число електронів в атомі таке саме, як і число протонів, тому твердження В неправильне. Твердження Г також неправильне, тому що їхні нуклонні числа однакові.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв'язок. Основні типи хімічного зв’язку. Типи кристалічних ґраток
Завдання перевіряє вміння за фізичними властивостями визначати тип кристалічної ґратки.
За умовою завдання речовина летка, має запах і невисоку температуру плавлення. Такі властивості мають речовини з молекулярною кристалічною ґраткою.
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Поняття ступінь окиснення.
Завдання на розуміння поняття «ступінь окиснення» та вміння визначати ступінь окиснення елементів у речовині.
Для розв’язання завдання достатньо визначити ступінь окиснення елементів у сполуках наведеної схеми хімічної реакції:
Аналіз ступенів окиснення Силіцію, Флуору і Нітрогену показує, що ступінь окиснення жодного з хімічних елементів не змінився.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Типи хімічних реакцій. Загальні відомості про металічні елементи та метали. Основи.
Завдання перевіряє здатність з опису хімічного досліду зрозуміти тип хімічної реакції, фізичних і хімічних властивостей лужноземельних елементів.
Лужноземельні елементи активно реагують з водою, тому реакція є екзотермічною. Унаслідок взаємодії лужноземельних елементів з водою утворюється основа (кальцій гідроксид – малорозчинна у воді основа) і водень. Тому з наведених тверджень правильними є лише І і ІV.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Розчини
Завдання перевіряє знання понять «розчинність», «насичені та ненасичені розчини», розуміння масової частки розчиненої речовини в розчині, уміння визначати масу речовини в розчині, зіставляти отримані дані з табличними даними.
Для розв’язання завдання необхідно розрахувати маси солей у вихідних розчинах, масу води і маси солей в утворених після добавляння відповідних мас солей.
Масова частка речовини – це відношення маси речовини до маси розчину:
із цієї формули можна знайти масу речовини:
Після добавляння до кожного розчину по 5 г солі, маса солей у кожній посудині становить 30 г, маса води не змінюється – по 100 г у кожній посудині. Розчинність – маса речовини, яка може розчинитися в 100 г води з отриманням насиченого розчину, наведена у таблиці. У кожній посудині після проведення досліду по 30 г солі у 100 г води. Не складно зіставити отримані дані з даними таблиці й зробити висновок, що в обох посудинах розчини будуть ненасиченими.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Неорганічна хімія.
Завдання перевіряє знання розчинності газів у воді й способи збирання газів, а саме витисненням води.
Для розв’язання завдання необхідно знати, що гази, які розчиняються у воді, не можна зібрати витисненням води. Нітроген(IV) оксид, гідроген бромід і амоніак – гази, які добре розчиняються у воді, тому зібрати їх витисненням води не можна, а кисень – газ, який погано розчиняється у воді, тому його можна зібрати у такий спосіб.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Оксиди. Хімічні властивості солетворних оксидів.
Завдання перевіряє знання визначення кислотних і основних оксидів, хімічних властивостей солетворних оксидів.
Для розв’язання завдання необхідно вміти розрізняти кислотні й основні оксиди (основні оксиди – оксиди металічних елементів, кислотні – неметалічних елементів) і знати, що вони реагують між собою, не реагують між собою або два основних оксиди, або два кислотних. У варіантах А, В і Г наведено пари формул основного і кислотного оксидів, а у варіанті Б – два основних оксиди, тому правильна відповідь Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Основи. Хімічні властивості, способи добування основ.
Завдання перевіряє знання хімічних властивостей і способів добування основ.
Основний оксид взаємодіє з водою з утворенням відповідного гідроксиду за умови, якщо такий гідроксид розчиняється у воді. Із запропонованих оксидів лише кальцій оксиду відповідає розчинний гідроксид.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні реакції. Основні класи неорганічних сполук. Оксиди. Кислоти. Загальні відомості про металічні елементи і метали.
Завдання перевіряє знання хімічних властивостей кислот, зокрема хлоридної кислоти як сильної кислоти, уміння за описом досліду зробити висновок про хімічні реакції.
В умові завдання описано, як під дією газу з оксиду утворився метал, тобто відбулася реакція відновлення. Відновниками можуть бути різні речовини, тому необхідно проаналізувати запропоновані варіанти відповідей:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Електролітична дисоціація, йонно-молекулярні рівняння.
Завдання перевіряє вміння визначати можливість перебігу реакції обміну між електролітами в розчинах.
Для виконання завдання необхідно розуміти що означає осадити йон і за яких умов можлива реакція між електролітами в розчинах, уміння користуватися таблицею розчинності.
Осадити йон означає зв’язати його іншим йоном в осад. В умові завдання йдеться про катіон, а катіон можна осадити аніоном. Проаналізуємо, які є аніони в запропонованих варіантах водних розчинів:
За таблицею розчинності, яка є в тестовому зошиті, визначаємо, з яким із запропонованих аніонів катіон
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Амфотерні сполуки.
Завдання перевіряє знання хімічних властивостей амфотерних сполук, а саме амфотерних гідроксидів, та їхню взаємодію з кислотами і лугами.
Для розв’язання завдання необхідно знати і розуміти, що цинк нітрат реагує з лугом з утворенням осаду – амфотерного цинк гідроксиду, який розчиняється як у надлишку лугу, так і в надлишку кислоти.
Відповідь: B
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання хімічних властивостей сполук неметалічних елементів, солей.
Для розв’язання завдання необхідно знати, що відбувається з різними солями за нагрівання, і визначати окисно-відновні реакції.
Проаналізуємо наведені варіанти солей з огляду на можливість їхнього термічного розкладання. Розкладання солей карбонатної кислоти (А і Б) відбувається без зміни ступеня окиснення з виділенням вуглекислого газу; амоній хлорид (В) легко розкладається за нагрівання на амоніак і гідроген хлорид, реакція відбувається без зміни ступеня окиснення; розкладання нітратів, зокрема магній нітрату (Г) супроводжується зміною ступеня окиснення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Солі.
Завдання перевіряє знання хімічних властивостей солей, а саме умов, за яких метал взаємодіє з розчином солі; уміння аналізувати результати реакції, а саме зміну маси після взаємодії металу з розчином солі; уміння користуватися рядом активності металів.
Для розв’язання завдання необхідно скористатися рядом активності металів, який є в тестовому зошиті. У ряду активності метали розміщено за зменшенням їхньої активності. Активніший метал знаходиться ліворуч. Метал може витискувати інший метал з розчину солі, якщо він більш активний, тобто стоїть у ряду активності ліворуч.
За допомогою ряду активності порівняємо кадмій (за умовою завдання пластинка кадмієва) із металами, які входять до складу запропонованих солей. Кадмій активніший лише за Купрум і Плюмбум (Б і Г).
Тепер проаналізуємо, як змінюється маса пластинки, якщо кадмій реагуватиме з розчинами
Загальна схема реакції:
Якщо в реакцію вступає 1 моль Кадмію, то внаслідок реакції утворюється 1 моль металу, тому достатньо порівняти молярні маси.
Розглянемо два випадки:
1) Реакція Кадмію з
2) Реакція кадмію з
За умовою завдання маса пластинки збільшилася, тому правильна відповідь – Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали
Завдання перевіряє знання властивостей лужноземельних металів, а саме кальцію і його сполук.
Проаналізуємо твердження:
І твердження правильне, у промисловості кальцій оксид добувають випалюванням вапняку.
ІІ твердження неправильне, тому що Кальцій – лужноземельний металічний елемент, він утворює оксид і гідроксид, які виявляють оснόвні властивості.
Відповідь: A
Знайшли помилку? Пишіть на
Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання хімічних властивостей металів, а саме алюмінію, і добування металів алюмотермією.
Для виконання завдання достатньо знати, що алюмотермія – це відновлення металу з оксиду алюмінієм. Із чотирьох запропонованих варіантів лише в одному (Б) алюміній відновлює метал з оксиду.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання якісного визначення лужних металічних елементів у сполуках, а саме Калію, і взаємодію солей з кислотами.
Для розв’язання завдання необхідно знати, що із запропонованих лише солі Калію забарвлюють полум’я у фіолетовий колір. Таких солей дві (А і Г). Далі в умові зазначено, що сіль реагує з хлоридною кислотою з виділенням газу. Із двох солей з утворенням газуватої речовини з хлоридною кислотою реагує лише
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про металічні елементи та метали.
Завдання перевіряє знання властивостей і добування металічних елементів, а саме Феруму.
Для розв’язання завдання необхідно знати способи добування і хімічні властивості заліза. Перша реакція – добування заліза із оксиду. Добути метал з оксиду можна реакцією відновлення. Із запропонованих відновником може бути лише карбон(ІІ) оксид (
Отже, правильна відповідь – Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання властивостей сполук неметалічних елементів, а саме гідроген хлориду.
Для виконання завдання необхідно знати, що гідроген хлорид у присутності води виявляє кислотні властивості та:
- дисоціює з утворення протонів Гідрогену
\(\mathrm{ (H^+)}\) , і універсальний індикаторний папірець змінить колір на червоний, що свідчить про утворення кислого середовища\(\mathrm{ (H^+)}\) . Тому І твердження правильне; - реагує з амоніаком, який у свою чергу виявляє оснόвні властивості. Унаслідок реакції утворюється білий дим – амоній гідроген хлорид
\(\mathrm{ NH_4Cl}\) . Тому ІI твердження також правильне.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі.
Завдання перевіряє вміння якісно визначати солі за аніоном.
Для розв’язання завдання необхідно знати якісні реакції на аніони. За умовою завдання є водні розчини солей магній нітрат
з нітрат-аніонами катіони барію не реагують. Таким чином, магній сульфат можна відрізнити від магній нітрату, використавши водний розчин барій хлориду.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Електронегативність. Неорганічні речовини і їхні властивості. Загальні відомості про неметалічні елементи та неметали.
Завдання перевіряє знання і розуміння періодичного закону і зміни властивостей елементів у групах.
Для виконання завдання необхідно розуміти, що Карбон і Силіцій – елементи IV групи головної підгрупи. Необхідно знати, що електронегативність
У групі
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Алкени. Номенклатура алкенів.
Завдання перевіряє знання номенклатури IUPAC.
Для виконання завдання необхідно знати правила номенклатури IUPAC і відповідно, використовуючи номенклатуру, давати назву речовині. Для цього вибираємо найдовший карбоновий ланцюг, нумеруємо атоми Карбону з того боку, де ближче знаходиться подвійний зв'язок, у цьому випадку між 2 і 3 атомами Карбону. Речовина належить до гомологічного ряду алкенів.
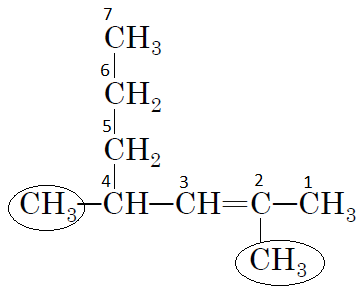
Із структурної формули видно, що до карбонового ланцюга приєднуються два однакові замісники
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні.
Завдання перевіряє знання структури та властивостей вуглеводнів, уміння порівнювати структуру та властивості алканів, циклоалканів, алкенів.
Для розв'язання завдання необхідно знати будову і властивості алканів, циклоалканів, алкенів. За умовою завдання треба указати ПОМИЛКОВЕ твердження, проаналізуємо їх:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Теоретичні основи органічної хімії. Явище ізомерії. Ізомери.
Завдання перевіряє знання поняття ізомерії, уміння визначати ізомери за назвою.
Для розв’язання завдання необхідно знати поняття «ізомери» і вміти за назвою речовини написати молекулярну формулу. Ізомери – речовини, які мають однаковий склад (якісний і кількісний), але різну будову, а тому й різні властивості. Молекулярна формула пент-1-ену:
Із молекулярних формул видно, що таку саму формулу як пент-1-ен має 2-метилбут-1-ен (А).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкіни.
Завдання перевіряє знання про хімічні властивості алкінів.
Для виконання завдання необхідно знати хімічні властивості алкінів. Етин – ненасичений вуглеводень гомологічного ряду алкінів. Унаслідок каталітичної гідратації етина утворюється етаналь.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Ароматичні вуглеводні. Бензен.
Завдання перевіряє знання хімічних властивостей алканів на прикладі пропану й ароматичних вуглеводнів – на прикладі бензену.
Пропан і бензен належать до різних гомологічних рядів, але мають деякі спільні властивості. І пропан, і бензен НЕ знебарвлюють бромну воду. Бензен у цьому схожий до насичених вуглеводнів.
За освітлення і бензен, і пропан реагують з хлором. Пропан за освітлення вступає в реакцію заміщення з хлором, а бензен – у реакцію приєднання.
Тому правильними твердженнями є ІІІ і ІV.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії.
Завдання перевіряє вміння класифікувати спирти за природою атомів Карбону, з якими сполучена гідроксильна група, – первинні, вторинні, третинні спирти.
Для виконання завдання достатньо знати, які спирти називають третинними. Третинний спирт – це спирт, у якому гідроксильна група приєднана до третинного атома Карбону. Третинний атом Карбону – це Карбон, який поєднаний із трьома іншими атомами Карбону.
Аналізуємо назви спиртів:
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Алкани. Алкени. Спирти.
Завдання перевіряє знання класифікації хімічних реакцій в органічній хімії, хімічні властивості алканів, алкенів і спиртів.
Аналізуємо схеми хімічних реакцій:
1) із алкана добули алкен. Алкен (пропен) містить на два атоми Гідрогену менше, ніж алкан (пропан), це реакція відщеплення. Відщеплення водню – це дегідрування;
2) із алкена добули спирт. Алкен (пропен) може приєднати молекулу води з утворенням спирту, це реакція приєднання. Приєднання води – це гідратація.
Тому правильна відповідь – Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Фенол.
Завдання перевіряє знання визначення, хімічних властивостей і добування оксигеновмісних органічних сполук, а саме фенолу.
Проаналізуємо твердження:
Отже, правильна відповідь – В.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання перевіряє визначення поняття полісахариди.
Полісахариди – високомолекулярні вуглеводи. Для виконання завдання необхідно знати представників полісахаридів. Із запропонованих до полісахаридів належать целюлоза й крохмаль.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання перевіряє знання хімічних властивостей естерів.
Естери – органічні речовини, які утворюються внаслідок реакції естерифікації із карбонової кислоти і спирту.
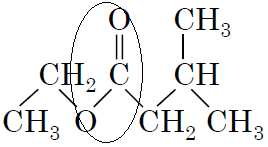
Для виконання завдання необхідно знати, що внаслідок кислотного гідролізу естеру утворюється кислота і спирт. Щоб визначити, яка кислота і спирт утворюється, треба правильно визначити розташування характеристичної групи. Проаналізуємо структурну формулу естеру. Атом Оксигену, який входить до характеристичної групи, пов’язаний із залишком спирту, тому спирт – етанол, а карбонільна група пов’язана із залишком кислоти. Із структурної формули видно, що кислота містить п’ять атомів Карбону. Перший атом Карбону входить у карбонільну групу, а біля третього – метильний замісник, тому кислота – 3-метилбутанова.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ароматичні вуглеводні. Аміни.
Завдання перевіряє вміння аналізувати структурну формулу речовини.
Проаналізуємо твердження щодо речовини, структурну формулу якої наведено:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія.
Завдання перевіряє знання якісного визначення ненасиченого характеру речовини.
Для розв’язання завдання необхідно застосувати знання для вибору способу виявлення речовини з подвійним зв’язком.
Довести наявність подвійного зв’язку можна або бромною водою, або розчином калій перманганату. Із запропонованих варіантів відповідей правильною є лише відповідь В.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Альдегіди. Карбонові кислоти.
Завдання перевіряє вміння порівнювати різні класи оксигеновмісних органічних сполук і робити висновки щодо їх визначення і хімічних властивостей.
Проаналізуємо речовини, структурні формули яких наведено, і твердження щодо них:
| 1 ароматичний спирт | 2 ароматичний альдегід | 3 етер | 4 ароматична кислота |
Отже правильна відповідь – В.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Альдегіди. Вуглеводи.
Завдання перевіряє знання якісних реакцій і вміння якісно визначати багатоатомні спирти, альдегіди, вуглеводи.
Проаналізуємо умову завдання й зробимо висновки:
1) після добавляння до кожної пробірки свіжоосадженого за надлишком лугу купрум(ІІ) гідроксиду і ретельного перемішування у пробірках 1 і 3 утворився прозорий розчин темно-синього кольору. Зміна кольору купрум(ІІ) гідроксиду на темно-синій говорить про те, що в пробірках 1 і 3 багатоатомні спирти, а це із запропонованих гліцерол і глюкоза. У пробірці 2 купрум(ІІ) гідроксид не розчинився, тому можна припустити, що в ній етаналь. Після нагрівання вмісту пробірки 2 спостерігали утворення осаду жовтого кольору й поступову зміну його забарвлення на червоне підтверджує це припущення. Отже, у пробірці 2 – етаналь.
2) таку саму реакцію на нагрівання спостерігаємо в пробірці 3, тому у пробірці 3 – глюкоза. Глюкоза – альдегідоспирт, тому спочатку ми спостерігали реакцію, як на багатоатомний спирт, а після нагрівання як на альдегід.
3) у пробірці 1 спостерігали реакцію лише на багатоатомний спирт, тому в пробірці 1 – гліцерол.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Окисно-відновні реакції. Ступінь окиснення.
Завдання перевіряє вміння визначати ступінь окиснення в простих і складних йонах і визначати кількість електронів, що беруть участь у процесі відновлення.
Для виконання завдання необхідно правильно визначити ступінь окиснення і кількість електронів, що беруть участь у цьому процесі.
| Схема процесу відновлення | Кількість електронів |
1 |
Б3 |
2 |
Г5 |
3 |
А2 |
4 |
Д6 |
Відповідь: 1Б, 2Г, 3А, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання перевіряє знання основних класів неорганічних сполук, їхні властивості й добування, уміння встановлювати генетичні зв’язки між класами неорганічних сполук.
У завданні необхідно увідповіднити цифри в схемах хімічних реакцій з формулами речовин.
Проаналізуємо схеми хімічних реакцій: у першій схемі з хлоридною кислотою із запропонованих можуть реагувати або
Відповідь: 1Г, 2В, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти. Фенол. Альдегіди. Карбонові кислоти.
Завдання перевіряє знання функціональних (характеристичних груп) спиртів, фенолів, альдегідів, карбонових кислот; уміння за функціональною (характеристичною групою) визначити клас органічної сполуки.
Для виконання завдання необхідно знати, який клас сполук яку функціональну (характеристичну групу) має і вміти зіставити клас органічної сполуки зі структурною формулою:
| Клас органічних сполук |
Функціональна (характеристична група) |
Структурна формула речовини |
|
1карбонові
кислоти |
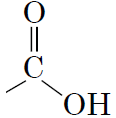 |
В
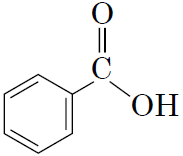 |
|
2альдегіди
|
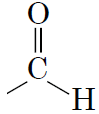 |
Г
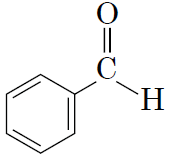 |
|
3феноли
|
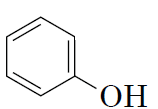 |
Д
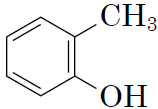 |
|
4спирти
|
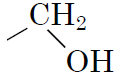 |
Б
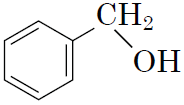 |
Відповідь: 1В, 2Г, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Алкани. Алкени. Спирти. Карбонові кислоти.
Завдання перевіряє знання і розуміння поняття «структурні ізомери» та вміння зіставити назву речовини з формулою структурного ізомеру.
Для виконання завдання необхідно знати поняття «ізомери». Ізомери – речовини, які мають однаковий склад (якісний і кількісний), але різну будову, а тому різні властивості.
Напишемо назву речовини молекулярною формулою і знайдемо відповідну структурну формулу:
| Назва речовини | Молекулярна формула | Формула структурного ізомеру |
|
1пентан
|
Г
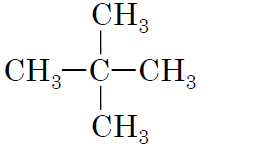
|
|
|
2пент-1-ен
|
Д
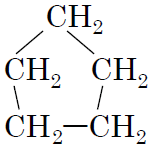 |
|
|
3пентан-1-ол
|
В
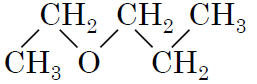 |
|
|
4пентанова кислота
|
А
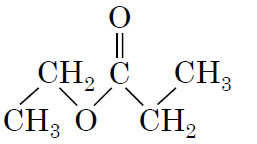 |
Відповідь: 1Г, 2Д, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії. Алкани. Алкени. Ароматичні вуглеводні. Бензен. Спирти.
Завдання перевіряє знання типів хімічних реакцій, хімічних властивостей і добування алканів, алкенів, ароматичних вуглеводнів, спиртів.
Проаналізуємо схему перетворення і увідповіднимо її типу хімічної реакції:
Відповідь: 1В, 2А, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Алкіни. Спирти. Феноли. Аміни.
Завдання перевіряє знання способів добування деяких органічних сполук.
Проаналізуємо спосіб добування речовини й увідповіднимо його речовині:
Відповідь: 1Г, 2Д, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання перевіряє знання формули розрахунку об’єму через кількість речовини, уміння проводити нескладні обчислення.
Для розв’язання задачі необхідно знати формулу, яка пов’язує кількість речовини з об’ємом за нормальних умов, і зробити нескладні розрахунки.
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання перевіряє вміння обчислювати середню молярну масу суміші газів.
Для розв’язання завдання необхідно розуміти, що середня молярна маса суміші газів – це маса 1 моль суміші газів.
Нехай кількість суміші газів дорівнює 1 моль:
Кількість речовини суміші 1 моль, тому маса, яку ми обчислили, і є молярною масою.
Відповідь: 17.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші). Масова частка розчиненої речовини
Завдання перевіряє вміння проводити розрахунки для приготування розчинів з певною масовою часткою речовини з концентрованих розчинів.
Під час розбавляння маса розчиненої речовини не змінюється.
1) обчислимо масу лугу в 250 г розчину з масовою часткою лугу 12%:
2) обчислимо масу вихідного розчину (40%), із якого готують 12% розчин:
Відповідь: 75.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій
Завдання перевіряє вміння розв’язувати розрахункові задачі за рівняннями хімічних реакцій.
1) обчислимо масу сульфатної кислоти у вихідному розчині:
2) обчислимо масу сульфур(VI) оксиду, який добавили до розчину кислоти:
3) під час змішування сульфур(VI) оксиду з розчином кислоти, оксид реагує з водою, яка є в розчині, з утворенням сульфатної кислоти. Обчислимо масу сульфатної кислоти, яку можна отримати з 2 моль сульфур(VI) оксиду:
4) обчислимо загальну масу сульфатної кислоти в утвореному розчині:
5) обчислимо масу розчину, який утворився після змішування сульфур(VI) оксиду з розчином кислоти:
6) обчислимо масову частку сульфатної кислоти в утвореному розчині:
Відповідь: 61.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння розв’язувати розрахункові задачі за рівняннями хімічних реакцій.
1) проаналізуємо, які речовини суміші будуть реагувати з хлоридною кислотою, узятою в надлишку. Із двох речовин суміші (магній і силіцій) з хлоридною кислотою буде реагувати лише магній, унаслідок цієї взаємодії виділяється водень:
2) обчислимо кількість моль водню, який виділився під час хімічної реакції:
3) за рівнянням реакції взаємодії магнію з хлоридною кислотою, якщо виділяється 0,25 моль водню, то і магнію вступає в реакцію 0,25 моль. Обчислюємо кількість магнію і його масу:
4) обчислюємо масову частку магнію в суміші:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв'язування задач на виведення формули сполуки.
Завдання перевіряє вміння установлювати хімічну формулу сполуки за кількісними даними про реагенти і продукти реакції.
Унаслідок повного окиснення (згоряння) вуглеводню утворюється вуглекислий газ і вода. За умовою задачі продукти окиснення пропустили спочатку через фосфор(V) оксид і вміст цієї склянки збільшився на 2,7 г (це маса води, фосфор(V) оксид використовують як осушувач, він поглинув воду), а потім через концентрований розчин лугу і маса другої склянки збільшилась на 6,6 г (це вуглекислий газ, розчин лугу прореагував з вуглекислим газом).
1) напишемо рівняння реакції повного окиснення вуглеводню:
2) знаючи маси, обчислимо кількість речовин вуглекислого газу і води:
3) знаючи кількість речовини вуглекислого газу і води, за рівнянням хімічної реакції обчислюємо
Отже, формула речовини
Відповідь: 15.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання перевіряє вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Визначимо ступені окиснення кожного елемента, складемо електронний баланс і перетворимо схему окисно-відновної реакції на хімічне рівняння:
За умовою завдання необхідно вказати суму коефіцієнтів, вона становить 20.
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння розв’язувати розрахункові задачі за рівняннями хімічних реакцій і виконувати обчислення, якщо речовини містять домішки.
Технічний кальцій карбід містить домішки. Під час реакції його з водою з виділенням етину реагує чиста речовина.
1) за рівнянням реакції мольне співвідношення кальцій карбіду і етину 1 : 1, якщо утворився етин кількістю речовини 0,25 моль, то в реакцію вступив кальцій карбід такою ж кількістю речовини 0,25 моль. Обчислюємо кількість, а потім і масу кальцій карбіду:
2) обчислюємо масову частку кальцій карбіду в технічному зразку
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння визначати хімічний елемент за рівнянням хімічної реакції.
Деякі метали добувають відновленням їхніх оксидів воднем.
1) напишемо рівняння реакції відновлення оксиду воднем:
2) за умовою задачі ми знаємо масу оксиду і масу відновленого металу. Різниця мас складає масу Оксигену. Знаючи масу Оксигену, можна знайти його кількість речовини, а тому й кількість речовини води:
3) за рівнянням реакції кількість речовини металу втричі менша за кількість речовини води, тому, якщо утворилося 1,5 моль води, то металу буде 0,5 моль. Обчислюємо кількість речовини металу:
4) обчислюємо молярну масу металу:
Відповідь: 184.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання перевіряє вміння розв’язувати розрахункові задачі на визначення складу суміші.
За умовою завдання до суміші порошків магнію і заліза добавили хлоридну кислоту. І магній, і залізо реагують з хлоридною кислотою з утворенням солей і виділенням водню.
1) напишемо рівняння реакцій взаємодії металів з кислотою:
За рівняннями реакцій кількість речовини металів така сама, як і кількість водню. Нехай кількість речовини водню, який виділяється в реакції (1), дорівнює х моль, тоді кількість речовини водню, який виділяється в реакції (2), дорівнює
2) виразимо маси металів через
3) обчислюємо масу заліза і його масову частку в суміші:
Відповідь: 70.
Знайшли помилку? Пишіть на




