ЗНО онлайн 2019 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2019 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Естери.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою, розпізнавати естери за їхніми структурними формулами.
Речовини, структурні формули яких наведено в умові завдання, належать до естерів і є продуктами реакцій між відповідними спиртами й карбоновими кислотами. Загальну формулу естерів наведено на рисунку 1.
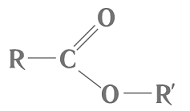
Рис. 1. Загальна формула естерів
Речовина 1 – етилетаноат, 2 – пропілметаноат. У цих речовин однакова молекулярна формула
Тому обидва наведені в завданні твердження є правильними.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння застосовувати знання про будову атомів і закономірності зміни властивостей хімічних елементів у періодичній системі.
У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а радіус атома збільшується. Тому радіус атома Оксигену менший за радіус атома Сульфуру, а електронегативність – більша. В Оксигену й Сульфуру різні протонні числа, тож з огляду на електронейтральність атомів загальна кількість електронів в їхніх атомах також різна. Тобто твердження А, В і Г неправильні.
Правильним є твердження Б, оскільки Оксиген і Сульфур – елементи тієї самої головної підгрупи й утворюють леткі сполуки з Гідрогеном складу
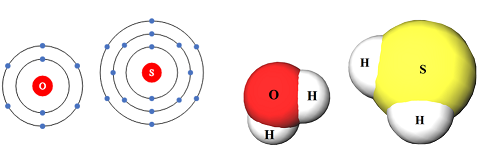
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
Тобто за умовою завдання потрібно визначити частинку, у якій кількість електронів більша за кількість протонів. Цій умові відповідає варіант відповіді A – у цій частинці кількість електронів на два більша за кількість протонів.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується (рис. 1).
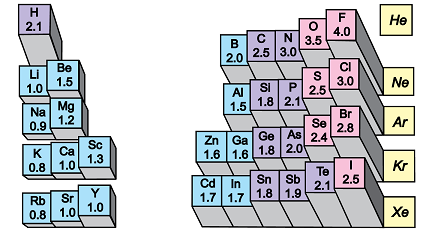
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A |
|
Б |
|
B |
|
Г |
|
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук і генетичні зв’язки між ними. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку знання властивостей і способу добування кальцій оксиду, розуміння генетичних зв’язків між основними оксидами, гідроксидами й солями.
Кальцій карбонат (сіль) унаслідок прожарювання розкладається на основний кальцій оксид і кислотний карбон(IV) оксид:
Кальцій оксид реагує з водою з утворенням кальцій гідроксиду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння аналізувати інформацію щодо розчинності солей, подану в графічній формі.
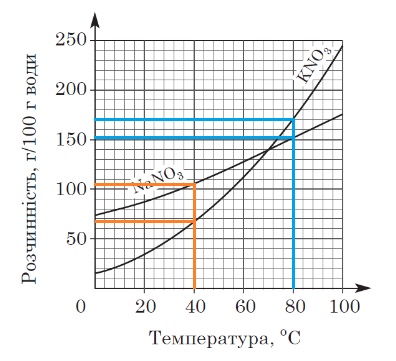
Залежність розчинності речовин від температури виражають за допомогою кривих розчинності. Їх будують за експериментально здобутими даними. Для побудови кривої розчинності відкладають на горизонтальній осі температуру, а на вертикальній – розчинність речовини за відповідної температури.
За результатами аналізування кривих розчинності, наведених в умові завдання, можна дійти висновку, що за температури 40 °С розчинність натрій нітрату більша за розчинність калій нітрату, а за температури 80 °С – навпаки.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку знання властивостей нітроген(IV) оксиду, гідроген хлориду, амоніаку, метану, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
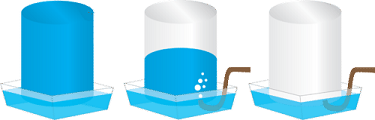
Із-поміж наведених у завданні речовин малорозчинною є лише кисень.
Нітроген(IV) оксид кислотний і реагує з водою, гідроген хлорид і амоніак добре розчиняються в ній.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати луги.
Луги – розчинні основи. До лугів відносять гідроксиди лужних елементів і, попри малу розчинність у воді, кальцій гідроксид

Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості оксидів і лугів для прогнозування можливості перебігу реакцій між ними.
В умові завдання наведено хімічні формули вищих кислотних
Кислотні оксиди не реагують між собою. Вони реагують з осно́вними оксидами й лугами. Основні оксиди з лугами не взаємодіють.
Тобто з-поміж наведених у завданні пар речовин реакція відбудеться лише між силіцій(IV)оксидом і натрій гідроксидом:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Способи добування метану й етину.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості простих і складних речовин для прогнозування складу продуктів реакції між ними.
Проаналізувавши варіанти відповіді, можна дійти висновку, що в них ідеться про такі газуваті продукти реакцій між речовинами Х та Y:
A |
сульфур(IV) оксид |
Б |
водень |
B |
метан |
Г |
етин |
Рівняння реакції між магнієм і хлоридною кислотою:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Номенклатура середніх і кислих солей.
Завдання скеровано на перевірку вміння називати середні й кислі солі за систематичною номенклатурою, розрізняти їх за хімічними формулами.
Кислі солі відрізняються від середніх тим, що крім катіона металічного елемента й аніона кислотного залишку містять один чи кілька атомів Гідрогену. У назві їх позначають відповідним префіксом – ди-, три- тощо.
Формула натрій дигідрогенортофосфату –
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння аналізувати й прогнозувати результати дослідження, робити висновки.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк оксид реагує як осно́вний, із лугами – як кислотний.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Унаслідок розчинення у воді магній сульфат дисоціює на йони:
З-поміж аніонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із катіоном Магнію утворюють лише гідроксид-аніони:
З-поміж катіонів, які утворюються внаслідок електролітичної дисоціації речовин, формули яких наведено у варіантах відповіді, осад із сульфат-аніоном утворюють лише катіони Барію:
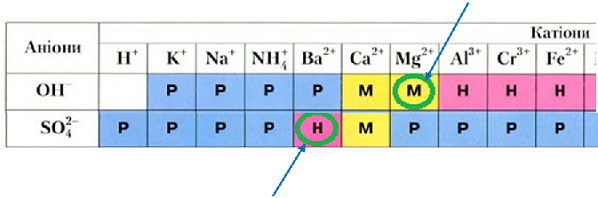
Тобто для підтвердження якісного складу магній сульфату потрібно використати водні розчини натрій гідроксиду і барій хлориду.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.

Ряд активності металів
Порівнявши положення металів у ряду активності, можна дійти висновку, що мідь витіснятиме із солей ртуть (Б), оскільки в ряду активності мідь розташована лівіше:
Активніші метали (барій, магній, нікель), які в ряду активності розташовані лівіше за мідь, вона з розчинів солей витіснити не зможе.
Атомна маса ртуті більша за атомну масу міді, тому маса пластинки збільшилася.

Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною і реагентом.
Пірохімічний аналіз (від грец. πυρо́ς – вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (див. рисунок).
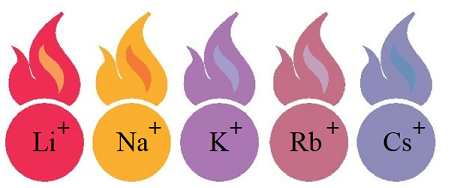
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Калію.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, способів добування амфотерних гідроксидів.
Алюміній в ряду активності металів розташований лівіше від водню і тому витісняє його з хлоридної кислоти:
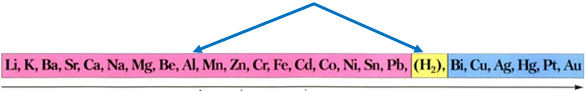
Ряд активності металів
Алюміній гідроксид – нерозчинна у воді сполука, тому його можна добути реакцією обміну між розчинною сіллю Алюмінію і лугом у водному розчині:
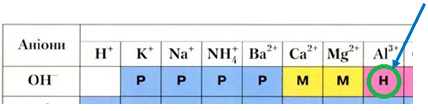
Тобто обидва твердження правильні.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза, способів добування і властивостей сполук Феруму(ІІІ).
1
2
3
4
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Гідроген хлорид.
Завдання скеровано на перевірку вміння застосовувати знання про генетичні зв’язки між класами неорганічних сполук для розв’язування експериментальних задач.
Сильна нелетка сульфатна кислота витісняє летку хлоридну кислоту з її солі:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Сульфатна кислота.
Завдання скеровано на перевірку знань про властивості сульфатної кислоти.
Двохосновна сульфатна кислота є сильним електролітом й утворює середні (сульфати) і кислі (гідрогенсульфати) солі.
Чиста сульфатна кислота – стійка речовина, тому твердження щодо її існування лише у водному розчині неправильне.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Поняття ступінь окиснення, окисно-відновна реакція.
Завдання скеровано на перевірку знання особливостей термічного розкладання солей, розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
A
Б
B
Г
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання амоній нітрату.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Карбон. Алотропія. Карбон(ІІ) оксид.
Завдання скеровано на перевірку знань про алотропні форми Карбону, хімічні властивості карбон(ІІ) оксиду, уміння розпізнавати екзо- й ендотермічні реакції.
В алмазу – алотропної модифікації Карбону – атомні, а не молекулярні кристалічні ґратки.
Ступінь окиснення атома Карбону в карбон(ІІ) оксиді дорівнює +2, а максимальний ступінь окиснення Карбону – елемента IVА групи – становить +4. Тому карбон(ІІ) оксид виявляє відновні властивості, зокрема й в екзотермічній реакції горіння:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура насичених одноатомних спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні одноатомні спирти за систематичною номенклатурою.
Називати спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
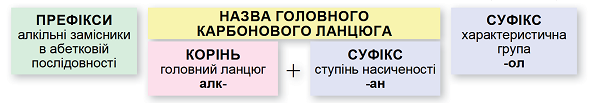
Рис. 1. Алгоритм побудови назв спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то його нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоби замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
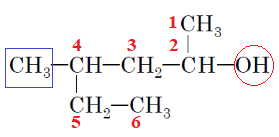
4-метилгексан-2-ол
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани й циклоалкани.
Завдання скеровано на перевірку знання особливостей будови і властивостей представників різних груп вуглеводнів.
Як гексан, так і циклогексан є насиченими вуглеводнями, а тому здатні відщеплювати молекулу водню, тобто вступати в реакцію дегідрування.
Однак у циклогексану
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті цис- транс-ізомерії алкенів.
Вид ізомерії, зумовлений взаємним просторовим розміщенням атомів, називають геометричною ізомерією або цис-, транс-ізомерією (від лат. cis – по цей бік, trans – по різні боки).
Цис-, транс-ізомерія можлива в тому разі, якщо біля атомів Карбону, сполучених подвійним зв’язком, є різні замісники.
Цю умову задовольняє лише варіант відповіді Б (див. рисунок 1).
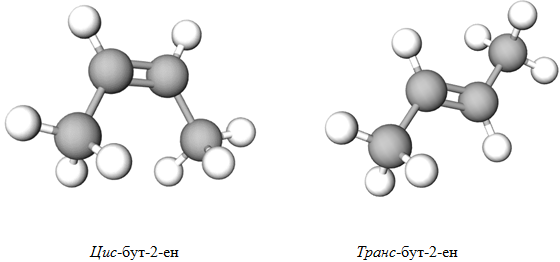
Рис. 1. Геометричні ізометри бут‑1‑ену
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени. Алкіни. Бензен. Якісна реакція на кратний зв’язок.
Пропен, бут-1-ин, бут-2-ен містять кратний зв’язок, за місцем якого можливе приєднання молекули брому. Тому ці ненасичені вуглеводні знебарвлюють бромну воду.
Молекула бензену містить стійке ароматичне кільце, тому приєднання молекули брому в м’яких умовах неможливе. І на відміну від алкенів й алкінів бензен не знебарвлює бромну воду.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація хімічних реакцій в органічній хімії (приєднання, заміщення, відщеплення, ізомеризація).
Завдання скеровано на перевірку вміння розпізнавати хімічні реакції різних типів за їхніми рівняннями.
Під час хімічної реакції (1) молекула бензену приєднує три молекули хлору.
Унаслідок хімічної реакції (2) атом Хлору заміщує атом Гідрогену в молекулі бензену.
Тобто перша реакція – приєднання, а друга – заміщення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Первинні, вторинні, третинні спирти.
Завдання скеровано на перевірку вміння розпізнавати спирти вторинної будови за їхніми структурними формулами.
Первинним є атом Карбону, сполучений з іншим атомом Карбону одним простим зв’язком, вторинним – з’єднаний із двома атомами Карбону двома простими зв’язками, третинним – сполучений із трьома атомами Карбону трьома простими зв’язками.
Залежно від положення гідроксигрупи (її розташування біля первинного, вторинного чи третинного атома Карбону) розрізняють спирти первинної, вторинної, третинної будови.
Умові завдання відповідає спирт, назва якого пропан-2-ол (див. рисунок).
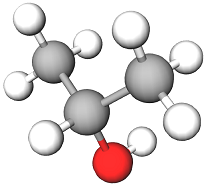
Рис. 1. Модель молекули пропан-2-олу
У варіантах відповіді Б і Г наведено структурні формули спиртів первинної будови, у варіанті В – третинної.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Етанол. Фенол.
Завдання скеровано на перевірку знання властивостей спиртів, розуміння впливу складу й будови речовин на їхні властивості, уміння порівнювати кислотні властивості спиртів і фенолу.
1 етанол виявляє слабші кислотні властивості порівняно з фенолом
Вуглеводневий замісник і характеристична група в молекулі фенолу взаємовпливають. Електрони бензенового кільця вступають у взаємодію з неподіленою електронною парою атома Оксигену, залучають її до своєї сфери й відтягують на себе. Унаслідок цього полярність зв’язку
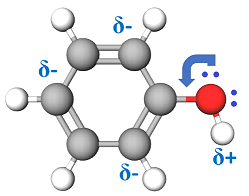
2 водний розчин етанолу не проводить електричний струм, тому не є електролітом
3 продуктом міжмолекулярної дегідратації етанолу є діетиловий етер:
4 етанол є органічним продуктом ферментативного бродіння глюкози:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання класифікації, хімічних властивостей і способів добування найважливіших вуглеводів.
A |
глюкоза й фруктоза не зазнають гідролізу, це моносахариди |
Б |
і крохмаль, і целюлоза – полісахариди, які вступають у реакцію гідролізу |
B |
зміна забарвлення крохмалю на синє внаслідок додавання водно-спиртового розчину йоду – якісна реакція на крохмаль |
Г |
продуктом повного гідролізу крохмалю є глюкоза, а не сахароза |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на деякі органічні сполуки.
Завдання скеровано на перевірку вміння використовувати знання про якісні реакції на альдегіди й багатоатомні спирти для розрізнення органічних сполук.
Гліцерол (A) як багатоатомний спирт реагує з купрум(ІІ) гідроксидом з утворенням яскраво-синього розчину, але без утворення за нагрівання жовтого осаду, бо в молекулі гліцеролу немає альдегідної групи.
У молекулі етаналю (B) немає гідроксильних груп. Як альдегід він за нагрівання реагує з купрум(ІІ) гідроксидом з утворенням жовтого осаду купрум(І) гідроксиду, який після відщеплення молекули води перетворюється на цегляно-червоний купрум(І) оксид.
Етанол (Г) не реагує з купрум(ІІ) гідроксидом.
З-поміж наведених варіантів відповіді умову завдання задовольняє лише глюкоза (Б), яка поєднує в собі властивості багатоатомного спирту й альдегіду, зумовлені характеристичними групами в її молекулі – п’ятьма гідроксильними й альдегідною:
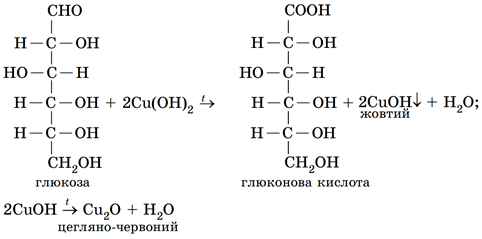
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації і гідролізу естеру, уміння аналізувати склад і будову речовини за її хімічною формулою.
Речовини, структурні формули яких наведено в умові завдання, належать до естерів і є продуктами реакції між відповідними спиртами й карбоновими кислотами. Загальну формулу естерів наведено на рисунку 1.
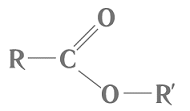
Рис. 1. Загальна формула естерів
Структурні формули етанової і пропанової кислот, метанолу й етанолу зображено на рисунку 2.
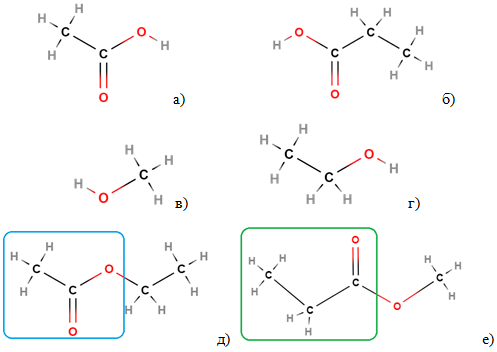
Рис. 2. Структурні формули етанової (а) і пропанової кислот (б), метанолу (в) й етанолу (г), етилетаноату (д) і метилпропаноату (е)
Вочевидь єдиним правильним твердженням із-поміж наведених є те, що етанова кислота – продукт кислотного гідролізу лише речовини 1 – етилетаноату.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісна реакція на подвійний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини й застосовувати знання про якісну реакцію на подвійний зв’язок для доведення його наявності в молекулі.
Якісна реакція на подвійний зв’язок полягає в знебарвленні бромної води, зумовленому приєднанням молекули брому за місцем подвійного зв’язку:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості амінів для пояснення результатів дослідів.
Аміни — органічні основи. У водних розчинах насичених амінів, наприклад, метанаміну (метиламіну), фенолфталеїн набуває малинового забарвлення, що свідчить про лужне середовище (рис. 1).
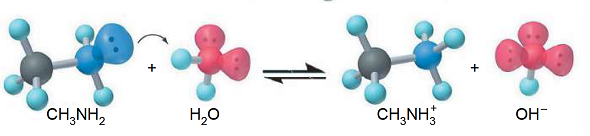
Рис. 1. Схема утворення катіонів метанамонію
і гідроксид-аніонів
Ще одним підтвердженням осно́вної природи амінів є їхня взаємодія з кислотами:
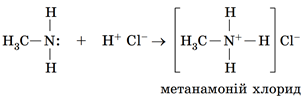
Тож якщо до отвору газовідвідної трубки, із якої виходить метиламін, піднести скляну паличку, змочену хлоридною кислотою, утвориться «дим без вогню» – біла хмаринка з дрібних кристаликів солі.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Синтетичні високомолекулярні органічні. речовини й полімерні матеріали на їхній основі
Завдання скеровано на перевірку вміння пояснювати суть поняття мономер.
Структурну формулу мономера полівінілхлориду наведено у варіанті відповіді A (рис. 1).
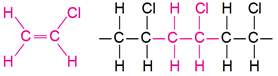
Рис. 1. Структурні формули вінілхлориду (а) і фрагмента полімерного ланцюга полівінілхлориду (б)
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння аналізувати склад і будову молекул органічних сполук за їхніми структурними формулами.
A |
і в молекулі речовини 1, і в молекулі речовини 2 є гідроксильна група |
Б |
речовина 1 є фенолом, а речовина 2 – ароматичним спиртом |
B |
фенол 1, так само як і ароматична карбонова кислота 3 реагують із натрій гідроксидом |
Г |
ароматична карбонова кислота 3 є продуктом гідролізу естеру 4, молекула якого утворена залишками молекул цієї кислоти й метанолу |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, відновлення як процес приєднання електронів, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і складних йонів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Відновлення – процес приєднання електронів окисником.
1
2
3
4
Відповідь: 1В, 2А, 3Г, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Властивості неорганічних речовин, генетичні зв’язки між ними.
Завдання скеровано на перевірку розуміння фізичного змісту закону збереження маси речовин у хімічних реакціях, уміння застосовувати знання про генетичні зв’язки між різними класами неорганічних сполук для складання рівнянь реакцій за їхньої участі.
Із кальцій оксидом із-поміж речовин А–Д можуть реагувати карбон(ІV) оксид і вода. Однак реакція, схему якої наведено, належить до реакцій сполучення. Тобто речовиною 1 може бути лише вода, а речовиною 2, відповідно, кальцій гідроксид.
Оскільки вода 1 є продуктом реакції обміну між речовинами 2 і 3, можна дійти висновку, що речовиною 3 є карбон(ІV) оксид, а речовиною 4 – кальцій карбонат.
Унаслідок термічного розкладання кальцій карбонату утворюються кальцій оксид і карбон(ІV) оксид.
Відповідь: 1Д, 2А, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація органічних сполук.
Завдання скеровано на перевірку вміння аналізувати хімічний склад органічних речовин за їхніми структурними формулами, застосовувати знання характеристичних (функціональних) груп для класифікації органічних сполук.
Щодо варіантів відповіді:
1 карбоксильна група
2 альдегідна група
3 гідроксильна група
4 аміногрупа
Відповідь: 1Д, 2Г, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку розуміння суті класифікації хімічних реакцій за участі органічних речовин.
1 унаслідок відщеплення молекули водню від молекули пропану утворюється молекула пропену
2 унаслідок заміщення атома Гідрогену в молекулі етану утворюється молекула бромоетану
3 унаслідок приєднання молекули гідроген броміду до молекули пропену утворюється молекула 2-бромопропану
4 унаслідок ізомеризації гексану утворюється 2,2-диметилбутан
Відповідь: 1Г, 2А, 3Б, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Способи добування органічних речовин, генетичні зв’язки між ними.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
1 етанол добувають гідратацією етену (A):
2 фенол добувають гідролізом хлоробензену (Б):
3 анілін добувають відновленням нітробензену (Д):
4 етин добувають гідролізом кальцій карбіду (B):
Відповідь: 1А, 2Б, 3Д, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії і вміння аналізувати хімічний склад органічних речовин за їхніми структурними формулами.
Ізомери – речовини з однаковою молекулярною формулою, але різною будовою молекул.
1 ізомером бутанової кислоти
2 ізомером бутан-1-олу
3 ізомером бут-1-ену
4 ізомером бутану
Відповідь: 1А, 2В, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку елемента в речовині за її хімічною формулою.
Дано:
Знайти:
Відповідь: 35.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
Знайти:
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 126.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 845.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 16.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати хімічну формулу речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
Дано:
Знайти:
Відповідь: 15.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів:
Відповідь: 38.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 96.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 60.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 40.
Знайшли помилку? Пишіть на




