ЗНО онлайн 2020 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2020 року з хімії
ТЕМА: Основні хімічні поняття. Хімічна і графічна (структурна) формули.
Завдання скеровано на перевірку розуміння молекулярної і структурної формул, якісного і кількісного складу речовин.
Для виконання завдання необхідно розуміти, що карбонові кислоти й естери – це різні класи органічних сполук. Однакова молекулярна формула вказує на те, що ці речовини ізомерні одна одній.
Ізомери – речовини, які мають однаковий склад, але різну будову, а тому різні властивості. Тому в цих речовин може бути лише однакова молекулярна маса.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні поняття. Речовина.
Завдання скеровано на перевірку знання і розуміння понять молекула, проста речовина, хімічний елемент.
Для виконання завдання необхідно знати, що молекули простих речовин складаються з атомів одного хімічного елемента. За умовними позначеннями атомів хімічних елементів необхідно проаналізувати рисунки, на яких схематично зображено суміші молекул.
На рисунках відповідей А і Б зображено суміш простих і складних речовин, а це не відповідає умові завдання. На рисунках відповідей В і Г зображено суміш простих речовин, але лише на рисунку відповіді В зображено суміш молекул простих речовин одного хімічного елемента.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома і простих йонів.
Завдання скеровано на перевірку знання будови атома й складу простих йонів, розуміння того, чим за складом ядер відрізняються атоми хімічних елементів.
Для виконання завдання необхідно розуміти, що атоми хімічних елементів відрізняються кількістю протонів у ядрах. Аналіз інформації, поданої в таблиці, показує, що наведено склад ядер атомів чотирьох хімічних елементів із протонними числами 7, 8, 9, 10. Отже, у завданні описано склад ядер атомів чотирьох хімічних елементів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку розуміння поняття нуклідний символ, уміння визначати за нуклідним символом склад ядра атома.
Нуклідний символ включає символьне позначення хімічного елемента з протонним і нуклонним числом.
Нуклідний символ:
Для визначення кількості нейтронів від нуклонного числа (відносна атомна маса) необхідно відняти протонне число (порядковий номер). Однакову різницю між цими числами наведено лише в рядку A.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на розуміння понятть нуклідний символ, йон.
В атомі кількість електронів збігається з протонним числом
Для аніона:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати ступінь окиснення елементів у речовині.
Зазвичай ступінь окиснення Натрію в сполуках дорівнює +1, а Оксигену – -2. Ураховуючи, що речовина електронейтральна, складаємо алгебраїчне рівняння й визначаємо ступінь окиснення Брому
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку знання типів хімічного зв’язку й уміння визначати тип зв’язку за формулами.
Для виконання завдання необхідно знати, між якими елементами може утворитися йонний зв’язок і визначити за формулами цей зв'язок.
Йонний зв'язок – зв'язок між йонами. Йони – заряджені частинки, на які перетворюються атоми хімічних елементів, що значно відрізняються за електронегативністю (ЕН). ЕН – здатність атома елемента притягувати електрони від атомів інших елементів, у періодах і групах змінюється так само, як неметалічні властивості. Зазвичай найбільша різниця в ЕН між металами і неметалами, тому достатньо проаналізувати, у якому рядку зазначено сполуки металічних і неметалічних елементів.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Хімічна рівновага. Принцип Ле Шательє.
Завдання скеровано на перевірку знання понять оборотна реакція, хімічна рівновага й розуміння впливу різних чинників на хімічну рівновагу.
Хімічна рівновага – стан, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічна рівновага є динамічною. На зміщення рівноваги впливає концентрація реагентів і продуктів реакції, тиск і температура. Вплив цих чинників описує принцип Ле Шательє: якщо змінити одну з умов, за якої система перебуває в рівновазі (концентрацію, тиск або температуру), то рівновага зміщується в бік тієї реакції, яка протидіє цій зміні. Відповідно до принципу Ле Шательє, підвищення тиску зміщує рівновагу в бік менших об’ємів (тиск знижується), а зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується); підвищення температури зміщує рівновагу в бік ендотермічної реакції (температура знижується), а зниження температури зміщує рівновагу в бік екзотермічної реакції (температура підвищується); збільшення концентрації реагентів зміщує рівновагу в бік продуктів реакції.
У завданні необхідно визначити, як змінити тиск і температуру для зміщення рівноваги в бік утворення метанолу (пряма реакція).
Проаналізуймо рівняння оборотної реакції, наведеної в завданні. Пряма реакція (утворення метанолу) супроводжується зменшенням тиску (із трьох об’ємів газів утворюється один, об’єм зменшується) і підвищенням температури (екзотермічна реакція,
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Хімічна рівновага. Принцип Ле Шательє.
Завдання скеровано на перевірку знання понять оборотна реакція, хімічна рівновага й розуміння впливу різних чинників на хімічну рівновагу.
Оборотна реакція – це реакція, яка відбувається в прямому і зворотному напрямках. Хімічна рівновага – стан, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічна рівновага є динамічною. На зміщення рівноваги впливає концентрація реагентів і продуктів реакції, тиск і температура. Вплив цих чинників описує принцип Ле Шательє: якщо змінити одну з умов, за якої система перебуває в рівновазі (концентрацію, тиск або температуру), то рівновага зміщується в бік тієї реакції, яка протидіє цій зміні. Відповідно до принципу Ле Шательє, підвищення тиску зміщує рівновагу в бік менших об’ємів (тиск знижується), а зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується); підвищення температури зміщує рівновагу в бік ендотермічної реакції (температура знижується), а зниження температури зміщує рівновагу в бік екзотермічної реакції (температура підвищується); збільшення концентрації реагентів зміщує рівновагу в бік продуктів реакції.
За умовою завдання необхідно проаналізувати рівняння оборотних реакцій і вказати рівняння реакції, у якій зниження тиску зумовить зміщення хімічної рівноваги праворуч, тобто в бік прямої реакції. Відповідно до принципу Ле Шательє, зниження тиску зміщує рівновагу в бік більших об’ємів (тиск підвищується).
Отже, необхідно визначити, у якій оборотній реакції пряма реакція відбувається зі збільшенням об’ємів.
Лише в оборотній реакції
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Гальванічний елемент.
Завдання скеровано на перевірку розуміння принципу роботи гальванічного елемента.
Гальванічний елемент – хімічне джерело електричного струму (енергія хімічної реакції перетворюється в електричну енергію).
Проаналізуємо, як працює гальванічний елемент, схему якого наведено в завданні. Електроди (заряджені стержні) виготовлені з металів цинку й міді, занурені в розчини їхніх солей і поєднані електролітним містком. Електроди з’єднані гальванометром. Цинк активніший за мідь, тому є анодом, а мідь – катодом. Анод окиснюється:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати ступінь окиснення елементів у речовині.
Зазвичай як ступінь окиснення Натрію, так і Гідрогену в сполуках становить +1, а Оксигену – -2. Ураховуючи, що речовина електронейтральна, складаємо алгебраїчне рівняння і визначаємо ступінь окиснення елемента в сполуці
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші речовин. Розчини. Гідроліз солей.
Завдання скеровано на перевірку знання гідролізу солей.
Для виконання завдання необхідно знати поняття гідроліз і розуміти, за яким йоном у водному розчині сіль зазнає гідролізу.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном, реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається дисоціація, реакція середовища – нейтральна.
Проаналізуємо, якою основою і кислотою утворена кожна сіль:
| Назва солі | Сіль утворено | Гідролізує за | ||
| основою | кислотою | |||
A |
алюміній хлорид | слабкою | сильною | катіоном |
Б |
амоній карбонат | слабкою | слабкою | катіоном |
B |
амоній сульфат | слабкою | сильною | катіоном |
Г |
натрій сульфід | сильною | слабкою | аніоном |
У водному розчині зазнає гідролізу як за катіоном, так і за аніоном амоній карбонат.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини. Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку розуміння реакцій йонного обміну, якісне виявлення катіонів Ферум(3+).
Для виконання завдання необхідно знати, що осадити катіон можна аніоном, і вміти користуватися таблицею розчинності.
Проаналізуємо запропоновані водні розчини на вміст аніонів і за допомогою таблиці розчинності визначимо, який саме аніон з катіоном
| Катіон | |||
| Аніон | |||
A |
p | ||
Б |
н | ||
B |
p | ||
Г |
p | ||
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини. Гідроліз солей.
Завдання скеровано на перевірку розуміння процесу гідролізу солей і вміння визначати середовище водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз, розуміти як визначити середовище водного розчину солі.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном – реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається електролітична дисоціація, реакція середовища – нейтральна.
Проаналізуємо, якою основою і кислотою утворена кожна сіль, і визначимо реакцію середовища:
Зіставляємо визначене середовище водного розчину солі з варіантами відповідей.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. рН розчинів.
Завдання скеровано на перевірку розуміння процесу гідролізу солей і вміння визначати середовище водного розчину солі залежно від того, якими електролітами утворена сіль, знання значень рН для кожного середовища.
Для виконання завдання необхідно знати, що таке гідроліз, розуміти, як визначити середовище водного розчину солі, знати значення рН для кожного середовища.
Гідроліз – це реакція обміну між сіллю і водою. Якщо сіль утворена слабкою основою і сильною кислотою, то гідроліз відбувається за катіоном, у такому разі реакція середовища кисла; якщо сильною основою і слабкою кислотою , то – за аніоном, реакція середовища – лужна; якщо слабкою основою і слабкою кислотою, то – як за катіоном, так і за аніоном, реакція середовища може бути нейтральною; якщо сильною кислотою і сильною основою, то гідроліз не відбувається, відбувається електролітична дисоціація, реакція середовища – нейтральна.
| Середовище розчину солі | Значення рН |
| нейтральне | рН = 7 |
| кисле | рН < 7 |
| лужне | рН > 7 |
Аналізуємо твердження:
І. Водний розчин
ІІ. Водний розчин
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали. Солі.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Метал реагує із сіллю, якщо він активніший за той метал, який входить до складу солі. Для порівняння активності металів користуємося рядом активності металів (таблиця 4 тестового зошита). За умовою завдання одна з пластинок виготовлена з кадмію, а інша – з міді. Пластинки занурили у водний розчин плюмбум(ІІ) етаноату. Порівняємо активність металів. Кадмій активніший за свинець, тому реагуватиме із сіллю, мідь – менш активний метал порівняно зі свинцем, тому із сіллю не реагує. Унаслідок взаємодії металу з розчином солі маса металу (пластинки) змінюється, тому що відносні атомні маси різних металів різні. В умові зазначено, що змінилася маса лише пластинки, виготовленої з металу Х, тому Х – кадмій, тоді Y – мідь. Отже, твердження ІІ правильне. Проаналізуємо, як зміниться маса пластинки, виготовленої з кадмію. Напишемо рівняння реакції кадмію з плюмбум(ІІ) етаноатом:
Порівняємо відносні атомні маси кадмію і свинцю:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали. Солі.
Завдання скеровано на перевірку знання хімічних властивостей металів.
Метал може відновлювати катіони металів або протон (катіон Гідрогену), якщо він активніший за той метал, який утворює катіон, або активніший за катіон Гідрогену.
Для порівняння активності металів користуємося рядом активності металів (таблиця 4 тестового зошита). За умовою завдання необхідно вказати катіон, який цинк не може відновити. Скориставшись рядом активності металів, визначаємо, що цинк у ньому розташований лівіше від міді, срібла й водню, тому може відновити відповідні йони з водного розчину. Проте, цинк менш активний, ніж магній, тому не відновлює катіони цього металу з водного розчину.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини. Гідроліз солей. Загальні відомості про неметалічні елементи й неметали. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання властивостей основних класів неорганічних сполук, розуміння процесу гідролізу солей і вміння визначати середовища водного розчину солі залежно від того, якими електролітами утворена сіль.
Для виконання завдання необхідно знати, що таке гідроліз; розуміти, як визначити середовище водного розчину солі.
Проаналізуємо склад розчину кожної речовини й визначимо реакцію середовища.
1 – сульфур(IV) оксид (
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Амфотерні сполуки.
Завдання скеровано на перевірку знання про амфотерні сполуки.
Для виконання завдання необхідно знати, які металічні елементи можуть утворювати амфотерні сполуки.
Із запропонованих варіантів відповіді лише алюміній гідроксид і цинк гідроксид виявляють амфотерні властивості.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Для виконання завдання необхідно знати, за яких умов відбуваються реакції обміну між електролітами в розчинах.
Проаналізуємо описані в завданні досліди й зіставимо їх із варіантами відповіді.
У першій пробірці після добавляння до розчину речовини Х розчину барій нітрату утворився осад:
У другій пробірці після добавляння до розчину речовини Х розчину натрій гідроксиду також утворюється осад:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про неметалічні елементи й неметали.
Завдання скеровано на перевірку вміння порівнювати фізичні й хімічні властивості неметалів, оксидів неметалічних елементів.
Для виконання завдання необхідно знати якісну реакцію на карбон(ІV) оксид.
Реактивом на карбон(ІV) оксид, який належить до кислотних, є вапняна вода (насичений розчин кальцій гідроксиду). Карбон(ІV) оксид із вапняною водою утворює осад білого кольору (
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Теоретичні основи органічної хімії. Вуглеводні. Алкани.
Завдання скеровано на перевірку знання елементів-органогенів для розпізнавання органічної сполуки за її складом.
Для виконання завдання необхідно знати, що одним з елементів-органогенів є Карбон, який є складником усіх органічних речовин.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Алкани. Номенклатура алканів.
Завдання скеровано на перевірку знання номенклатури IUPAC.
Для виконання завдання необхідно знати номенклатуру IUPAC і вміти за її правилами назвати речовину.
Речовина належить до класу оксигеновмісних сполук – одноатомних насичених спиртів.
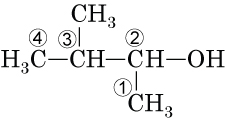
Вибираємо найдовший карбоновий ланцюг, нумеруємо атоми Карбону так, щоби атом Карбону, сполучений із характеристичною групою
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії.
Завдання скеровано на перевірку вміння за фізичними властивостями визначати агрегатний стан речовини за певних умов.
Для виконання завдання потрібно проаналізувати температури плавлення речовин. За температури –90 °C у твердому стані буде перебуватиме речовина, температура плавлення якої вища за температуру –90 °C. З-поміж наведених це температура –80 °C.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Оксигеновмісні органічні сполуки. Спирти. Феноли.
Завдання скеровано на перевірку знання класів органічних сполук, а саме спиртів і фенолів; уміння за структурною формулою визначати як належність речовини до певного класу сполук, так і її найпростішу формулу.
Проаналізуємо твердження:
І. Проаналізувавши структурну формулу речовини, доходимо висновку, що в її молекулі дві гідроксильні групи безпосередньо сполучені з бензеновим кільцем, тому ця сполука – двоатомний фенол. Тобто твердження I неправильне.
ІІ. За структурною формулою визначаємо молекулярну формулу речовини:
Тобто правильна відповідь – Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Номенклатура.
Завдання скеровано на перевірку знання поняття ізомери та вміння визначати структурні ізомери за назвою речовини відповідно до номенклатури IUPAC.
Для виконання завдання необхідно за назвою зобразити або уявити структурні формули речовин і порівняти їх.
Ізомери – це речовини, які мають однаковий склад, але різну будову, а тому різні властивості.
Проаналізуємо кожну пару речовин.
A пропан (
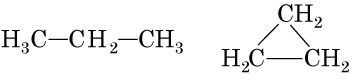
Б бутан (
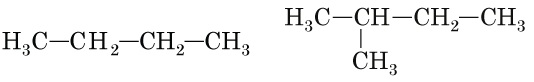
B бут-1-ен (
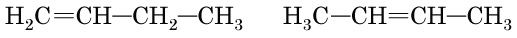
Г пропен (
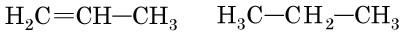
Отже, правильна відповідь – B.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання хімічних властивостей одноатомних насичених спиртів, а саме реакції міжмолекулярної дегідратації спиртів.
Унаслідок міжмолекулярної дегідратації етанолу утворюється діетиловий етер:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Теоретичні основи органічної хімії.
Завдання скеровано на перевірку знання хімічних властивостей ароматичних вуглеводнів на прикладі бензену й фенолів на прикладі фенолу.
Для виконання завдання достатньо знати хімічні властивості бензену й фенолу.
Помилковим є твердження «Бензен реагує з бромною водою».
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні.
Завдання скеровано на перевірку знання структури бензену й циклогексану.
Для виконання завдання достатньо зобразити структурні й написати молекулярні формули речовин.
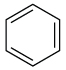 |
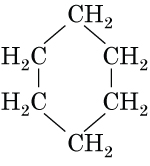 |
| бензен | циклогексан |
Знаючи структурні й молекулярні формули речовин, проаналізуємо твердження.
І. Бензен належить до вуглеводнів циклічної будови. Правильне твердження.
ІІ. Бензен і циклогексан є структурними ізомерами. Неправильне твердження, молекулярні формули речовин різні, тому вони не можуть бути структурними ізомерами.
Тому правильна відповідь – А.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання класифікації спиртів за кількістю гідроксильних груп.
Триатомні спирти містять три гідроксильні групи. Із запропонованих варіантів три гідроксильні групи містять структурні формули В і Г, але в структурній формулі речовини В гідроксильні групи безпосередньо сполучені з бензеновим кільцем, тому це триатомний фенол, а за умовою завдання має бути спирт.
Отже, правильна відповідь – Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання якісної реакції на багатоатомні спирти.
Для виконання завдання необхідно знати, що реактивом на багатоатомні спирти є свіжоосаджений купрум(ІІ) сульфат. Саме багатоатомні спирти з купрум(ІІ) сульфат. З ним багатоатомні спирти утворюють прозорий розчин темно-синього кольору.
Реакція натрій гідроксиду з купрум(ІІ) сульфатом (утворення свіжоосадженого купрум(ІІ) гідроксиду):
Із запропонованих варіантів відповіді лише пропан-1,2-діол із купрум(ІІ) гідроксидом утворює прозорий розчин темно-синього кольору:
пропан-1,2-діол +
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання класифікації вуглеводів, і вміння розрізняти представників полісахаридів.
Для виконання завдання необхідно знати, що із запропонованих речовин до полісахаридів належать лише крохмаль і целюлоза.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання способу добування аніліну.
Для виконання завдання необхідно знати, що одним зі способів добування амінів є відновлення нітросполук.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку знання добування та хімічних властивостей алкінів, способів добування алкінів й альдегідів.
Унаслідок гідролізу кальцій ацетиленіду утворюється етин, а внаслідок його гідратації – етаналь. Отже, назва речовини X у схемі перетворень – етаналь.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Суміші речовин. Розчини.
Завдання скеровано на перевірку вміння аналізувати табличні дані й зіставляти їх із текстовою частиною завдання.
Проаналізуємо табличні дані й зіставимо їх із реченнями, щоб утворилося правильне твердження.
1. З підвищенням температури розчинність речовини … зменшується. Із даних таблиці видно, що лише розчинність речовини Г з підвищенням температури зменшується. Отже, 1Г.
2. За температури 40 °С в насиченому розчині речовини … її маса більша, ніж маса розчинника. Із даних таблиці видно, що за температури 40 °С лише маса речовини Б більша, ніж маса розчинника. Отже, 2Б.
3. Максимальна маса речовини …, яку можна розчинити у воді масою 150 г за температури 20 °С, становить 47,4 г. Маса води в 1,5 раза більше за наведену в таблиці масу води (розчинника), тому й маса солі має бути в 1,5 раза більше за масу розчиненої речовини і становитиме 47,4 г. Із даних таблиці зрозуміло, що за температури 20 °С речовини Б, Г, Д не задовольняють умову завдання (Г і Д набагато менше за вказану масу, Б набагато більше за вказану масу). Для речовини В 1,5 m(речовини) = 1,5 · 36 = 54, не задовольняє умову. Для речовини А 1,5 m(речовини) = 1,5 · 31,6 = 47,4 г, задовольняє умову. Отже, 3А.
Відповідь: 1Г, 2Б, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Феноли. Альдегіди.
Завдання скеровано на перевірку знання функціональних (характеристичних) груп і розуміння належності органічної сполуки до того чи іншого класу сполук.
Для виконання завдання необхідно знати характеристичні групи спиртів і альдегідів, визначення фенолів.
Альдегіди – органічні сполуки, які містять характеристичну (функціональну) групу 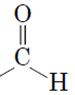 ;
;
феноли – це органічні сполуки, у яких гідроксильна група безпосередньо сполучена з бензеновим кільцем 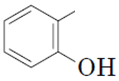 ;
;
спирти – органічні сполуки, у яких гідроксильна група сполучена з вуглеводневим замісником 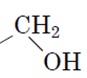 .
.
Відповідь: 1В, 2Д, 3Г.
Знайшли помилку? Пишіть на
ТЕМА: Теоретичні основи органічної хімії. Вуглеводні. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку знання типів хімічних реакцій за участю органічних сполук.
Для виконання завдання необхідно правильно визначити тип хімічної реакції.
Проаналізуємо схеми перетворення і визначимо тип хімічної реакції:
1 схема: з етену добути бромоетан (із ненасиченого вуглеводню добути моногалогенонасичений вуглеводень) – реакція приєднання, тому 1Г;
2 схема: з бромоетану добути етанол (із моногалогенонасиченого вуглеводню добути спирт) – реакція заміщення, тому 2Д;
3 схема: з етанолу добути етен (зі спирту добути алкен) – реакція відщеплення, тому 3Б.
Відповідь: 1Г, 2Д, 3Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів.
У завданні необхідно доповнити кожне речення так, щоб утворилося правильне твердження.
Проаналізуємо речення і встановимо відповідність.
1. Ізомери – речовини, які мають однаковий склад, але різну будову, а тому різні властивості, тобто «Продуктом ізомеризації бутану є речовина Б».
2. З бромною водою можуть реагувати речовини, які мають кратний зв'язок (подвійний чи потрійний), тож «З бромною водою реагує як речовина В, так і речовина Г».
3. Масова частка елементів у різних речовин може бути однаковою, якщо якісний склад однаковий, а індекси в хімічній формулі, що відображають кількісний склад, кратні тому самому числу. Тому «Масова частка Карбону в речовині Г (
Відповідь: 1Б, 2Г, 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Розв’язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за об’ємом, який вона має за нормальних умов:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Розв'язування задач за хімічними формулами і на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати масу певної кількості речовини:
Відповідь: 400.
Знайшли помилку? Пишіть на
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати об’єм (н.у.) газуватої речовини за певною кількістю (моль) атомів елемента – її складника.
1) обчислюємо кількість речовини атомів Нітрогену, яка дана за умовою завдання:
2) з атомів Нітрогену кількістю речовини 2 моль утворюється азот кількістю речовини 1 моль. Визначаємо кількість речовини азоту:
3) обчислюємо об’єм азоту:
Відповідь: 56.
Знайшли помилку? Пишіть на
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини й виводити молекулярну формулу сполуки за співвідношенням мас елементів.
1) обчислюємо молярну масу аскорбінової кислоти:
2) зі співвідношення мас визначаємо
Якщо
3)
4) сума індексів дорівнює 20.
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Розв'язування задач за хімічними формулами й на виведення формули сполуки.
Завдання скеровано на перевірку вміння обчислювати відносну густину газової суміші за її об’ємним складом.
Для виконання завдання необхідно знати, що таке відносна густина й розуміти, що об’ємна й мольна частка газуватих речовин рівні між собою.
1) нехай
2) обчислюємо масу кожної речовини й масу всієї суміші:
3) обчислюємо відносну густину суміші:
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Вираження кількісного складу розчину (суміші).
Завдання скеровано на перевірку вміння обчислювати масову частку речовини в розчині.
Для виконання завдання необхідно знати формулу для обчислення масової частки речовини в розчині.
Відповідь: 15.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Вираження кількісного складу розчину (суміші). Масова частка розчиненої речовини. Розв’язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння здійснювати розрахунки за рівняннями хімічних реакцій та обчислювати склад розчину.
1) натрій оксид реагує з водою з утворенням лугу. Обчислюємо кількість речовини й масу натрій гідроксиду, який утворюється внаслідок реакції:
2) обчислюємо масу розчину і масу води:
Відповідь: 258.
Знайшли помилку? Пишіть на
ТЕМА: Хімічна реакція. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння використовувати метод електронного балансу для перетворення схеми окисно-відновної реакції на хімічне рівняння.
Визначимо ступені окиснення елементів, що змінюються, складемо електронний баланс і перетворимо схему окисно-відновної реакції на хімічне рівняння:
Обчислюємо суму коефіцієнтів у рівнянні реакції: 22.
Відповідь: 22.
Знайшли помилку? Пишіть на
ТЕМА: Вираження кількісного складу розчину (суміші). Розв'язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі за рівняннями хімічних реакцій і визначати склад суміші.
1) компоненти суміші реагують із хлоридною кислотою, але газ виділяється лише внаслідок взаємодії магній карбонату з хлоридною кислотою.
Для розрахунку за рівнянням хімічної реакції обчислюємо кількість речовини карбон(ІV) оксиду, а за рівнянням реакції обчислюємо кількість речовини магній карбонату:
2) обчислюємо масу магній карбонату:
3) обчислюємо масову частку магній карбонату в суміші:
Відповідь: 42.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв'язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння проводити розрахунки за рівняннями хімічних реакцій, якщо відома маса продукту реакції й відносний вихід.
Унаслідок каталітичної гідратації етену утворюється етанол. За умовою задачі дано масу етанолу й відносний вихід продукту реакції.
1) Обчислюємо теоретичну масу і кількість речовини етанолу:
2) за рівнянням хімічної реакції обчислюємо кількість речовини етену, який вступає в реакцію, унаслідок якої утворюється етанол кількістю речовини 5 моль:
3) Обчислюємо об’ємну частку азоту в газуватій суміші, що утворилася:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв'язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння обчислювати за рівнянням хімічної реакції відносний вихід продукту реакції.
Для виконання завдання необхідно розуміти, як здійснювати розрахунки за рівняннями оборотних реакцій.
1) за рівнянням реакції визначаємо мольні співвідношення реагентів:
З азоту кількістю речовини 1 моль утворюється амоніак кількістю речовини 2 моль, тому з азоту об’ємом 25 л утворився амоніак об’ємом 50 л:
2) за умовою задачі відносний вихід амоніаку становить 20 %, обчислюємо практичний об’єм амоніаку:
3) за рівнянням хімічної реакції обчислюємо об’єми азоту і водню, які витратили на добування 10 л амоніаку:
4) обчислюємо об’єм азоту, який залишився після реакції, й об’єм суміші після реакції:
5)
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння здійснювати розрахунки за рівняннями хімічних реакцій.
У водному розчині карбонати перетворюються на гідрогенкарбонати.
1) обчислюємо об’єм карбон(ІV) оксиду, який прореагував з карбонатами:
2) записуємо рівняння реакцій, унаслідок яких карбонати перетворюються на гідрогенкарбонати:
Нехай під час повного перетворення у водному розчині карбонатів на гідрогенкарбонати в реакцію (1) вступає карбон(ІV) оксид кількістю речовини х моль , тоді в реакцію (2) – карбон(ІV) оксид кількістю речовини (0,1 – х) моль.
3) за умовою задачі маса суміші карбонатів становила 9,2 г.
Складаємо алгебричне рівняння й обчислюємо
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач за рівняннями реакцій.
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі на визначення складу суміші.
1. За умовою задачі об’єм газуватої суміші становив 50 мл. Нехай
2. Записуємо рівняння реакцій горіння метану й етану. За рівнянням (1) і (2) реакцій відповідно до закону об’ємних відношень газів визначаємо об’єм карбон(ІV) оксиду в кожній реакції.
3. Загальний об'єм карбон(ІV) оксиду, що утворився, становить 60 мл.
Складаємо алгебричне рівняння і розв'язуємо його:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розв’язування задач на виведення формули сполуки.
Завдання скеровано на перевірку вміння встановлювати формулу сполуки.
1) нехай формула вуглеводню
2) за умовою задачі вуглекислий газ, який утворився внаслідок спалювання вуглеводню, і кисень, що не прореагував, пропустили крізь водний розчин лугу, узятого в надлишку. Унаслідок цього об’єм газової суміші зменшився до 30 мл. Це означає, що в суміші був вуглекислий газ об’ємом 20 мл і кисень об’ємом 30 мл. Можна обчислити об’єм кисню, який витратили на реакцію горіння:
3) записуємо рівняння реакції горіння вуглеводню з урахуванням того, що кількість атомів Карбону – 2, а об’єм кисню, який витратили за реакцію, становить 30 мл:
Формула вуглеводню:
Відповідь: 28.
Знайшли помилку? Пишіть на




