ЗНО онлайн 2020 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2020 року з хімії
ТЕМА: Основні хімічні поняття. Речовина.
Завдання скеровано на перевірку вміння розрізняти прості й складні речовини, інтерпретувати інформацію, наведену в графічній формі.
Прості речовини утворено атомами одного хімічного елемента, а складні – атомами різних хімічних елементів.
Проаналізувавши наведені в умові завдання рисунки, можна дійти висновку, що на них зображено молекули складу:
A |
|
Б |
|
B |
|
Г |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількістю нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Умову завдання задовольняє варіант відповіді Г:
у нукліді
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку знання складу атома й розуміння причини його електронейтральності.
Атом є електрично нейтральною частинкою, що складається з позитивно зарядженого ядра, яке практично визначає його масу (понад 99,9 %), й електронів, що оточують ядро й визначають розміри атома.
Протони й електрони – частинки, заряди яких однакові за абсолютною величиною і протилежні за знаком, нейтрони – електронейтральні.
Тому для визначення електронейтральної частинки потрібно вибрати в таблиці рядок, у якому описано склад частинки з однаковою кількістю протонів й електронів.
Цю умову задовольняє частинка, склад якої описано в рядку Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває у стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
Проаналізувавши наведене в умові завдання рівняння реакції
можна дійти висновку, що перебіг прямої реакції – синтезу сульфур(VI) оксиду – відбувається з виділенням теплової енергії (
Тобто підвищення температури має бути компенсоване зміщенням хімічної рівноваги вліво, адже розкладання сульфур(VI) оксиду – ендотермічний процес, під час якого теплота поглинається.
Щодо інших варіантів відповіді:
А з огляду на мольні (а отже й об’ємні) відношення газів підвищення тиску зміщуватиме хімічну рівновагу праворуч. Адже тиск сульфур(IV) оксиду й кисню сумарною кількістю речовини 3 моль вищий за тиск сульфур(VI) оксиду, кількість речовини якого за рівнянням реакції становить 2 моль;
В, Г збільшення концентрації кисню або сульфур(IV) оксиду приведе до зміщення хімічної рівноваги праворуч, адже під час прямої реакції ці гази реагують між собою, тобто їхня концентрація зменшується.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Хімічний зв’язок. Обмінний і донорно-акцепторний механізми утворення ковалентних зв’язків.
Завдання скеровано на перевірку знання формули йона амонію, розуміння відмінності між способами утворення ковалентного зв’язку за обмінним і донорно-акцепторним механізмами, уміння визначати ступені окиснення хімічних елементів за формулою речовини чи йона.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Гідроген у сполуках із неметалічними елементами має ступінь окиснення
Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона
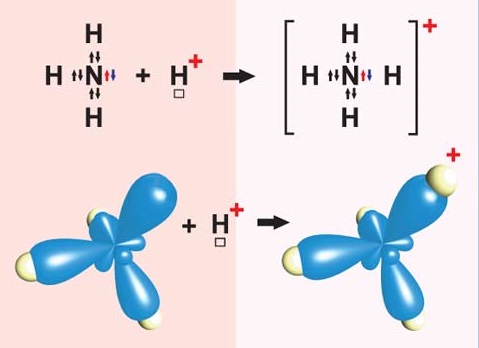
Рис. 1. Утворення катіона амонію
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння інтерпретувати інформацію, подану в графічній формі, застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Згідно з принципом Ле Шательє система, що перебуває у стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши дію цього впливу.
Проаналізувавши графіки залежності об’ємної частки (%) продукту реакції в рівноважній газуватій суміші від температури за різних значень тиску, можна дійти висновку, що з підвищенням температури вміст продукту реакції зменшується. Тобто йдеться про екзотермічну реакцію. До таких належать реакції синтезу амоніаку (Б) і гідроген хлориду (В).
За графіком також можна визначити, що об’ємна частка продукту реакції зменшується зі зниженням тиску (наприклад, за температури 400 °С вміст продукту реакції в суміші за тиску 1000 атм більший порівняно з його вмістом за 600, 300, 100...1 атм).
Тиск не впливає на рівновагу реакції (В), оскільки за її рівнянням мольні (і, відповідно, об’ємні) частки газів у лівій і правій частинах рівні:
Натомість реакція (Б), перебіг якої супроводжуваний зменшенням загального об’єму, залежить від тиску:
Тобто зі зниженням тиску рівновага цієї реакції зміщується ліворуч й об’ємна частка її продукту (амоніаку) у реакційній суміші зменшується.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Тобто за умовою завдання потрібно визначити рядок, у якому послідовно наведено формули солей слабкої основи й сильної кислоти, сильної основи й сильної кислоти, сильної основи й слабкої кислоти.
Цій умові відповідають солі, формули яких наведено в рядку A. Адже
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище).
Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Як за аніоном, так і за катіоном відбувається гідроліз солі, утвореної катіоном слабкої основи й аніоном слабкої кислоти.
Адже
З-поміж солей, формули яких наведено в завданні, катіоном слабкої основи й аніоном слабкої кислоти утворено амоній карбонат.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Розчинність речовин, її залежність від різних чинників.
Завдання скеровано на перевірку вміння аналізувати й інтерпретувати подану в графічній формі інформацію щодо залежності розчинності солей від температури.
За кривими розчинності, наведеними в умові завдання, легко визначити, що за температури 60 °С в порціях води масою 100 г для отримання насичених розчинів потрібно розчинити калій нітрат масою 110 г і рубідій нітрат масою 200 г (рис. 1).
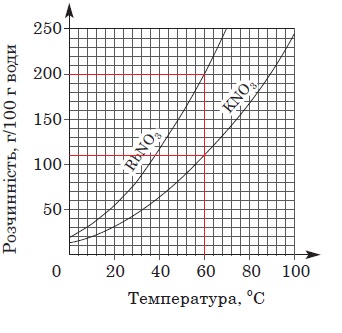
Рис. 1. Криві розчинності нітратів Рубідію і Калію
За умовою завдання для приготування насичених розчинів солей узято їхні наважки масою по 110 г. Тож для приготування насиченого за температури 60 °С розчину калій нітрату потрібно використати воду масою 100 г. Маса виготовленого розчину становить 210 г.
Для приготування насиченого за температури 60 °С розчину рубідій нітрату води масою 100 г достатньо для розчинення солі масою 200 г. Тобто для розчинення рубідій нітрату масою 110 г потрібно використати воду, маса якої трохи більша за 50 г, точніше – 55 г. Тож маса розчину рубідій нітрату дорівнює 165 г, що менше за масу розчину калій нітрату.
Масова частка солі в розчині дорівнює відношенню маси солі до маси розчину. Порівнявши вирази 110/210 і 110/165 легко дійти висновку, що масова частка калій нітрату у його розчині менша за масову частку рубідій нітрату.
Тобто правильним є лише твердження I.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку вміння аналізувати рівняння окисно-відновних реакцій.
Спочатку потрібно визначити ступені окиснення атомів Нітрогену в лівій і правій частинах хімічного рівняння, узявши до уваги, що алгебрична сума ступенів окиснення всіх атомів у молекулі дорівнює нулю:
Зниження ступеня окиснення атома елемента в молекулі називають відновленням. У цій реакції атоми Нітрогену зі ступенем окиснення +5 в натрій нітраті приймають електрони й відновлюються до азоту, у якому ступінь окиснення атомів Нітрогену дорівнює нулю.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Забарвлення індикаторів (універсального, фенолфталеїну, метилоранжу) у кислому, лужному й нейтральному середовищах.
Завдання скеровано на перевірку знання властивостей речовин, уміння прогнозувати їхню здатність реагувати з водою, забарвлення індикатора в розчині.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він набуває характерного малинового забарвлення.
Середовище водного розчину амоніаку лужне внаслідок перебігу реакції за схемою
Гідроксид-аніони у водному розчині амоніаку зумовлюють лужну реакцію середовища в ньому.
Натрій хлорид – сіль сильної основи й сильної кислоти – не зазнає гідролізу, тож середовище його водного розчину нейтральне.
Водний розчин гідроген сульфіду – слабка сульфідна кислота.
Сульфур(IV) оксид – кислотний, унаслідок його змішування з водою утворюється слабка сульфітна кислота.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння визначати склад солей за допомогою якісних реакцій на йони.
Узявши до уваги дані, наведені в довідковій таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді», можна дійти висновку, що сіль, про яку йдеться в умові завдання, – натрій гідрогенкарбонат. Рівняння реакцій, описаних у завданні, такі:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку вміння визначати ступені окиснення атомів хімічних елементів і прогнозувати їхні окисно-відновні властивості.
Спочатку потрібно визначити ступені окиснення атомів Сульфуру в речовинах, формули яких наведено в умові завдання, узявши до уваги, що:
- ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам;
- ступінь окиснення атомів Гідрогену в молекулах складних речовин дорівнює +1, а Оксигену, зазвичай, -2;
- алгебрична сума ступенів окиснення всіх атомів в молекулі дорівнює нулю.
А саме:
Виявляти лише відновні властивості (віддавати електрони) у хімічних реакціях може атом Сульфуру з мінімально можливим для нього ступенем окиснення. Сульфур – елемент головної підгрупи VI групи. На на зовнішньому енергетичному рівні його атома 6 електронів. Тому найменший ступінь окиснення атома Сульфуру дорівнює -2 (різниці між номером групи й числом 8). Такий ступінь окиснення мають атоми Сульфуру в молекулі гідроген сульфіду.
Атоми Сульфуру зі ступенем окиснення -2 віддають електрони й виявляють відновні властивості:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що цинк витіснятиме із солей свинець (А) і нікель (Б), оскільки в ряду активності він розташований лівіше від них:
Затим потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса цинкової пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) нітрату, і зменшиться внаслідок занурення у водний розчин нікель(ІІ) нітрату.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння розпізнавати речовини за хімічними властивостями.
Водень виділяється внаслідок реакції алюмінію із хлоридною кислотою:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу хімічних реакцій між неорганічними речовинами.
Продуктом реакції заліза з речовиною X є ферум(ІІІ) хлорид. Це дає підстави стверджувати, що речовина X – хлор, бо продуктом реакції заліза із хлоридною кислотою є ферум(ІІ) хлорид:
Речовина Y – залізо, бо карбон(IV) оксид із ферум(ІІІ) хлоридом не реагує. Натомість залізо відновлює сполуку феруму(ІІІ) до феруму(ІІ):
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції. Поняття окисник, відновник, окиснення, відновлення.
Завдання скеровано на перевірку як розуміння суті процесів окиснення і відновлення, так і вміння встановлювати причиново-наслідкові зв’язки між властивостями й застосуванням речовин.
У карбон(ІІ) оксиді атом Карбону має ступінь окиснення +2 і здатен підвищити його до +4 внаслідок утрати електронів:
Те, що карбон(ІІ) оксид є сильним відновником, використовують для відновлення металів з оксидів металічних елементів, наприклад:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за якісним і кількісним складом реагентів і продуктів реакції та тепловим ефектом.
Під час реакції кальцій оксиду з водою частина її перетворилася на пару. Це свідчить про виділення теплоти. Отже, реакція є екзотермічною:
Реагентами в цій реакції є дві складні речовини, продуктом – одна складна речовина. Це реакція сполучення.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку знання властивостей кислот, уміння складати їхні хімічні формули й класифікувати кислоти за основністю.
Хімічна формула ортофосфатної кислоти
Ортофосфатна кислота – речовина молекулярної будови, добре розчиняється у воді.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Амфотерні сполуки.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерність – здатнiсть сполуки виявляти кислотнi або основнi властивостi залежно вiд природи реагенту.
Умову завдання задовольняє варіант відповіді Б, у якому наведено схеми реакцій цинк оксиду як із кислотою, так і з лугом. Це доводить його амфотерність.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
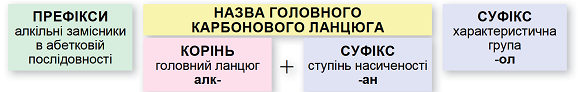
Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
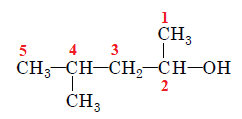
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу п’ять атомів Карбону, із другим атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 4-метилпентан-2-ол.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії та вміння визначати ізомерні речовини за структурними формулами.
Ізомерія – явище iснування ізомерів – сполук, однакових за хімічним складом i молекулярною масою, але рiзних за будовою.
Умову завдання задовольняють речовини 2, 3, 4, молекулярна формула яких
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани.
Завдання скеровано на перевірку вміння аналізувати структурні формули алканів й обґрунтовувати залежність між їхніми температурами кипіння, відносними молекулярними масами та будовою молекул.
У гомологічному ряду алканів температури кипіння підвищуються зі збільшенням довжини карбонового ланцюга, а температури кипіння ізомерних алканів зменшуються зі збільшенням його розгалуженості.
Вочевидь найвищу температуру кипіння (151 °C) із-поміж алканів, про які йдеться в завданні, має нонан (дев’ять атомів Карбону в нерозгалуженому ланцюгу, рис. 1).
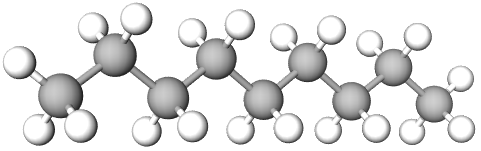
Рис. 1. Модель молекули нонану
Інші три вуглеводні – ізомери, які різняться будовою карбонового ланцюга.
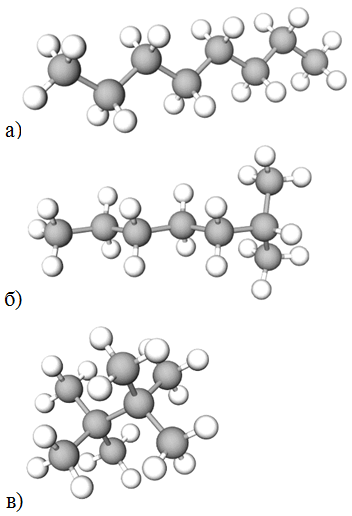
Рис. 2. Моделі молекул октану (а), 2-метилгептану (б),
2,2,3,3-тетраметилбутану (в)
В октану нерозгалужений ланцюг, тож його температура кипіння (126 °C) найвища серед цих ізомерів.
Карбоновий ланцюг 2-метилгептану менш розгалужений порівняно із 2,2,3,3-тетраметилбутаном, тому температура його кипіння (116 °C) вища за температуру кипіння (106 °C) 2,2,3,3-тетраметилбутану.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкени.
Завдання скеровано на перевірку знання хімічних властивостей алкенів і вміння класифікувати реакції за їхньої участі.
Пропен реагує з бромом за схемою:
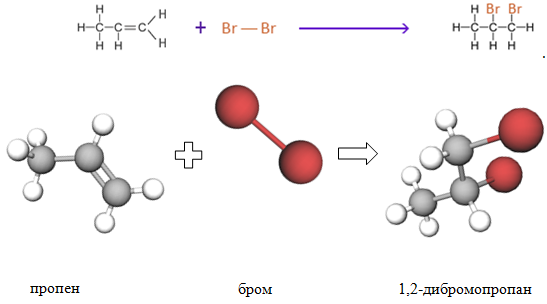
Продуктом приєднання брому до пропену за місцем подвійного зв’язку є 1,2-дибромопропан.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкени й алкіни.
Завдання скеровано на перевірку знання хімічних властивостей алканів та алкінів й уміння розрізняти вуглеводні різних гомологічних рядів.
Аналіз наведених варіантів відповіді дає змогу дійти висновку:
Твердження А «У реакцію гідрування вступає як етен, так і етин» є правильним, бо обидва вуглеводні належать до ненасичених.
Твердження Б «Продуктом каталітичної гідратації етину є етаналь» також правильне.
Твердження В «Етен і етин належать до одного гомологічного ряду» помилкове, етин належить до алкінів, а етен – до алкенів.
Твердження Г «Каталітичним дегідруванням етану можна добути етен» правильне, бо алкени можна добути дегідруванням алканів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Карбонові кислоти.
Завдання скеровано на перевірку вміння аналізувати й порівнювати хімічний склад і будову насичених одноосновних карбонових кислот – метанової та етанової (рис. 1), їхні властивості.
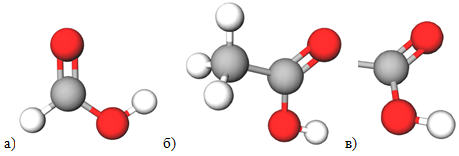
Рис. 1. Моделі молекул метанової (а) та етанової (б) кислот, карбоксильної групи (в)
Спільні властивості метанової та етанової кислот зумовлено характеристичною (функціональною) карбоксильною групою в їхніх молекулах. Обидві кислоти дисоціюють у водному розчині з утворенням катіонів Гідрогену, тож твердження, що у водному розчині метанової кислоти метиловий оранжевий не змінює забарвлення, є помилковим.
Як метанова, так і етанова кислота вступають в реакцію естерифікації та реагують із лугами.
Специфічні властивості метанової кислоти порівняно з іншими насиченими одноосновними карбоновими кислотами зумовлено тим, що карбоксильну групу в її молекулі сполучено не з вуглеводневим замісником, а з атомом Гідрогену. Тож метанова кислота окиснюється амоніачним розчином аргентум(І) оксиду за нагрівання (реакція срібного дзеркала) , а етанова – ні.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Фенол. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії, уміння розрізняти феноли поміж інших органічних сполук.
Ізомерія – явище існування ізомерів – сполук, однакових за хімічним складом i молекулярною масою, але різних за будовою.
Речовина 1 є ізомером речовини 2, оскільки в них однакова молекулярна формула
Феноли – сполуки, у молекулах яких є одна або більше гідроксильних груп, приєднаних до бензенового або іншого аренового кільця (рис. 1).
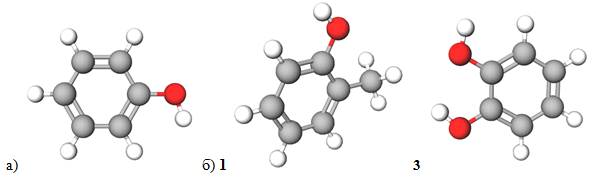
Рис. 1. Моделі молекул: найпростішого фенолу (а), речовин 1 і 3 (б)
Тож речовини 1 і 3 належать до фенолів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол.
Завдання скеровано на перевірку знання хімічних властивостей фенолу, зумовленості їх взаємним впливом бензенового кільця і гідроксильної групи в його молекулі.
Твердження, що гідроксильна група в молекулі фенолу підвищує реакційну здатність бензенового кільця в реакціях заміщення, правильне. Вуглеводневий замісник і характеристична група в молекулі фенолу взаємовпливають. Електрони бензенового кільця взаємодіють із неподіленою електронною парою атома Оксигену, залучають її до своєї сфери й відтягують на себе. Унаслідок цього полярність зв’язку
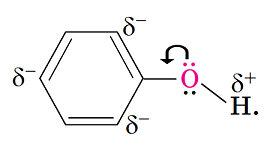
Рис. 1. Розподілення електронної густини в молекулі фенолу
Під впливом атома Оксигену гідроксильної групи електронна густина в бензеновому кільці фенолу підвищується. Це є причиною зменшення його стійкості до окиснення і заміщення.
Твердження, що для якісного виявлення фенолу можна використати бромну воду, також правильне. Зовнішнім ефектом цієї реакції є утворення білого осаду 2,4,6-трибромофенолу:
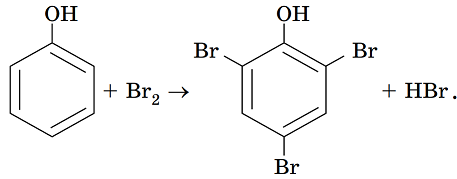
Твердження щодо взаємодії фенолу з натрій гідроксидом у водному розчині також правильне. Унаслідок збільшення полярності зв’язку
З огляду на викладене вище, твердження, що у воді фенол виявляє слабші кислотні властивості, ніж етанол, помилкове.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Етен. Етанол. Установлення генетичних зв’язків між різними класами органічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей етену, уміння установлювати генетичні зв’язки між різними класами органічних сполук.
Щодо правильності наведених в умові завдання тверджень:
A |
каталітичним гідруванням етену добувають етан, а не етанол |
Б |
каталітичною гідратацією етину добувають етаналь, а не етанол |
B |
частковим окисненням етаналю добувають етанову кислоту, а не етанол |
Г |
ферментативним бродінням глюкози добувають етанол |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання скеровано на перевірку вміння розрізняти формули естерів.
Загальну формулу естерів наведено на рисунку 1:
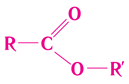
Рис. 1. Загальна формула естерів
Структурні формули етанової кислоти, 2-метилпропан-1-олу й продукту реакції між ними зображено на рисунку 2.
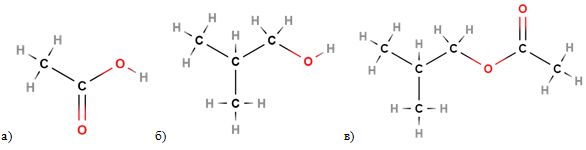
Рис. 2. Структурні формули етанової кислоти (а), 2-метилпропан-1-олу (б), естеру, утвореного ними (в)
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкени. Етен.
Завдання скеровано на перевірку знання хімічних властивостей етену.
Етен – ненасичений вуглеводень, вступає в реакції приєднання, які відбуваються за місцем кратного зв’язку, наприклад, із водою:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни. Анілін.
Завдання скеровано на перевірку знання хімічних властивостей аніліну, зумовленості їх взаємним впливом бензенового кільця й аміногрупи в його молекулі.
Для аніліну можливі реакції як за аміногрупою, так і за бензеновим кільцем. Особливості цих реакцій зумовлені взаємним впливом атомів у молекулі аніліну.
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього на атомі Нітрогену електронна густина зменшується, і тому зменшуються осно́вні властивості аміногрупи. Це є причиною того, що анілін реагує із сильними кислотами з утворенням солей бензенамонію:
Натомість у бензеновому кільці електронна густина збільшується, найсильніше – у положеннях 2, 4 і 6 відносно аміногрупи. Тому внаслідок добавляння бромної води до аніліну утворюється білий осад
2,4,6-трибромоаніліну:
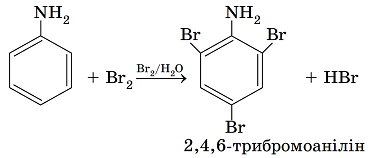
Тобто обидва твердження, наведені в умові завдання, є правильними.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Глюкоза.
Завдання скеровано на перевірку знання хімічного складу молекули глюкози й уміння виявляти характеристичні групи в її молекулі.
Хімічні властивості глюкози, яка поєднує в собі властивості багато-атомних спиртів і альдегідів, зумовлені характеристичними групами в її молекулі – п’ятьма гідроксильними й альдегідною (рис. 1).
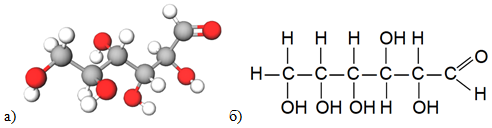
Рис. 1. Модель молекули (а) і структурна формула (б) глюкози
Реактивом, за допомогою якого можна довести наявність у молекулі глюкози як альдегідної групи, так і кількох гідроксильних груп, є свіжодобутий купрум(ІІ) гідроксид.
Унаслідок змішування з ним глюкози за надлишку лугу осад купрум(ІІ) гідроксиду розчиняється, утворюється яскраво-синій розчин, що свідчить про наявність у молекулі глюкози кількох гідроксильних груп.
Якщо цей розчин нагріти, спочатку утвориться жовтий осад купрум(І) гідроксиду унаслідок відновлення купрум(ІІ) гідроксиду глюкозою. За подальшого нагрівання осад набуде цегляно-червоного кольору, бо внаслідок термічного розкладання купрум(І) гідроксиду утвориться купрум(І) оксид:
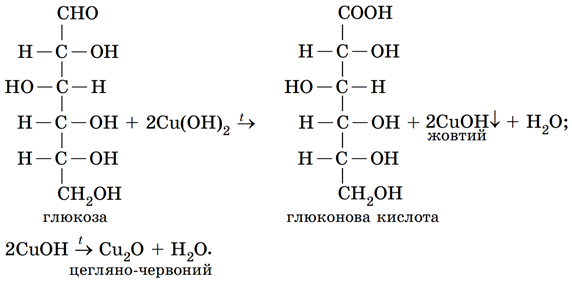
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Ізомерія.
Завдання скеровано на перевірку знання загальних формул вуглеводнів різних гомологічних рядів, розуміння суті ізомерії, реакції ізомеризації.
1 |
Ізомером речовини A є речовина B з такою самою молекулярною формулою |
2 |
Продуктом ізомеризації бутану є речовина Б з такою самою молекулярною формулою |
3 |
Загальній формулі |
Відповідь: 1В, 2Б, 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Ізомерія.
Завдання скеровано на перевірку вміння розрізняти реакції різних типів за участі органічних речовин.
Перетворення 1 – це реакція відщеплення (Б) води від пропан-2-олу з утворенням проп-1-ену.
Перетворення 2 – це реакція приєднання (Г) водню до проп-1-ену з утворенням пропану.
Перетворення 3 – це реакція заміщення (Д) атома Гідрогену в молекулі пропану атомом Брому внаслідок бромування.
Відповідь: 1Б, 2Г, 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Поняття нуклон, нуклід, ізотопи, протонне число, нуклонне число.
Завдання скеровано на перевірку вміння аналізувати й порівнювати склад ядер атомів.
1 |
Ізотопами є атоми A та Д, оскільки в них однакове протонне число (16) і різна кількість нейтронів у ядрах (20 і 16 відповідно). |
2 |
Атоми B та Г – це ізотони з однаковою кількістю (18) нейтронів у ядрах і різними протонними числами (17 і 18 відповідно). |
3 |
Ізобари – це атоми Г та А з тим самим нуклонним (36), але з різними протонними числами (18 і 16 відповідно). |
Відповідь: 1Д, 2Г, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами в розчині. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння ідентифікувати речовини за допомогою якісних реакцій на йони в їхньому складі.
Для правильного розв’язання завдання потрібно скористатися довідковою таблицею «Розчинність основ, кислот, амфотерних гідроксидів і солей за температури 20–25 °С у воді». Також потрібно пам’ятати, що реакції йонного обміну між електролітами в розчині необоротні (відбуваються до кінця), якщо хоча б один із продуктів реакції є нерозчинною речовиною (утворюється осад або виділяється газ) або слабким електролітом (вода), тобто виводиться зі сфери перебігу реакції. Виділення газу, утворення осаду – помітні зовнішні ефекти, за якими можна розпізнати ті чи ті реакції.
1 |
Під дією хлоридної кислоти на калій силікат (В) утвориться осад силікатної кислоти. Унаслідок реакції калій силікату з барій хлоридом у розчині утвориться осад барій силікату. |
2 |
Магній сульфат (А) у розчині не реагує ні з хлоридною кислотою, ні з барій хлоридом, усі ці речовини перебувають у розчині у формі йонів. |
3 |
Натрій карбонат (Б) реагує з хлоридною кислотою з виділенням газу. Унаслідок взаємодії з барій хлоридом у розчині утворюється осад барій карбонату. |
Відповідь: 1В, 2А, 3Б.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за її кількістю.
Дано:
Знайти:
Відповідь: 180.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за її об’ємом.
Молярний об’єм газу за нормальних умов (н. у.) становить 22,4 л/моль.
Кількість речовини водню дорівнює частці від ділення його об’єму (н. у.) на молярний об’єм і становить 20 моль.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газуватої суміші за об’ємними частками її складників.
Об’ємна частка метану в суміші становить 25 %, відповідно об’ємна частка кисню в ній дорівнює 75 %.
Середню молярну масу
у якій
Дано:
Знайти:
Відповідь: 28.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати хімічну формулу речовини за даними про співвідношення мас елементів у ній і її молярною масою.
Дано:
Знайти:
Відповідь: 21.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння аналізувати хімічні формули речовин, визначати масові частки речовин у суміші.
Дано:
Знайти:
Кількість речовини атомів Карбону й Оксигену:
Відповідь: 56.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількісний склад розчинів.
Дано:
Знайти:
Якщо
Відповідь: 120.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 11.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількісний склад суміші.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати хімічну формулу сполуки.
Дано:
Знайти:
Відповідь: 52.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати хімічну формулу сполуки.
Дано:
Знайти:
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 45.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Із хлоридною кислотою реагують і магній гідроксид, і магній карбонат, однак карбон(IV) оксид утворюється лише внаслідок реакції з магній карбонатом:
за умовою задачі
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 19.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Для газів об'ємні частки в суміші збігаються з мольними, тому
Відповідь: 80.
Знайшли помилку? Пишіть на




