ЗНО онлайн 2021 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2021 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б два хімічні елементи (
В два хімічні елементи (
Г три хімічні елементи (
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула. Прості і складні речовини.
Завдання скеровано на перевірку знання хімічних формул речовин, уміння розрізняти за ними прості і складні речовини.
Прості речовини утворені атомами одного хімічного елемента. Цю умову задовольняє варіант відповіді В: алюміній
А (
Б (
В (
Г (
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація хімічних елементів. Лужні елементи.
Завдання скеровано на перевірку знання класифікації хімічних елементів.
До лужних належать елементи 1А групи періодичної системи (рис. 1).
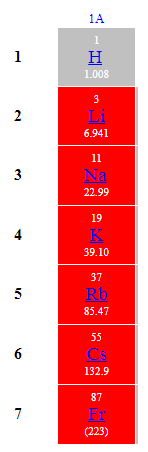
Рис. 1. Лужні елементи
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів хімічних елементів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) й атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Нейтронне число
Якщо кількість протонів і нейтронів однакова, то нуклонне число є парним, тобто вибір потрібно зробити між нуклідами
Кількість нейтронів у нукліді
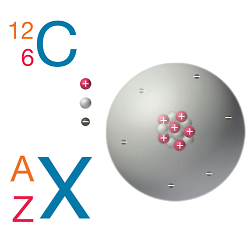
Рис. 1. Склад нукліда
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Йон – позитивно (катiон) або негативно (анiон) електрично заряджена частинка, заряд якої кратний заряду електрона.
В нукліді
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
А
Б
В
Г
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти процеси окиснення і відновлення в окисно-відновних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Тепловий ефект хімічної реакції. Екзо- й ендотермічні реакції. Оборотні реакції. Хімічна рівновага й умови її зміщення. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за тепловим ефектом й застосовувати принцип Ле Шательє для прогнозування зміщення хімічної рівноваги.
Якщо система в стані рівноваги зазнає певної дії, то рівновага в системі зміститься так, щоби зменшити вплив цієї дії.
Екзотермічна реакція – хімiчне перетворення, за якого зменшується внутрiшня енергiя системи й видiляється тепло,
Ендотермічна реакція – хімiчне перетворення, за якого збільшується внутрiшня енергiя системи й поглинається тепло,
Оскільки в термохімічному рівнянні, наведеному в умові, зазначено, що
На зміну об’єму реакції, рівняння якої
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Тепловий ефект хімічної реакції. Екзо- й ендотермічні реакції. Оборотні реакції. Хімічна рівновага й умови її зміщення. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за тепловим ефектом й застосовувати принцип Ле Шательє для прогнозування зміщення хімічної рівноваги.
Якщо система в стані рівноваги зазнає певної дії, то рівновага в системі зміститься так, щоби зменшити вплив цієї дії.
Екзотермічна реакція – хімiчне перетворення, за якого зменшується внутрiшня енергiя системи й видiляється тепло,
Екзотермічна реакція – хімiчне перетворення, за якого збільшується внутрiшня енергiя системи й поглинається тепло,
Тобто підвищення температури приведе до зміщення вправо рівноваги ендотермічних реакцій – варіанти відповіді В і Г.
Зниження тиску приведе до зміщення праворуч рівноваги реакції, яка відбувається зі збільшенням тиску.
Реакція, рівняння якої
відбувається зі збільшенням тиску, а реакція, рівняння якої
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Тепловий ефект хімічної реакції. Екзо- й ендотермічні реакції. Оборотні реакції. Хімічна рівновага й умови її зміщення. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за тепловим ефектом й застосовувати принцип Ле Шательє для прогнозування зміщення хімічної рівноваги.
Якщо система в стані рівноваги зазнає певної дії, то рівновага в системі зміститься так, щоби зменшити вплив цієї дії.
Екзотермічна реакція – хімiчне перетворення, за якого зменшується внутрiшня енергiя системи й видiляється тепло,
Ендотермічна реакція – хімiчне перетворення, за якого збільшується внутрiшня енергiя системи й поглинається тепло,
Зниження тиску приведе до зміщення праворуч рівноваги реакції, яка відбувається зі збільшенням тиску.
Реакція, рівняння якої
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді А – В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей (рис. 1).
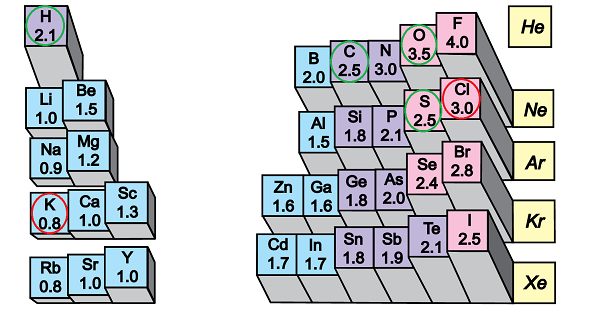
Натомість у калій хлориді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Калію і хлорид-аніонами.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, метану, гідроген хлориду, амоніаку, етену, кисню, азоту, нітроген(I) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).

Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі за результатами аналізування її складу за хімічною формулою.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
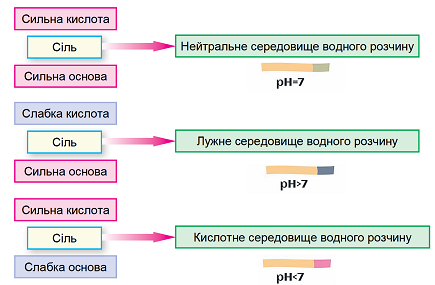
Рис. 1. Характер середовища водного розчину солі залежить від сили відповідних кислоти й основи
Умові задання відповідає амоній сульфат.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водного розчину солі за результатами аналізування її складу за хімічною формулою.
Фенолфталеїн – специфічний індикатор лужного середовища, під дією гідроксид-аніонів набуває малинового забарвлення.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном. Унаслідок цього середовище розчину стає лужним.
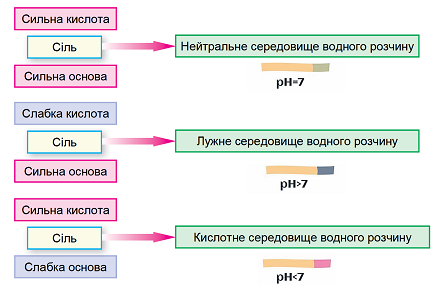
Рис. 1. Характер середовища водного розчину солі залежить від сили відповідних кислоти й основи
Умові задання відповідає калій карбонат.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності реакцій між електролітами в розчині.
Хлоридна кислота є сильною, тому може витіснити із солей слабші за неї сульфідну, залишок якої є в натрій сульфіді (варіант відповіді А) і сульфітну, залишок якої є в натрій сульфіті (варіант відповіді Г) кислоти. Однак осад з барій хлоридом у водному розчині утворить лише натрій сульфіт – він є малорозчинною речовиною, а барій сульфід розчиняється у воді (рис. 1).
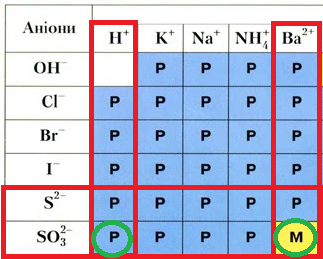
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей у воді за температури 20–25 °С»
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук.
А амфотерний цинк оксид реагує з лугом
Б амфотерний купрум(ІІ) оксид реагує з нітратною кислотою
В кислотний сульфур(IV) оксид реагує з основним кальцій оксидом
Г два вищі кислотні оксиди – сіліцій(IV) оксид і карбон(IV) оксид – не реагують між собою
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук і способи їхнього добування.
Дією етанової (оцтової) кислоти на кальцій карбонат добувають карбон(IV) оксид (вуглекислий газ):
Густина карбон(IV) оксиду більша за густину повітря, тому його збирають у посудину, розташовану отвором догори.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості основних класів неорганічних сполук і способи їхнього добування.
Вапно – тривіальна назва кальцій оксиду
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Явище амфотерності.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння аналізувати й прогнозувати результати дослідження, робити висновки.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Прикладами амфотерних оксидів є оксиди Цинку й Алюмінію.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Сульфатна кислота. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза й сульфатної кислоти, уміння прогнозувати хімічний склад продуктів реакцій сульфатної кислоти різної концентрації з металами.
У розведених водних розчинах сульфатної кислоти окисниками є катіони Гідрогену, а не атоми Сульфуру в кислотному залишку:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння складати формули оксигеновмісних кислот.
Проаналізувавши наведені формули солей, можна дійти висновку, що йдеться про солі двохосновної оксигеновмісної кислоти, утвореної хімічним елементом, ступінь окиснення якого в ній дорівнює +6:
Цій умові відповідає сульфатна кислота
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Вуглеводні. Алкани, їхні фізичні властивості.
Завдання скеровано на знання фізичних властивостей алканів і розуміння змісту понять «температура кипіння» і «температура плавлення».
Плавлення (топлення) – екзотермічний процес переходу речовин (зокрема таких, що не мають кристалічної будови) із твердого стану в рiдкий.
Тобто для того, щоби розв’язати завдання, потрібно проаналізувати подані в таблиці температури плавлення алканів. Варіанти відповіді А і Б відповідають газуватим речовинам, які зріджуються і тверднуть за від’ємних температур.
З-поміж варіантів відповіді В і Г потрібно вибрати варіант Г, бо речовина, яка плавиться за температури 18 °С (варіант В), за температури 25 °С перебуватиме в рідкому стані. А речовина, яка плавиться за температури 37 °С, і за 25 °С перебуватиме в твердому стані.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура алкінів.
Завдання скеровано на перевірку вміння називати алкіни за систематичною номенклатурою.
Зі структурної формули, що містить потрійний зв’язок, зрозуміло, що йдеться про назву алкіну розгалуженої будови.
Називати алкіни за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).

Рис. 1. Алгоритм побудови назв алкенів й алкінів за систематичною номенклатурою
Зверніть увагу: положення потрійного зв’язку й замісників позначають найменшими числами, але перевагу у виборі початку нумерації віддають потрійному зв’язку (рис. 2).
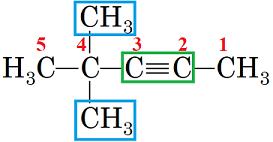
Рис. 2. Структурна формула 4,4-диметилпент-2-ину
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Загальна формула алкенів.
Завдання скеровано на перевірку знання загальної формули алкенів.
Загальна формула алкенів –
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії й уміння визначати речовини-ізомери.
Ізомери – речовини з однаковою молекулярною формулою, але різною будовою молекул.
З-поміж наведених речовин ізомерами є циклобутан і бутен-2-ен, які мають однакову молекулярну формулу
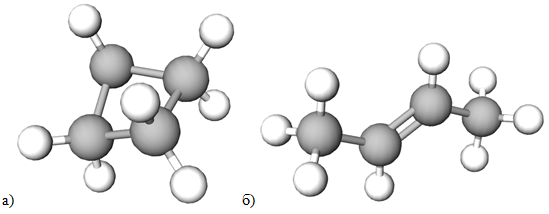
Рис. 1. Моделі молекул циклобутану (а) і бутен-2-ену (б)
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Найпростіша формули речовини. Естери.
Завдання скеровано на перевірку розуміння змісту поняття «найпростіша формула речовини», знання формули естерної групи.
За структурною формулою речовини можна визначити її молекулярну формулу

Рис. 1. Метиловий естер пропенової кислоти
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Карбонові кислоти.
Завдання скеровано на перевірку знання тривіальних назв органічних речовин.
Формулу оцтової (етанової) кислоти наведено на рисунку Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання хімічного складу й властивостей сахарози, класифікації вуглеводів.
Молекулярна формула сахарози
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти.
Завдання скеровано на перевірку вміння інтерпретувати інформацію щодо фізичних властивостей спиртів, подану в графічній формі.
Зі збільшенням кількості атомів у молекулах насичених одноатомних спиртів і, відповідно, їхньої молекулярної маси, температура кипіння послідовно підвищується.
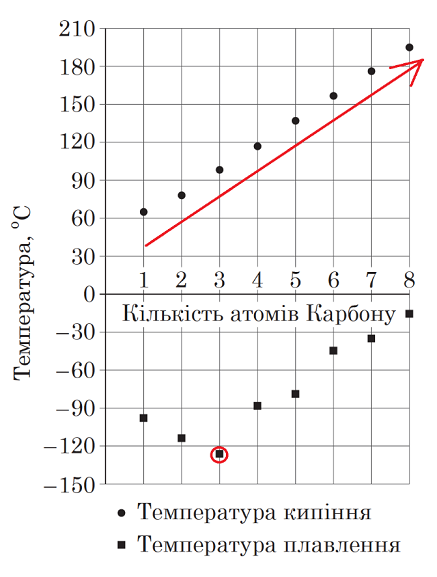
Температура плавлення пропан‑1‑олу не найвища, а найнижча з-поміж наведених.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація хімічних реакцій в органічній хімії. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання генетичних зв’язків між класами органічних сполук, уміння розрізняти типи хімічних реакцій.
Перетворення етину на етаналь – реакція гідратації (приєднання води), етаналю на етанол – гідрування (приєднання водню):
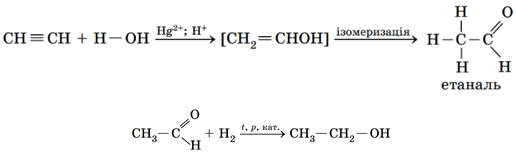
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей органічних сполук, якісних реакцій на характеристичні групи.
Те, що речовина Х реагує з натрій карбонатом із виділенням газу, свідчить про те, що в її молекулі є карбоксильна група.
Реакція з амоніачним розчином аргентум(І) оксиду вказує на те, що в молекулі речовини Х є альдегідна група.
Ці умови задовольняє метанова (мурашина) кислота (рис. 1).
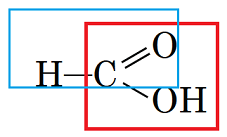
Рис. 1. Альдегідна (у прямокутнику синього кольору) і карбоксильна (у прямокутнику червоного кольору) групи у структурній формулі метанової кислоти
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості аніліну.
Завдання скеровано на перевірку знання хімічних властивостей аніліну й розуміння взаємного впливу груп атомів у молекулах органічних сполук.
Для аніліну можливі реакції як за аміногрупою, так і за бензеновим кільцем. Особливості цих реакцій зумовлені взаємним впливом атомів у молекулі аніліну (рис. 1).
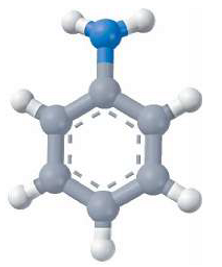
Рис. 1. Модель молекули аніліну
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього на атомі Нітрогену електронна густина зменшується, і тому зменшуються основні властивості аміногрупи. Тож анілін виявляє слабші основні властивості порівняно з амоніаком.
Натомість у бензеновому кільці електронна густина збільшується, найсильніше – у положеннях 2, 4 і 6 відносно аміногрупи. Тому внаслідок добавляння бромної води до аніліну утворюється білий осад 2,4,6‑трибромоаніліну:
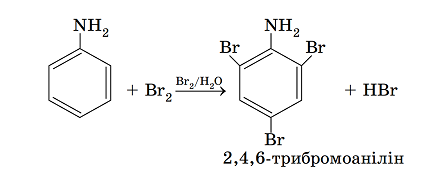
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Амінокислоти.
Завдання скеровано на перевірку знання хімічних властивостей амінокислот, уміння аналізувати хімічний склад пептидів за їхніми структурними формулами, виявляти пептидні зв’язки.
Пептидний зв’язок – це амідний зв’язок у молекулах білків, що утворився внаслідок взаємодії карбоксильної групи однієї амінокислоти з амiногрупою іншої (з вилученням води),
За умовою завдання в утворенні пептидних зв’язків беруть участь як карбоксильна, так й аміногрупа молекули валіну. Тобто її фрагмент має бути в центрі трипептиду (рис. 1).
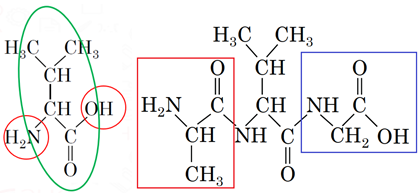
Рис. 1. Характеристичні групи в молекулі валіну, які беруть участь в утворенні пептидних зв’язків
Аміногрупа гліцину прореагує з карбоксильною групою валіну, а карбоксильна група аланіну – з аміногрупою валіну.
Цим умовам задовольняє варіант відповіді В.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей органічних сполук, якісних реакцій на характеристичні групи, альдегідну зокрема.
Альдегіди також можна окиснити в лужному середовищі купрум(ІІ) гідроксидом. Унаслідок реакції блакитний осад купрум(ІІ) гідроксиду перетворюється на жовтий осад купрум(І) гідроксиду, із якого за подальшого нагрівання утвориться цегляно-червоний купрум(І) оксид:
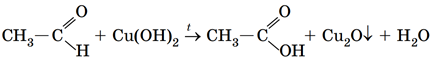
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку знання властивостей неорганічних речовин.
Розбавлена хлоридна кислота не реагує з міддю, а концентрована нітратна – реагує.
Натрій сульфат на відміну від натрій нітрату реагує з барій хлоридом.
Унаслідок реакції з лугом алюміній хлориду і магній хлориду у водному розчині утворюються осади відповідних гідроксидів. Однак осад алюміній гідроксиду, на відміну від осаду магній гідроксиду, розчиняється в надлишку лугу.
Відповідь: 1А, 2Б, 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості органічних речовин.
Завдання скеровано на перевірку знання властивостей органічних речовин і типів хімічних реакцій за їхньої участі.
Продуктом часткового окиснення пропан‑1‑олу є пропаналь, гідрування пропену – пропан, ізомеризації бутану – ізобутан.
Відповідь: 1Б, 2В, 3Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості органічних речовин.
Завдання скеровано на перевірку знання властивостей органічних речовин і типів хімічних реакцій за їхньої участі.
Перетворення пропану на 2‑бромопропан – реакція заміщення атома Гідрогену в молекулі пропану на атом Брому.
Перетворення етанолу на етен – реакція відщеплення молекули води від молекули спирту.
Перетворення етину на етан – реакція приєднання двох молекул водню до молекули алкіну.
Відповідь: 1Д, 2Б, 3Г.
Знайшли помилку? Пишіть на
ТЕМА: Характеристичні групи в молекулах органічних речовин.
Завдання скеровано на перевірку вміння розрізняти характеристичні групи в молекулах органічних речовин.
Червоним кольором виокремлено характеристичні групи:
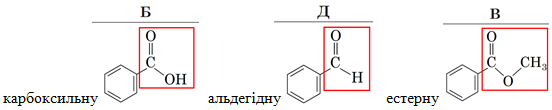
Відповідь: 1Б, 2Д, 3В.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
Знайти:
Відповідь: 106.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання хімічних рівнянь.
Кількість атомів кожного з хімічних елементів у лівій і правій частинах рівняння мають бути однаковими:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість газуватої речовини за її об’ємом (н. у.).
Дано:
Знайти:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
Знайти:
Відповідь: 2.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 28.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати молекулярну формулу речовини за співвідношенням мас атомів хімічних елементів у ній.
Дано:
Знайти:
Відповідь: 19.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати за хімічними рівняннями масу (об’єм) продуктів і реагентів.
Дано:
Знайти:
Відповідь: 90.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати за хімічними рівняннями масу (об’єм) продуктів і реагентів з огляду на відносний вихід продукту реакції.
Дано:
Знайти:
Відповідь: 168.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати молекулярну формулу речовини за її масою і масами продуктів її повного окиснення.
Дано:
Знайти:
Найпростіша формула речовини -
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на




