ЗНО онлайн 2021 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2021 року з хімії
ТЕМА: Основні хімічні поняття. Алотропія. Алмаз, графіт.
Завдання скеровано на перевірку розуміння поняття алотропія, знання алотропних модифікацій Карбону.
Алотропи – різні структурні модифікації одного елемента, мають різні фізичні й хімічні властивості. Алмаз (рис. 1) і графіт (рис. 2) є алотропами Карбону.
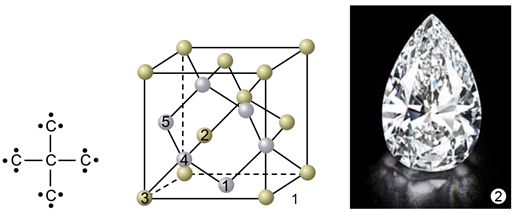
Рис. 1. 1. Модель кристалічних ґраток алмазу. 2. Діамант – огранений алмаз
У кристалічних ґратках алмазу всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні. Атоми Карбону в графіті розташовані плоскими сітками.

Рис. 2. 1. Модель кристалічних ґраток графіту. 2. Кристал графіту
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Карбон(IV) оксид.
Завдання скеровано на перевірку знання тривіальної назви карбон(IV) оксиду і його хімічної формули.
Вуглекислий газ – продукт газообміну в легенях людини й сировина для фотосинтезу глюкози й крохмалю рослинами, його систематична назва карбон(IV) оксид, хімічна формула –
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Атом. Молекула. Хімічний елемент. Хімічна формула. Неорганічні речовини. Вода.
Завдання скеровано на перевірку знання хімічної формули води й уміння інтерпретувати її.
Молекула води, хімічна формула якої
Ця молекула триатомна – містить два атоми Гідрогену й атом Оксигену (рис. 1).

Рис. 1. Модель молекули води: атом Гідрогену –
 , атом Оксигену
, атом Оксигену
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Фізичні й хімічні явища.
Завдання скеровано на перевірку розуміння суттєвої ознаки хімічних явищ, уміння розпізнавати поміж повсякденних явищ хімічні.
Суттєвою ознакою хімічних явищ є перетворення одних речовин на інші. Про утворення нових речовин можуть свідчити зміна кольору, поява чи зникнення запаху, утворення осаду тощо.
Перетворення речовин, про що свідчить поява характерного кислого смаку й запаху, утворення осаду, відбувається під час скисання молока.
Під час плавлення парафіну й замерзання води відбуваються переходи речовин з одного агрегатного стану в інший, подрібнення крейди також не приводить до зміни хімічного складу.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші. Способи розділення сумішей.
Завдання скеровано на перевірку розуміння фізичних явищ, на яких ґрунтується розділення речовин із різними властивостями.
На рисунку зображено ділильну лійку – посудину, яку використовують у лабораторії для розділення рідин, що не змішуються. З-поміж речовин, назви яких подано у варіантах відповіді, рідиною, що не змішується із водою, є соняшникова олія.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Органічна хімія.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин, уміння розпізнавати органічні речовини.
Органічні речовини – сполуки Карбону. Крохмаль – органічна речовина, яка нагромаджується в результаті фотосинтезу у плодах, зерні, коренях і бульбах деяких рослин як запасна форма вуглеводів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти процеси окиснення і відновлення в окисно-відновних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
А
Б
В
Г
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Склад і будова атомів хімічних елементів. Електронні формули атомів.
Завдання скеровано на перевірку вміння аналізувати положення хімічного елемента в періодичній системі, визначати електронні формули атомів.
Формула вищого оксиду хімічного елемента
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Склад і будова атомів хімічних елементів. Ізотопи.
Завдання скеровано на перевірку вміння аналізувати склад атомів хімічних елементів.
Нуклони – це протони й нейтрони. Нуклонне число
Ізотопи – нукліди з однаковим протонним, але рiзними нуклонними числами.
| Атом | Кількість | |||
| протонів | нейтронів | нуклонів | електронів | |
| 16 | 20 | 16 + 20 = 36 | 16 | |
| 18 | 18 | 18 + 18 = 36 | 18 | |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння механізму утворення ковалентного зв’язку за донорно-акцепторним механізмом, уміння розпізнавати ковалентні зв’язки – полярні й неполярні.
І. Ковалентний зв’язок може утворюватися за обмінним (унаслідок усуспільнення електронів) або за донорно-акцепторним механізмом. Катіон амонію утворюється внаслідок приєднання протона до молекули амоніаку. Тож один із чотирьох ковалентних зв’язків у катіоні амонію утворено за донорно-акцепторним механізмом. Молекула амоніаку є донором, а катіон Гідрогену – акцептором електронної пари (рис. 1).
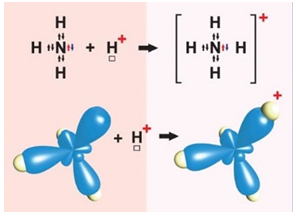
Рис. 1. Утворення катіона амонію
ІІ. Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари (рис. 2).

Рис. 2. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік більш електронегативного атома, називають полярним зв’язком. Саме такі зв’язки між атомами Гідрогену й Оксигену в молекулі води, спільні електронні пари зміщені до атома Оксигену.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння використовувати знання про закономірності зміни властивостей хімічних елементів у періодичній системі й аналізувати склад і будову їхніх атомів.
А В атомах Флуору й Хлору різна загальна кількість електронів, бо в них різні порядкові номери і, відповідно, протонні числа.
Б Електронегативність Флуору більша, ніж електронегативність Хлору, оскільки в групах хімічних елементів електронегативність зменшується зі збільшенням протонних чисел атомів. Флуор – самий електронегативний елемент.
В Радіус атома Хлору більший, ніж радіус атома Флуору, оскільки в групах зі збільшенням кількості енергетичних рівнів в атомах хімічних елементів збільшується їхній радіус.
Г Окисні властивості хлору виражені слабше, ніж фтору, бо окисні властивості простих речовин галогенів зростають зі збільшенням електронегативності атомів відповідних хімічних елементів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Електроліти й неелектроліти.
Завдання скеровано на перевірку вміння аналізувати склад речовин, визначати типи хімічних зв’язків у них і розпізнавати електроліти.
Електричний струм проводять розчини й розплави електролітів – речовин із йонним або ковалентним сильно полярним типами хімічного зв’язку.
Гідроген хлорид у водному розчині, натрій гідроксид і калій сульфат у розплавах дисоціюють на йони, тому є електролітами.
Етанол у водному розчині на йони не дисоціює, тому цей розчин не проводить електричний струм.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кислотні оксиди.
Завдання скеровано на перевірку вміння складати хімічну формулу кислоти за формулою її кислотного оксиду й навпаки.
Кислотні оксиди реагують із водою з утворенням кислот:
А
Б
В
Г
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Карбонатна кислота. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку вміння прогнозувати продукти реакції за участі солей карбонатної кислоти – карбонатів і гідрогенкарбонатів.
Для перетворення натрій гідрогенкарбонату – кислої солі – на натрій карбонат (середню сіль) потрібно використати луг:
Дією сильнішої за карбонатну етанової кислоти на натрій карбонат, можна добути карбон(IV) оксид:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Властивості і способи добування солей.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі неорганічних речовин.
А алюміній сульфід – сіль слабкої основи і слабкої кислоти, у водному розчині зазнає гідролізу, тому реакцією обміну її не добувають
Б алюміній як менш активний метал не може витіснити натрій із його солі у водному розчині
В продуктом реакції між металом алюмінієм і неметалом сіркою є сіль – алюміній сульфід
Г унаслідок гідролізу алюміній сульфату утворюються основні сульфати Алюмінію, а не алюміній сульфід
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі хлоридної кислоти.
А натрій карбонат як сіль слабкої кислоти реагує з розбавленою хлоридною кислотою, а мідь як малоактивний метал, що розташований в ряду активності до водню, – ні
Б як цинк, розташований в ряду активності до водню, так і барій гідроксид – луг – реагує з хлоридною кислотою:
В кислотний силіцій(ІV) оксид не реагує з хлоридною кислотою, а магній як метал, розташований в ряду активності до водню, реагує з нею
Г аргентум(I) нітрат реагує з розбавленою хлоридною кислотою з утворенням нерозчинного аргентум(I) хлориду, а срібло як малоактивний метал, що розташований в ряду активності до водню, – ні
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між солями у водному розчині.
Завдання скеровано на перевірку вміння аналізувати реакції обміну між солями у водному розчині.
Унаслідок реакції у водному розчині барій хлориду з натрій сульфідом осад не утворюється.
В інших трьох реакціях утворюються нерозчинні барій карбонат і барій сульфат, малорозчинний барій сульфіт (рис. 1).
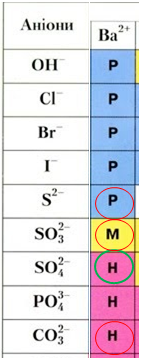
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, амфотерних гідроксидів і солей у воді за температури 20–25 °С»
Барій карбонат і барій сульфіт як солі слабких кислот реагують з розбавленою нітратною кислотою з виділенням карбон(IV) оксиду й гідроген сульфіду відповідно.
Тобто умову завдання задовольняє калій сульфат:
Продукт цієї реакції – барій сульфат – не розчиняється в розбавленій нітратній кислоті.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища розбавленого водного розчину солі з огляду на її хімічний склад і здатність до гідролізу.
Гідроліз – реакція солі з водою, що приводить до утворення слабкого або малорозчинного електроліту й зміни рН розчину. Може відбуватися за аніоном, коли сіль утворено катіоном сильної основи й аніоном слабкої кислоти (лужне середовище), або за катіоном, коли сіль утворено катіоном слабкої основи й аніоном сильної кислоти (кисле середовище). Солі сильних основ і кислот не зазнають гідролізу, їхні водні розчини мають нейтральну реакцію.
Калій силікат – сіль сильної основи (калій гідроксиду) і слабкої силікатної кислоти, тому середовище її водного розчину лужне.
Алюміній нітрат – сіль слабкої основи (алюміній гідроксиду) і слабкої силікатної кислоти, тому середовище її водного розчину кисле.
Натрій хлорид – сіль сильної основи (натрій гідроксиду) і сильної хлоридної кислоти, тому середовище її водного розчину нейтральне.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Алюміній гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Осади гідроксидів Магнію, Калію, Феруму(ІІ) розчиняться в кислоті й не розчиняться в надлишку розчину лугу.
Алюміній гідроксид амфотерний, тобто здатний залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид
Тобто речовина
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна формула. Масова частка хімічного елемента в речовині.
Завдання скеровано на перевірку вміння аналізувати якісний і кількісний склад речовини за її хімічною формулою, інтерпретувати інформацію, подану в графічній формі.
Масова частка хімічного елемента в речовині – це відношення маси хімічного елемента до маси речовини. Чим більша маса елемента в речовині, тим більша його масова частка в ній.
| 39 | 1 | 12 | 3 · 16 |
Скориставшись даними щодо відносних атомних мас хімічних елементів й індексів у формулі калій гідрогенкарбонату, можна дійти висновку, що масовій частці Карбону на діаграмі відповідає стовпчик B.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю, уміння кількісно оцінювати результати перебігу таких реакцій.
Скориставшись довідковою таблицею «Ряд активності металів», можна визначити, що кадмій і залізо витіснятимуть із солей свинець і мідь, оскільки в ряду активності вони розташовані лівіше від них:
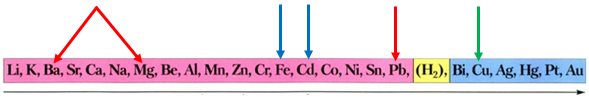
Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Вочевидь маса залізної пластинки збільшиться, а кадмієвої – зменшиться, якщо її занурити у водний розчин купрум(ІІ) нітрату. Унаслідок занурення в розчин плюмбум(ІІ) нітрату маса обох пластинок збільшиться.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває у стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
У всіх наведених варіантах відповіді йдеться про реакції, реагенти і продукти яких – гази. Тобто з-поміж реакцій потрібно вибрати ту, у якій загальний об’єм газів, формули яких зазначено в лівій частині хімічного рівняння, менший порівняно із загальним об’ємом газів, формули яких зазначено в його правій частині:
А
Б
В
Г
Цю умову задовольняє реакція Г. Вона ендотермічна (
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою, аналізувати інформацію, подану як у текстовій, так і в графічній формі.
Система, що перебуває у стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
В оборотній реакції, рівняння якої
І. З підвищенням температури збільшується об’ємна частка водню в рівноважній суміші, це означає, що підвищення температури сприяє зміщенню хімічної рівноваги вправо, тобто реакція ендотермічна. Підтвердженням цього також є перше речення умови, у якому зауважено, що за високих температур метан розкладається на прості речовини.
ІI. За тієї самої температури об’ємна частка водню в рівноважній суміші більша за тиску
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алканів. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості алканів для прогнозування типів і продуктів реакцій за їхньої участі.
Бутан є насиченим вуглеводнем, тому
А вступає в реакції відщеплення водню з утворенням
Б ізомеризується у 2-метилпропан
В НЕ ВСТУПАЄ в реакції приєднання
Г вступає в реакції заміщення з хлором за освітлення
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура алкенів.
Завдання скеровано на перевірку вміння називати алкени за систематичною номенклатурою.
Зі структурної формули, що містить подвійний зв’язок, зрозуміло, що йдеться про назву алкену розгалуженої будови.
Називати алкени за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).

Рис. 1. Алгоритм побудови назв алкенів й алкінів за систематичною номенклатурою
Зверніть увагу: положення подвійного зв’язку й замісників позначають найменшими числами, але перевагу у виборі початку нумерації віддають подвійному зв’язку (рис. 2).
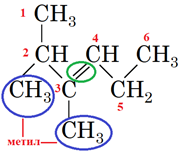
Рис. 2. Структурна формула 2,3-диметилгекс-3-ену
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нафта. Перегонка нафти.
Завдання скеровано на перевірку розуміння фізичних основ перегонки нафти.
І. Фракції нафти – продукти, які добувають із неї перегонкою і розрізняють за температурою кипіння, густиною й іншими властивостями: бензин, лігроїн, гас, мастила, залишковий гудрон.
ІІ. Перегонка нафти – спосіб її перероблення, що ґрунтується на відмінності в температурах кипіння складників цієї суміші. Під час перегонки нафти її складники випаровуються і конденсуються без перетворень одних речовин на інші.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Алкени. Арени.
Завдання скеровано на перевірку знання хімічних властивостей алканів, алкенів, аренів.
А Бензен, на відміну від етену, стійкий до дії розчину калій перманганату.
Б Ні бензен, ні пропан НЕ ВЗАЄМОДІЄ з бромною водою.
В Як бензен, такі пропан вступає в реакції заміщення.
Г Як бензен, так і етен вступає в реакцію гідрування.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Альдегідна й карбоксильна характеристичні групи.
Завдання скеровано на перевірку знання хімічних властивостей альдегідів і карбонових кислот.
Під дією водного розчину органічної речовини
Речовина
Цим двом умовам відповідає метанова кислота (рис. 1).
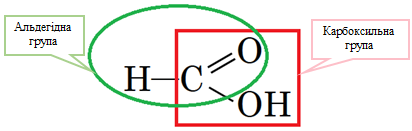
Рис. 1. Структурна формула метанової кислоти
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни. Анілін.
Завдання скеровано на перевірку знання хімічних властивостей аніліну, зумовленості їх взаємним впливом бензенового кільця й аміногрупи в його молекулі.
Для аніліну можливі реакції як за аміногрупою, так і за бензеновим кільцем. Особливості цих реакцій зумовлені взаємним впливом атомів у молекулі аніліну.
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього на атомі Нітрогену електронна густина зменшується, і тому зменшуються осно́вні властивості аміногрупи. Тож у воді анілін виявляє СЛАБШІ основні властивості, ніж метиламін.
Анілін реагує із сильними кислотами з утворенням солей бензенамонію:
Натомість у бензеновому кільці електронна густина збільшується, найсильніше – у положеннях 2, 4 і 6 відносно аміногрупи. Тому внаслідок добавляння бромної води до аніліну утворюється білий осад 2,4,6-трибромоаніліну:
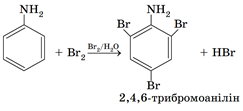
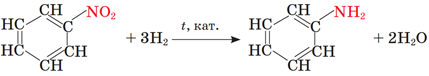
Анілін добувають відновленням нітробензену:
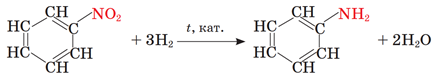
А аміногрупа в молекулі аніліну підвищує реакційну здатність бензенового кільця в реакціях заміщення
Б у воді виявляє СЛАБШІ основні властивості, ніж метиламін
В реагує з хлоридною кислотою, унаслідок чого утворюється сіль
Г можна добути відновленням нітробензену
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Етанол. Реакція дегідратації.
Завдання скеровано на перевірку знання хімічних властивостей спиртів.
Спирти вступають у реакцію дегідратації. За міжмолекулярної дегідратації від двох молекул спирту відщеплюється молекула води:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Багатоатомні спирти. Гліцерол.
Завдання скеровано на перевірку знання якісної реакції на гліцерол.
Як багатоатомний спирт гліцерол реагує зі свіжоосадженим купрум(ІІ) гідроксидом. За надлишку лугу утворюється прозорий розчин яскраво-синього кольору.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Альдегіди.
Завдання скеровано на перевірку розуміння суті реакції дегідрування і генетичних зв’язків між органічними речовинами різних класів.
Етаналь є продуктом каталітичної гідратації етину, тому варіанти відповіді Б і В не підходять.
Відщепленням молекули водню перетворити карбоксильну групу, що містить два атоми Оксигену, на альдегідну, у якій один атомом Оксигену, неможливо. Тому варіант відповіді А також не задовольняє умову завдання.
Єдиним правильним варіантом відповіді є Г – дегідрування – відщеплення молекули водню. Молекулярна формула етанолу
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол.
Завдання скеровано на перевірку вміння порівнювати кислотні властивості фенолу, карбонатної та хлоридної кислот.
Потрібно взяти до уваги, що хлоридна кислота (1) сильніша за карбонатну, тому витісняє її з натрій карбонату, водний розчин якого на рисунку позначено цифрою 2. Карбон(IV) оксид – продукт реакції натрій карбонату з хлоридною кислотою – витісняє фенол з натрій феноляту (3), що доводить: фенол є слабшою кислотою порівняно з карбонатною.
Ключовим в умові завдання є слово одночасно, тобто за допомогою одного досліду в тому самому приладі порівняно силу трьох кислот.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації і гідролізу естеру, уміння аналізувати склад і будову речовини за її хімічною формулою.
Речовина, структурну формулу якої наведено в умові завдання, належить до естерів і є продуктом реакції між спиртом і карбоновою кислотою. Загальну формулу естерів наведено на рисунку 1.
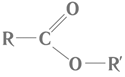
Рис. 1. Загальна формула естерів
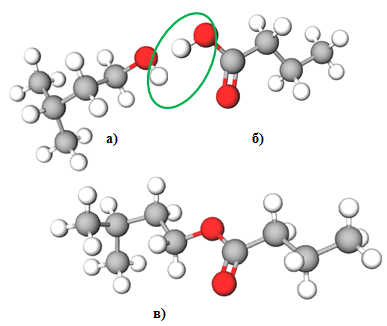
Рис. 2. Структурні формули 3-метилбутан-1-олу (а), бутанової кислоти (б), й естеру, утвореного ними (в)
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати реакції різних типів за участі органічних сполук.
1. Від молекули пропану відщеплюється молекула водню й утворюється молекула пропену, це реакція дегідрування.
2. До молекули пропену приєднується молекула води, це реакція гідратації.
3. Унаслідок реакції естерифікації зі спирту й карбонової кислоти утворюється естер.
Відповідь: 1В, 2Г, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Способи добування органічних речовин. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати реакції різних типів за участі органічних сполук і прогнозувати продукти цих перетворень.
1. Дегідруванням циклогексану (відщепленням трьох молекул водню) добувають бензен:
2. Відновленням нітробензену добувають анілін:
3. Гідролізом хлоробензену добувають фенол:
Відповідь: 1Б, 2Г, 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розпізнавання неорганічних речовин.
1. Реактивом на катіони Барію є сульфат-аніони, що є складниками сульфатної кислоти.
2. Реактивом на хлорид-аніони є катіони Аргентуму(І), що є складниками аргентум(І) нітрату.
3. З-поміж двох осадів – магній гідроксиду й цинк гідроксиду, що утворяться внаслідок добавляння розчину лугу, лише цинк гідроксид є амфотерним і розчиниться за надлишку лугу – калій гідроксиду.
Відповідь: 1В, 2А, 3Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1. Продуктом гідратації кальцій оксиду є одна складна речовина – кальцій гідроксид.
2. Унаслідок розкладання кальцій карбонату утворюються дві складні речовини – оксиди Кальцію і Карбону(IV).
3. Унаслідок розкладання гідроген пероксиду утворюються вода (складна речовина) і кисень (проста речовина).
Відповідь: 1В, 2Б, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання хімічних рівнянь.
Кількість атомів кожного з хімічних елементів у лівій і правій частинах рівняння мають бути однаковими:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини за її масою.
Дано:
Знайти:
Відповідь: 2.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу речовини за кількістю атомів хімічного елемента в її молекулі.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 7.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за масою реагенту.
Дано:
Знайти:
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за масою реагенту і його відносним виходом.
Дано:
Знайти:
Відповідь: 120.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини.
Завдання скеровано на перевірку вміння аналізувати інформацію щодо розчинності солей, подану в графічній формі.
Залежність розчинності речовин від температури виражають за допомогою кривих розчинності. Їх будують за експериментально здобутими даними. Для побудови кривої розчинності відкладають на горизонтальній осі температуру, а на вертикальній – розчинність речовини за відповідної температури.
За результатами аналізування кривої розчинності (рис. 1), наведеної в умові завдання, можна дійти висновку, що за температури 60 °С у воді масою 100 г розчинена сіль масою 200 г.
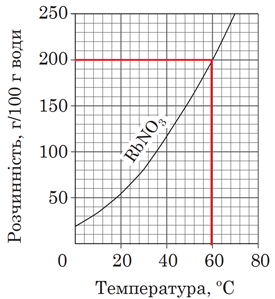
Рис. 1. Крива розчинності рубідій нітрату
Відповідно у воді масою 90 г розчинена сіль масою 180 г. А маса розчину дорівнює сумі мас солі й води. Вона становить 270 г.
Відповідь: 270.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Під час розв’язування задачі потрібно взяти до уваги, що частину води буде витрачено на реакцію з натрій оксидом, а в решті розчиниться натрій гідроксид.
Дано:
Знайти:
Відповідь: 207.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати молекулярну формулу речовини за відношенням мас елементів у продукті реакції за її участі.
Дано:
Знайти:
Відповідь: 56.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 85.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 400.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Молярні маси етану й метаналю однакові – 30 г/моль.
Відповідь: 40.
Знайшли помилку? Пишіть на









