ЗНО онлайн 2021 року з хімії – додаткова сесія
ТЕМА: Основні хімічні поняття. Хімічні формули. Прості речовини. Склад повітря.
Завдання скеровано на перевірку знання хімічних формул простих речовин – складників повітря.
Молекула азоту двохатомна, його хімічна формула
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неметали. Вуглець. Адсорбційні властивості активованого вугілля.
Завдання скеровано на перевірку розуміння зумовленості застосування активованого вугілля в медицині його властивостями.
Адсорбція (від лат. ad – на і лат. sorbeo – поглинаю) – вибіркове поглинання речовини з газового чи рідкого середовища поверхневим шаром твердого тіла (адсорбенту).
Активоване вугілля має велику поверхню з величезною кількістю дуже дрібних отворів – пор. Це зумовлює його велику вбирну здатність. Тому активоване вугілля використовують у медицині як адсорбент для поглинання токсичних речовин.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку знання визначення оксидів як класу неорганічних сполук, уміння визначати ступені окиснення хімічних елементів у сполуці за її хімічною формулою, розпізнавати оксиди за їхніми хімічними формулами.
Оксиди – бінарні сполуки Оксигену з іншими елементами, у яких ступінь окиснення атома чи атомів Оксигену становить –2. Цю умову не задовольняє натрій пероксид
А
Б
В
Г
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Хімічні формули.
Завдання скеровано на перевірку вміння інтерпретувати хімічні формули речовин.
У хімічній формулі кількість хімічних елементів визначають за кількістю їхніх символів.
| Формула речовини | Кількість хімічних елементів (видів атомів), якими утворена речовина |
| 4 |
|
| 1 |
|
| 3 |
|
| 3 |
|
| 2 |
|
| 2 |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Хімічні реакції.
Завдання скеровано на перевірку вміння відрізняти хімічні реакції від фізичних явищ за ознакою перетворення одних речовин на інші.
Під час плавлення льоду вода переходить з одного агрегатного стану в інший.
Унаслідок намагнічування залізо не зазнає хімічних перетворень.
Так само не змінюється хімічний склад цукру внаслідок подрібнення.
Унаслідок гасіння харчової соди оцтом утворюються нові речовини, зокрема вуглекислий газ:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Чисті речовини і суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад.
На рисунку схематично зображено розділення суміші двох рідин із різною густиною за допомогою ділильної лійки. Густина бензену менша за густину води, тому в ділильній лійці після розшаровування цих рідин шар бензену буде зверху, а води – знизу. Його можна видалити, відкривши кран ділильної лійки.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація речовин. Органічні й неорганічні речовини.
Завдання скеровано на перевірку знання характерної ознаки органічних речовин.
Органічні речовини є сполуками Карбону, тому кисень не належить до органічних речовин.
А
Б
В
Г
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні елементи й прості речовини. Поширеність хімічних елементів у природі.
Завдання скеровано на перевірку вміння відрізняти хімічний елемент (вид атомів) від простої речовини (форми існування хімічного елемента).
Білий фосфор і червоний фосфор – прості речовини, алотропні форми, у яких існує хімічний елемент Фосфор.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Солі. Хімічні властивості солей.
Завдання скеровано на перевірку знання продуктів термічного розкладання середніх і кислих солей, солей амонію, карбонатної та нітратної кислот.
Унаслідок розкладання амоній нітрату утворюються лише газуваті продукти:
Унаслідок розкладання решти речовин, про які йдеться в завданні, утворюються тверді залишки оксиду металічного елемента (А, Г) або солі (Б).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Оксиди. Основи. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей оксидів і способів добування лугів.
Луги добувають дією води на оксиди лужних елементів, Кальцію, Барію тощо. Кальцій оксид реагує з водою з утворенням кальцій гідроксиду. Решта оксидів, про які йдеться в завданні, з водою не реагують.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання класифікації хімічних реакцій за тепловим ефектом і переходом електронів під час їхнього перебігу.
Негашене вапно добувають прожарюванням вапняку. Реакція потребує постійного нагрівання, тобто відбувається із поглинанням теплової енергії. Тому ця реакція – ендотермічна.
Під час реакції ступені окиснення хімічних елементів не змінюються:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Як натрій, так і кальцій є активними металами, реагують iз водою з утворенням відповідного гідроксиду й виділенням газуватого водню. Обидві реакції є екзотермічними, унаслідок їхнього перебігу змінюються ступені окиснення хімічних елементів:
Однак кальцій гідроксид на відміну від натрій гідроксиду є малорозчинним (рис. 1).
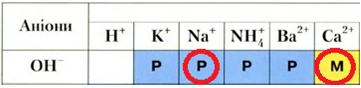
Рис. 1. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація неорганічних речовин. Генетичні зв’язки між класами неорганічних сполук. Способи добування солей.
Завдання скеровано на перевірку знання генетичних зв’язків між класами неорганічних сполук і способів добування солей.
Продуктами реакції гідроген сульфіду з киснем є вода й сульфур(ІV) оксид. Продукт реакції барій оксиду з водою – барій гідроксид – луг.
Гідроген хлорид реагує з амоніаком, а натрій із бромом з утворенням солей:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
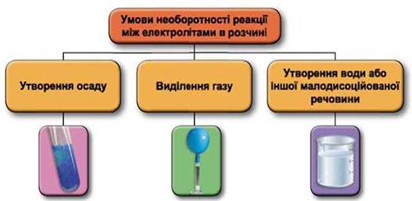
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Катіони Магнію взаємодіють із гідроксид-аніонами з утворенням осаду – малорозчинного магній гідроксиду.
Сульфат-аніони зв’язують катіони Барію в нерозчинний барій сульфат.
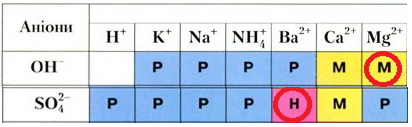
Рис. 2. Фрагмент таблиці «Розчинність основ, кислот, солей та амфотерних гідроксидів у воді за температури 20–25 °С»
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати властивості хімічних елементів за їхнім положенням у періодичній системі.
Силіцій, Фосфор, Сульфур, Хлор – елементи третього періоду. Чим більше протонне число елемента, тим менше радіус його атома й більша електронегативність порівняно з іншими елементами цього ж періоду. Тож в ряду хімічних елементів Силіцій, Фосфор, Сульфур, Хлор радіус атома зменшується, а електронегативність збільшується.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Електронна будова атомів і простих йонів.
Завдання скеровано на перевірку вміння визначати електронну будову атомів і простих йонів.
В атомі Аргону 18 електронів, у катіоні
В атомі Неону 10 електронів, в аніоні
Ці хімічні елементи утворюють сіль, формула якої
Електронегативність Флуору найвища поміж хімічних елементів. Тому його атом не віддає електрони іншим атомам. Максимальний ступінь окиснення Флуору – 0.
Флуор утворює просту речовину фтор, формула якого
Кальцій – типовий металічний елемент.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
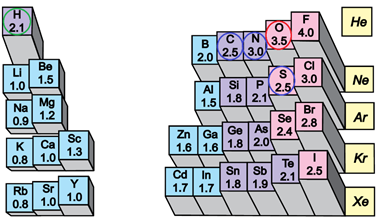
Рис. 1. Електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчину солей і забарвлення індикатора в них.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою i сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою i слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
| Сіль | утворена | Реакція середовища водного розчину | Забарвлення фенолфталеїну у водному розчині | |
| Хімічна формула | основою | кислотою | ||
| сильною | слабкою | лужне | малинове | |
| сильною | сильною | нейтральне | – | |
| слабкою | сильною | кисле | – | |
| сильною | слабкою | лужне | малинове | |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і забарвлення індикатора в них.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
| Сіль | утворена | Гідроліз | |
| Назва | основою | кислотою | |
| Амоній етаноат | слабкою | слабкою | за катіоном і за аніоном |
| Натрій етаноат | сильною | слабкою | за аніоном |
| Калій нітрат | сильною | сильною | не відбувається |
| Цинк нітрат | слабкою | сильною | за катіоном |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що у водному розчині цинк як активніший метал витіснить залізо з ферум(ІІ) хлориду, залізо – свинець, кадмій – мідь, а нікель як менш активний метал не витіснить цинк.
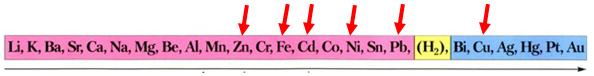
Активність металів зменшується
Рис. 1. Ряд активності металів
Після цього потрібно порівняти відносні атомні маси цих елементів (їх зазначено в довідковій таблиці «Періодична система хімічних елементів»):
Зрозуміло, що лише маса залізної пластинки збільшиться, якщо її занурити у водний розчин плюмбум(ІІ) етаноату, бо атомна маса Плюмбуму більша за атомну масу Феруму.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Алюміній гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерність – здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості.
Алюміній гідроксид амфотерний, тобто здатний залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид
Тобто лише в досліді Г йдеться про амфотерні властивості алюміній гідроксиду:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
1 Зменшення концентрації газуватого метанолу в суміші зумовить зміщення рівноваги в праву частину рівняння.
2 Зміщенню рівноваги в бік утворення карбон(ІІ) оксиду сприятиме зменшення концентрації водню. Оскільки система намагатиметься компенсувати це зменшення, то рівновага зміститься в бік утворення водню і, відповідно, карбон(ІІ) оксиду.
3 Ця реакція екзотермічна, тому підвищення температури приведе до зсування хімічної рівноваги в бік розкладання метанолу на водень і карбон(ІІ) оксид.
4 Підвищення тиску зсуватиме хімічну рівновагу вправо, бо внаслідок прямої реакції об’єм газу зменшується, тож зменшується і тиск, який він справляє:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага, принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для керування хімічною рівновагою.
Система, що перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом прагне повернутися до стану рівноваги, компенсувавши його дію.
Проаналізувавши рівняння оборотної реакції
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку знання складу нафти, розуміння відмінності між складною речовиною і сумішшю.
Нафта – багатокомпонентна суміш, а не складна речовина.
Метан – головний складник природного газу.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
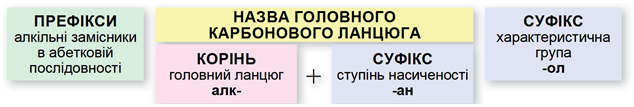
Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
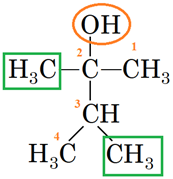
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу чотири атоми Карбону. Із другим атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 2,3-диметилбутан-2-ол.
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку вміння прогнозувати типи хімічних реакцій за участю органічних речовин з огляду на їхні структурні формули.
A Ізомери – речовини, що мають однакову молекулярну формулу, але різну будову молекул, а тому – різні властивості. Молекулярна формула речовини 1
Б У молекулі речовини 3 п’ять атомів Карбону, а в молекулі бутану – чотири. Тому речовина 3 не може бути продуктом ізомеризації бутану.
B У реакції приєднання вступають ненасичені сполуки 1 і 2 (алкен й алкін відповідно). Речовина 3 є насиченим вуглеводнем і в реакцію приєднання не вступає.
Г Кожна із цих речовин вступає в реакцію хлорування, для речовин 1 і 2 характерні реакції приєднання за місцем кратного зв’язку, для речовини 3 – реакція заміщення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей етану, етену, бензену, уміння класифікувати хімічні реакції за їхньої участі.
А як етан, так й етен вступають у реакції заміщення
Б як молекули бензену, так і молекули етену здатні приєднувати молекули водню
В тримеризація етину – один зі способів добування бензену
Г молекула бензену дуже стійка, тому бензен не реагує з бромною водою
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між вуглеводнями й оксигеновмісними органічними сполуками.
А гідратацією етину добувають етаналь
Б продуктом гідруванням етену є етан
В унаслідок гідрування етаналю утворюється етанол:
Г продуктами гідролізу метилетаноату є метанол й етанова кислота
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання складу й властивостей сахарози.
А молекула сахарози утворена залишком молекули глюкози й залишком молекули фруктози, тобто сахароза є дисахаридом
Б сахароза добре розчиняється у воді
В з йодом із утворенням речовини синього кольору реагує крохмаль, а не сахароза
Г молекула сахарози складається із залишків молекул глюкози й фруктози
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Характеристичні (функціональні) групи.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних речовин і прогнозувати їхні властивості за характеристичними (функціональними) групами в молекулах цих сполук.
Молекулярна формула речовини, про яку йдеться в завданні,
У молекулі речовини є карбоксильна
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Характеристичні (функціональні) групи. Взаємний вплив атомів у молекулах органічних речовин.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних речовин й обґрунтовувати властивості речовин будовою їхніх молекул.
Найслабші кислотні властивості з-поміж речовин, про які йдеться в завданні, виявляє етанол (B). У його молекулі гідроксильна група сполучена з алкільним замісником, якому властивий надлишок електронної густини, що послаблює полярність зв’язку в характеристичній групі
Фенол порівняно з етанолом виявляє сильніші кислотні властивості, бо арильний замісник
Етанова кислота виявляє сильніші властивості порівняно з фенолом і слабші порівняно з метановою кислотою. Це зумовлено тим, що в молекулі метанової кислоти немає алкільного замісника, який послаблює полярність зв’язку в характеристичній групі
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції органічних сполук.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на органічні речовини для їхнього ідентифікування.
Водно-спиртовий розчин є реактивом на крохмаль. Поява синього забарвлення в посудині 1 свідчить, що в ній містився рідкий крохмальний клейстер. Тобто умову завдання не задовольняють варіанти відповіді Б і В.
Утворення в посудині 2 білого осаду під дією етанолу підтверджує, що в ній містився водний розчин білка курячого яйця, який під дією спирту зазнав денатурації.
Глюкоза є альдегідоспиртом і без нагрівання реагує з купрум(ІІ) гідроксидом як багатоатомний спирт. Адже в її молекулі є п’ять гідроксильних груп біля сусідніх атомів Карбону. Так само з купрум(ІІ) гідроксидом реагує триатомний спирт гліцерол.
За нагрівання реакція глюкози з купрум(ІІ) гідроксидом відбувається за участі альдегідної групи: глюкоза окиснюється до глюконової кислоти, а купрум(ІІ) гідроксид відновлюється до купрум(І) гідроксиду. Ця речовина жовтого кольору за нагрівання розкладається на цегляно-червоний купрум(І) оксид і воду:
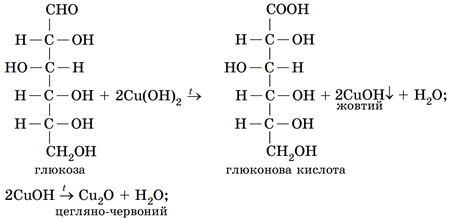
Тобто в посудині 3 містився водний розчин гліцеролу, а в посудині 4 – глюкози.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Карбонові кислоти. Метанова кислота.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних речовин і пояснювати їхньою будовою властивості цих сполук.
A у реакції з магнієм атоми Гідрогену в карбоксильній групі метанової кислоти є окисниками
Б реакція метанової кислоти з натрій гідрогенкарбонатом не є окисно-відновною
B амоніачний розчин аргентум(І) оксиду окиснює метанову кислоту до вуглекислого газу й води
Г реакція нейтралізації не є окисно-відновною
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння пояснювати властивості амінокислот будовою їхніх молекул.
Показник
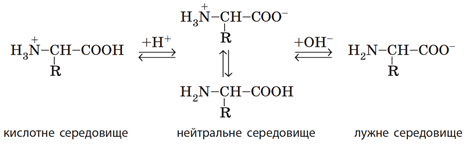
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії. Етанол.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій за участі органічних сполук і класифікувати ці реакції.
Унаслідок внутрішньомолекулярної дегідратації (1) етанолу утворюється етен (Б) і вода:
Продуктом міжмолекулярної дегідратації (2) етанолу є діетиловий етер (Д):
Частковим окисненням (3) етанолу можна добути етаналь (В):
Відповідь: 1Б, 2Д, 3В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання властивостей органічних і неорганічних речовин, уміння аналізувати рівняння реакцій за їхньої участі.
1 продуктами горіння амоніаку в кисні є азот і вода (Д):
2 унаслідок термічного розкладання метану утворюються ацетилен і водень (Г):
3 продукти термічного розкладання амоній карбонату – амоніак, карбон(IV)оксид і вода (А):
Відповідь: 1Д, 2Г, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Ізомерія. Хімічні властивості.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних речовин, обґрунтовувати їхні властивості будовою молекул.
1 ізомером речовини A є речовина Д, оскільки в них та сама молекулярна формула
2 речовину Б можна добути окисненням речовини А:
3 речовина В – один із продуктів кислотного гідролізу речовини Г:
Відповідь: 1Д, 2А, 3В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Гідроліз солей. Умови необоротності реакцій між електролітами у водних розчинах.
Завдання скеровано на перевірку вміння прогнозувати реакцію середовища водних розчинів солей і можливість перебігу реакцій між електролітами у водних розчинах.
Гідроліз солі – реакція йонного обміну між йонами солі й молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
Гідроліз солі, утвореної слабкою основою і сильною кислотою, – це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислим.
Гідроліз солі, утвореної сильною основою і слабкою кислотою, – це гідроліз за аніоном.
Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається як за катіоном, так і за аніоном. Реакція середовища нейтральна.
Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу. Реакція середовища нейтральна.
Кисле середовище у водних розчинах плюмбум(ІІ) нітрату й цинк сульфату, нейтральне – натрій хлориду й калій нітрату. У водному розчині натрій карбонату середовище лужне.
Тобто в посудинах 1 і 3 можуть міститися розчини плюмбум(ІІ) нітрату й цинк сульфату, а в посудині 2 – натрій хлориду й калій нітрату.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
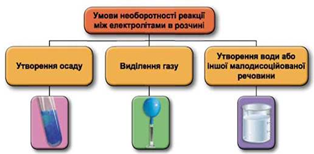
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Тобто розчин калій нітрату не може міститися в посудині 2, бо із жодною із солей, про які йдеться в завданні, не реагує. Отже, у посудині 2 міститься водний розчин натрій хлориду.
Потрібно розрізнити розчини двох солей – цинк сульфату та плюмбум(ІІ) нітрату. Плюмбум(ІІ) нітрат у водному розчині реагує як із натрій хлоридом, так й із цинк сульфатом з утворенням малорозчинних плюмбум(ІІ) хлориду й плюмбум(ІІ) сульфату. Тобто розчин плюмбум(ІІ) нітрат міститься в посудині 1, а цинк сульфату – у посудині 3.
| Номер посудини | 1 |
2 |
3 |
| 1 |
|||
| 2 |
– | ||
| 3 |
– |
Відповідь: 1В, 2Б, 3А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічні рівняння.
Завдання скеровано на перевірку вміння добирати коефіцієнти для перетворення схем реакцій на хімічні рівняння на основі закону збереження маси речовин.
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
Знайти:
Відповідь: 31.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватої речовини за її кількістю.
Дано:
Знайти:
Відповідь: 224.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість атомів хімічних елементів у молекулах алканів за загальною формулою вуглеводнів цього гомологічного ряду.
Загальна формула вуглеводнів гомологічного ряду алканів
Відповідь: 64.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку складника суміші газів за його об’ємною часткою.
Дано:
Знайти:
Відповідь: 68.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції за його масою і масою одного з реагентів.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 90.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Знайти:
120 г становить 25 частин, 1 частина – маса другого розчину – 4,8 г
24 частини – маса першого розчину, яка становить 115,2 г.
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння використовувати закон збереження маси для визначення хімічної формули речовини.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 55.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння використовувати закон збереження маси для визначення хімічної формули речовини.
Дано:
Знайти:
Якщо вуглеводень є алкеном, то
Алкіном шуканий вуглеводень бути не може, оскільки рівняння
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати задачі за рівняннями хімічних реакцій.
Дано:
Знайти:
Відповідь: 35.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати задачі за рівняннями хімічних реакцій.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 40.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі за рівняннями хімічних реакцій.
Дано:
Знайти:
За умовою задачі
За рівнянням реакції:
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі за рівняннями хімічних реакцій.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на




