НМТ онлайн 2024 року з хімії – 1 сесія
Тестові завдання першої сесії національного мультитесту (ЗНО) 2024 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний і кількісний склад речовини за хімічною формулою.
Хімічна формула – це умовний запис якісного і кількісного складу речовини за допомогою символів хімічних елементів й індексів.
З-поміж наведених хімічних формул треба знайти ту, яка містить три символи хімічних елементів. Цій умові не відповідає лише формула
У молекулі речовини, формула якої
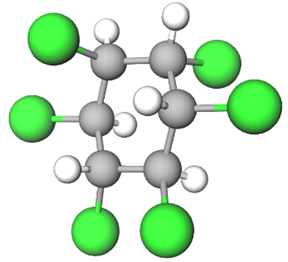
У молекулі речовини, формула якої
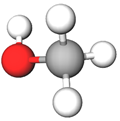
У молекулі речовини, формула якої
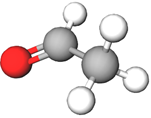
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нуклід.
Завдання скеровано на перевірку вміння тлумачити нуклідні символи й порівнювати склад ядер атомів.
Нуклідний символ – символ частинки, біля якого зазначені: масове (нуклонне) число – лівий надрядковий індекс, атомний номер – лівий підрядковий індекс. Якщо частинка має електричний заряд, його позначають правим надрядковим індексом
| Нуклідний символ | A |
Б |
В |
Г |
| Протонне число (дорівнює порядковому номеру хімічного елемента в періодичній таблиці) | ||||
| Нуклонне число (дорівнює сумі кількості протонів і нейтронів) | ||||
| Кількість нейтронів (дорівнює різниці нуклонного й протонного чисел) |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни властивостей хімічних елементів у періодичній таблиці.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах періодичної таблиці електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Електронегативність хімічних елементів збільшується в
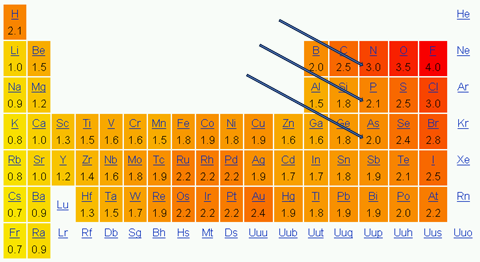
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку вміння за складом і властивостями речовини визначати тип кристалічних ґраток.
Кварц
Мідь
Кальцій карбонат
Мідь
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Кисень. Склад повітря.
Завдання скеровано на перевірку знання вмісту кисню в повітрі й уміння тлумачити діаграми.
Об’ємна частка кисню в повітрі становить приблизно
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Реакції йонного обміну.
Завдання скеровано на перевірку вміння застосовувати знання про необоротність реакцій йонного обміну в розчині для прогнозування перебігу реакцій.
У разі використання розчину сульфатної кислоти іншим реактантом може бути лише натрій гідроксид. Бо в разі використання барій гідроксиду утвориться осад барій сульфату, який у воді не розчиняється. Тож скорочене йонне рівняння буде іншим:
У разі використання натрій гідроксиду іншим реактантом може бути і хлоридна, і сульфатна кислоти:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Амоніак.
Завдання скеровано на перевірку знання способу добування амоніаку й уміння розпізнавати хімічні реакції різних типів.
Азот реагує з воднем з утворенням амоніаку. З двох простих речовин утворюється складна. Тобто синтез амоніаку з простих речовин є реакцією сполучення:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння аналізувати переходи електронів в окисно-відновних реакціях, визначати окисники й відновники.
Три електрони беруть участь у відновленні заліза з ферум(ІІІ) оксиду (окисник) чадним газом:
У реакції окиснення заліза хлором атом Хлору (окисник) приймає один електрон:
У реакції гідролізу фосфор(V) оксиду ступені окиснення хімічних елементів не змінюються.
У реакції окиснення фосфор(III) хлориду хлором кожен атом Хлору, який був у молекулі хлору (окисник), приймає один електрон:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Оборотні реакції. Умови зміщення хімічної рівноваги. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння аналізувати рівняння оборотних реакцій і застосовувати принцип Ле Шательє для прогнозування зміщення хімічної рівноваги внаслідок зміни температури, тиску, концентрації реагентів тощо.
Якщо система в станi рiвноваги зазнає певної дiї, то рівновага в системі зміститься так, щоб зменшити вплив цiєї дiї.
Унаслідок перебігу прямої реакції тиск підвищується, бо
Ця реакція ендотермічна
Тобто утворенню карбон(ІІ) оксиду й водню сприяють зниження тиску й підвищення температури.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Метали. Нітратна і сульфатна кислоти.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій металів, основних оксидів металічних елементів, солей із кислотами.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Оксиди і леткі сполуки з Гідрогеном неметалічних елементів. Індикатори.
Завдання скеровано на перевірку знання властивостей оксидів і летких сполук із Гідрогеном неметалічних елементів, уміння прогнозувати кольори індикаторів у водних розчинах лугів і кислот.
Водні розчини карбон(ІІ) оксиду й метану не містять катіонів Гідрогену чи гідроксид-аніонів, тому не діють ні на фенолфталеїн, ні на метиловий оранжевий.
Водний розчин амоніаку містить гідроксид-аніони, тому фенолфталеїн набуде під їхньою дією малинового забарвлення. Отже, цей варіант не задовольняє умову завдання:
Водний розчин гідроген хлориду містить катіони Гідрогену, під дією яких метиловий оранжевий змінює оранжеве забарвлення на рожеве:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Луги. Оксиди. Хімічні властивості натрій гідроксиду й фосфор(V) оксиду.
Завдання скеровано на перевірку знання властивостей лугів і кислотних оксидів, уміння прогнозувати й пояснювати спостереження.
Натрій гідроксид і фосфор(V) оксид – гігроскопічні речовини, тобто легко вбирають водяну пару з повітря. Фосфор(V) оксид реагує з водою з утворенням ортофосфатної кислоти. Тому маси посудин із обома речовинами збільшаться.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Солі.
Завдання скеровано на перевірку знання властивостей солей.
Етанова кислота слабка, тому не зможе витіснити нітратну кислоту з амоній нітрату.
З-поміж амоній карбонату, магній карбонату й кальцій сульфіду і з калій гідроксидом, і з етановою кислотою прореагує лише амоній карбонат. В обох реакціях виділиться газ. У реакції амоній карбонату з концентрованим розчином лугу виділиться амоніак, а в реакції з етановою кислотою – карбон(IV) оксид:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Амфотерність. Цинк оксид і цинк гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерність – здатність речовин реагувати і з кислотами, і з лугами.
Цинк оксид є амфотерним гідроксидом, бо реагує з кислотами як основний оксид, а з лугами – як кислотний.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Закон збереження маси.
Завдання скеровано на перевірку розуміння закону збереження маси речовини в хімічних реакціях і вміння застосовувати його для визначення складу реагентів.
У хімічних реакціях сума мас реактантів дорівнює сумі мас продуктів реакції, адже атоми не зникають, а лише перегруповуються. Тому розрахунки дають змогу визначити, що в молекулі вуглеводню три атоми Карбону й вісім атомів Гідрогену:
Тобто невідомий вуглеводень – пропан, представник алканів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Хімічні властивості вуглеводнів.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів різних груп.
Бензен (арен) й етин (алкін) вступають у реакції приєднання.
Бензен (арен) й етан (алкан) вступають в реакції заміщення.
Під дією етину (алкіну) й етену (алкену) бромна вода знебарвлюється внаслідок хімічної реакції.
Етан (алкан) і бензен (арен) не реагують із бромом, розчиненим у воді.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Хімічні властивості вуглеводнів.
Завдання скеровано на перевірку вміння виявляти генетичні зв’язки між органічними речовинами різних класів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол.
Завдання скеровано на перевірку вміння прогнозувати можливість реакції фенолу з лужними металами, лугами, галогенами, гідроген галогенідами.
Фенол реагує з натрієм, натрій гідроксидом, бромом:
Фенол не реагує з бромідною кислотою.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вищі карбонові кислоти. Жири. Мило.
Завдання скеровано на перевірку знання хімічних реакцій, на яких ґрунтується виробництво мила.
Мила – натрієві і калієві солі вищих карбонових кислот. Оскільки вищі карбонові кислоти, зокрема стеаринова, утворюються внаслідок лужного гідролізу тригліцеридів. Продуктами реакції тристеарату з калій гідроксидом є калій стеарат
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Гідроліз дисахаридів. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії, уміння аналізувати рівняння реакції гідролізу.
Сполука
За законом збереження маси речовини в хімічних реакціях
Таку саму формулу має сахароза.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку вміння називати аміни за систематичною номенклатурою.
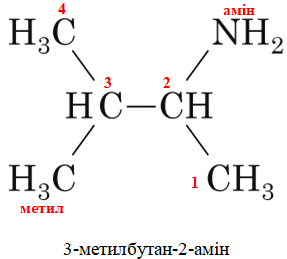
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Синтетичні високомолекулярні органічні сполуки. Капрон.
Завдання скеровано на перевірку вміння аналізувати схему реакції поліконденсації.
Капрон є синтетичним поліамідним волокном, полімерний ланцюг якого містить амідні групи.
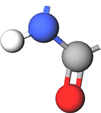
Капрон добувають поліконденсацією молекул 6-аміногексанової кислоти, кожна з яких містить карбоксильну групу
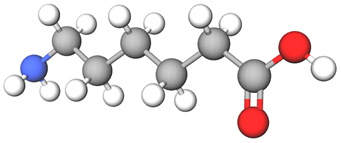
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними сполуками різних класів.
Завдання скеровано на перевірку вміння розпізнавати характеристичні (функціональні групи) в молекулах органічних речовин, прогнозувати властивості органічних сполук за їхньою будовою.
Речовина А – вища ненасичена карбонова кислота
Речовина Б – вищий насичений одноатомний спирт
Речовина В – вища насичена карбонова кислота
Речовина Г – вищий ненасичений спирт, вуглеводневий замісник якого може містити кратні зв’язки.
Речовина Д – вищий насичений альдегід
1 Ненасиченими можуть бути сполуки А та Г. 2 Містять карбоксильну групу сполуки В та А. 3 Унаслідок часткового окиснення спирт Б перетворюється на альдегід Д.
Відповідь: 1Г; 2А; 3Д.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Солі. Гідроліз солей.
Завдання скеровано на перевірку розуміння суті гідролізу солі як реакції обміну з водою, уміння прогнозувати реакцію середовища водного розчину солі внаслідок гідролізу.
Калій сульфат – сіль сильної основи
Натрій сульфід – сіль сильної основи
Тобто внаслідок розчинення натрій сульфіду показник pH спочатку зростатиме аж до повного розчинення, після – не змінюватиметься (Б).
Алюміній нітрат – сіль слабкої основи
Тобто внаслідок розчинення алюміній нітрату показник pH спочатку зменшуватиметься аж до повного розчинення, після – не змінюватиметься (А).
Відповідь: 1Г; 2Б; 3А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини. Обчислення кількості речовини за масою.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу, обчислювати молярну масу речовини й кількість речовини за її масою.
Формула озону
Молярна маса озону
Кількість речовини озону є часткою від ділення маси озону на молярну масу:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення молярної маси за формулою речовини.
Завдання скеровано на перевірку вміння аналізувати структурну формулу речовини, визначати за нею молекулярну формулу, обчислювати молярну масу речовини.
Аналізування структурної формули дає змогу визначити кількість атомів Карбону, Гідрогену, Оксигену в молекулі речовини й написати молекулярну формулу:
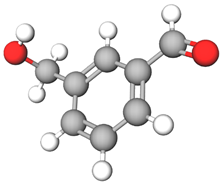
Відповідь: 124.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини. Обчислення маси складників розчину.
Завдання скеровано на перевірку вміння аналізувати кількісні дані щодо складу розчину, обчислювати маси його складників.
Загальне співвідношення компонентів у розчині:
маса пропан-2-олу:
маса води:
Разом
Відповідь: 70.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі за хімічними рівняннями.
За рівнянням реакції
Відповідь: 74.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями маси продукту, якщо один із реактантів у надлишку. Відносний вихід продукту реакції.
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі за хімічними рівняннями.
За рівнянням
Кисень у надлишку, обчислюємо масу магній оксиду, що утворився, за масою магнію, який у реакції витратиться повністю:
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Суміші. Обчислення масової частки
Завдання скеровано на перевірку вміння розв’язувати розрахункові задачі за хімічними рівняннями.
За рівнянням
Кисень у надлишку, тому після повного окиснення чадного газу до вуглекислого об’єм кисню зменшиться на
Унаслідок повного окиснення чадного газу об’ємом
Сумарний об’єм газової суміші після реакції:
Об’ємна частка кисню в цій суміші:
Відповідь: 60.
Знайшли помилку? Пишіть на




