НМТ онлайн 2025 року з хімії – 1 сесія
ТЕМА: Основні хімічні поняття. Хімічні явища. Хімічна реакція.
Завдання скеровано на перевірку базового хімічного мислення тестованих – здатності розрізняти фізичні і хімічні явища реального життя.
| Варіант відповіді | Явище | Процес | Тип явища | Пояснення |
| А | Подрібнення крейди | Зміна форми, розміру частинок речовини | Фізичне | Крейда залишається тією ж речовиною |
| Б | Бродіння яблучного соку | Перетворення цукрів на спирт і вуглекислий газ | Хімічне | Відбувається реакція: цукри → етанол + вуглекислий газ. Це біохімічна реакція за участі ферментів |
| B | Тверднення розплавленого парафіну | Зміна агрегатного стану | Фізичне | Парафін залишається парафіном, нові речовини не утворюються |
| Г | Розшарування суміші води й олії | Розділення фаз | Фізичне | Вода й олія за описаних умов не реагують одна з одною, вони просто не змішуються, тобто нові речовини не утворюються |
Бродіння яблучного соку – це хімічне явище, бо з вуглеводів утворюються нові речовини: етанол, вуглекислий газ. Про перебіг реакції свідчать зміна смаку, запаху, виділення газу.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Ізотопи. Нуклонне число.
Завдання скеровано на перевірку знання будови атомного ядра, розуміння суті ізотопії, уміння обчислювати нуклонне число, порівнювати атоми за складом і робити висновки.
| Варіант відповіді | Твердження | Аналіз твердження | Висновок |
| А | Атоми |
Ізотопи — це атоми одного елемента (однакова кількість протонів), але з різною кількістю нейтронів. Атоми |
Неправильно |
| Б | Нуклонні числа атомів |
Нуклонне число дорівнює сумі кількостей протонів і нейтронів. Тобто нуклонні числа атомів |
Правильно |
| B | Атоми |
Атоми електронейтральні, бо кількість електронів дорівнює кількості протонів. Атоми |
Неправильно |
| Г | Нуклонне число атома |
Нуклонне число дорівнює сумі кількостей протонів і нейтронів. Тобто нуклонні числа атомів |
Неправильно |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів. Метали і неметали.
Завдання скеровано на перевірку знання ознак неметалів і їхнього місця в періодичній таблиці, уміння класифікувати хімічні елементи за їхніми фізико-хімічними властивостями.
У фрагменті таблиці наведено хімічні символи й зазначено відносні атомні маси десяти елементів. З-поміж них п’ять хімічних елементів належать до неметалічних: Бор, Карбон, Нітроген, Силіцій і Фосфор.
Такого висновку легко дійти, якщо взяти до уваги, що елементи побічних підгруп (у наведеному фрагменті таблиці це Скандій, Титан, Ванадій) є металічними. Алюміній – типовий металічний елемент, а в Галію металічні властивості виражені сильніше, ніж в Алюмінію, бо електрони зовнішнього енергетичного рівня розташовані на більшій відстані від ядра атома. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах – знизу догори.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Oкиснення і відновлення. Ступені окиснення хімічних елементів.
Завдання скеровано на перевірку знання правил визначення ступеня окиснення хімічних елементів у складних йонах, уміння застосовувати логіку й математичні обчислення для визначення ступенів окиснення.
| Формула йона | ||
| Ступінь окиснення Оксигену в йоні | ||
| Загальний заряд йона | ||
| Обчислення загального заряду складного йона, де |
||
| Обчислення числового значення ступеня окиснення Хлору в складному йоні | ||
| Ступінь окиснення Хлору в складному йоні |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Масова частка речовини. Властивості однорідних сумішей.
Завдання скеровано на перевірку розуміння поняття масової частки речовини в розчині.
| Маса води в посудині І | |
| Маса солі в посудині І | |
| Загальна маса розчину в посудині І | |
| Маса розчину, перенесеного в посудину ІІ |
Маса розчинів у посудинах І і ІІ різна (
Маса солі в розчинах І і ІІ різна, бо різна маса цих розчинів.
Маса води в розчинах І і ІІ різна, бо різна маса цих розчинів.
Масова частка солі (відношення маси розчиненої солі до маси розчину) у розчинах І та ІІ однакова, бо розчин ІІ є частиною розчину І.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Кислоти. Луги. Реакція нейтралізації. Кількісні відношення речовин у хімічних реакціях.
Завдання скеровано на перевірку розуміння процесу нейтралізації між кислотою та основою, уміння зіставляти відношення об’ємів розчинів із відношеннями кількостей речовини в них, застосовувати поняття pH як показника рівноваги між йонами
| Варіант відповіді | Запис | Аналіз запису | Висновок |
| А | Це означало б, що кількість йонів |
Неправильно | |
| Б | Маси кислоти й лугу можуть бути рівні, але це не є достатньою умовою рівності кількості йонів |
Неправильно | |
| B | Це і є умова повної нейтралізації, унаслідок якої |
Правильно | |
| Г | Рівність мас йонів не означає рівності їхньої кількості, бо молярні маси цих йонів різні | Неправильно |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Закон збереження маси речовини в хімічних реакціях. Хімічні рівняння.
Завдання скеровано на перевірку вміння аналізувати хімічні рівняння.
| Варіант відповіді | Запис | Кількість атомів / йонів | Висновок |
| А | Кількість йонів Натрію в правій частині запису більша, ніж у лівій (два проти одного) | Неправильно | |
| Б | Атомів Гідрогену – два, йонів Натрію – один, атомів Нітрогену – один, Oксигену – чотири й у лівій, і в правій частині запису | Правильно | |
| B | Кількість атомів Гідрогену в правій частині запису більша, ніж у лівій (три проти двох) | Неправильно | |
| Г | Ліва і права частини запису різняться кількостями атомів Нітрогену (два проти одного), Oксигену (шість проти чотирьох) й Гідрогену (один проти двох) | Неправильно |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Окисно-відновні властивості хімічних елементів. Сульфур як окисник і відновник.
Завдання скеровано на перевірку розуміння змін ступенів окиснення Сульфуру в різних сполуках, уміння визначати, у яких речовинах Сульфур може проявляти й окисні, і відновні властивості.
| Формула речовини | Ступінь окиснення Сульфуру | Здатність бути | |
| окисником | відновником | ||
У сульфатній кислоті Сульфур виявляє найвищий ступінь окиснення
У сірці й сульфур(IV) оксиді Сульфур має проміжні ступені окиснення
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні реакції. Тепловий ефект хімічних реакцій. Об’ємні відношення газів у хімічних реакціях.
Завдання скеровано на перевірку вміння аналізувати перебіг хімічної реакції, класифікувати реакції за тепловим ефектом.
Унаслідок збільшення тиску рівноважна об’ємна частка складної речовини зростає (наприклад, за
Унаслідок підвищення температури рівноважна частка складної речовини зменшується (наприклад, за
Отже, правильне продовження висновку: «Реакція сполучення відбувається зі зменшенням об’єму, є екзотермічною».
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Кислоти. Основи. Реакція нейтралізації. Утворення солей.
Завдання скеровано на перевірку розуміння процесу нейтралізації між лугом (основою) і кислотою, уміння визначати продукт реакції – сіль – залежно від складу реактантів, називати солі за систематичною номенклатурою.
| Варіант відповіді | Назва й формула солі | Сіль | Висновок |
| А | Алюміній хлорид |
Є продуктом реакції між нерозчинним гідроксидом і хлоридною кислотою | Неправильно |
| Б | Літій сульфат |
Є продуктом реакції між лугом і сульфатною кислотою |
Правильно |
| B | Купрум(ІІ) нітрат |
Є продуктом реакції між нерозчинним гідроксидом і нітратною кислотою | Неправильно |
| Г | Цинк етаноат |
Є продуктом реакції між нерозчинним гідроксидом й етановою кислотою | Неправильно |
Усі кислоти, про які йдеться в завданні, розчинні у воді. Лугом (розчинною основою) є лише літій гідроксид.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Взаємодія металів із кислотами. Виділення водню. Кількісний аналіз реакцій.
Завдання скеровано на перевірку розуміння хімізму реакції металу з кислотою з утворенням водню, уміння співвідносити масу металу з кількістю речовини й об’ємом водню, що виділиться, застосовувати поняття молярної маси й молярного об’єму для порівняння кількості водню, що утворюється.
Загальний вигляд рівняння реакцій зазначених металів із розведеною хлоридною кислотою такий:
Розв’язання завдання ґрунтується на розумінні закономірностей:
1) що більша молярна масу металу, то менша його кількість речовини за однакових мас металів;
2) що більша кількість речовини металу, то більші кількість речовини й, відповідно, об’єм водню, що виділяється, якщо ступені окиснення металічних елементів у солях, однакові.
Тобто що більша молярна маса металу, то менша його кількість речовини і, відповідно, менший об’єм водню, який виділяється (за однакової маси металів і заряду катіона в солі, що утворюється в реакції металу з кислотою).
Найменшу молярну масу з-поміж зазначених в умові металів має магній. Тож водень найбільшого об’єму виділиться в пробірці
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація кислот за основністю. Двоосновні кислоти.
Завдання скеровано на перевірку знання формул і класифікації кислот за кількістю йонів Гідрогену, здатних до дисоціації, уміння розпізнавати двоосновні кислоти серед інших.
| Варіант відповіді | Назва кислоти | Формула кислоти | Кількість атомів Гідрогену, що утворюються внаслідок дисоціації молекули кислоти | Основність кислоти | Висновок |
| А | Карбонатна | Двоосновні | Правильно | ||
| Сульфатна | |||||
| Б | Ортофосфатна | Триосновна | Неправильно | ||
| Карбонатна | Двоосновна | ||||
| B | Сульфатна | Двоосновна | Неправильно | ||
| Етанова | Одноосновна | ||||
| Г | Сульфідна | Двоосновна | Неправильно | ||
| Нітратна | Одноосновна |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Термічне розкладання солей. Леткі продукти реакції.
Завдання скеровано на перевірку знання хімічних властивостей гідрогенкарбонатів і карбонатів, уміння прогнозувати продукти термічного розкладання солей.
| Варіант відповіді | Формула солі | Продукти термічного розкладання | Твердий залишок |
| А | |||
| Б | |||
| B | |||
| Г |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Властивості солей у водних розчинах. Реакції між солями. Середовище розчину.
Завдання скеровано на перевірку розуміння суті гідролізу солей, знання умов, за яких відбувається реакція між розчиненими у воді солями.
| Варіант відповіді | Формула солі | Середовище водного розчину солі | Висновок |
| А | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Кисле, бо це сіль слабкої основи й сильної кислоти | |||
| Б | Лужне, бо це сіль сильної основи й слабкої кислоти | Правильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти | |||
| B | Лужне, бо це сіль сильної основи й слабкої кислоти | Неправильно | |
| Лужне, бо це сіль сильної основи й слабкої кислоти | |||
| Г | Нейтральне, бо це сіль сильної основи й сильної кислоти | Неправильно | |
| Нейтральне, бо це сіль сильної основи й сильної кислоти |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація речовин за небезпечними властивостями. Їдкі речовини. Хімічна безпека.
Завдання скеровано на перевірку:
- уміння розпізнавати речовини, що спричиняють хімічні опіки та корозію;
- знання марковання небезпечних речовин відповідно до міжнародних стандартів (GHS);
- навички класифікації речовин за їхньою дією на організм і матеріали.
| Варіант відповіді | Назва й формула речовини | Природа речовини | Властивості | Їдка / корозійна дія |
| А | Етанол |
Одноатомний спирт | Не є їдким | |
| Б | Гліцерол |
Триатомний спирт | Безпечний | |
| B | Метанова кислота |
Карбонова кислота | Сильна, їдка, спричиняє опіки | |
| Г | Аміноетанова кислота |
Амінокислота | Біологічно активна, не їдка |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація вуглеводнів. Термічне розкладання. Алкани, алкени, алкіни, арени.
Завдання скеровано на перевірку знання загальних формул і класифікації вуглеводнів, уміння аналізувати хімічне рівняння термічного розкладання, навички визначення типу речовини за її формулою та структурою.
За законом збереження маси визначаємо формулу вуглеводню:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Гідрування органічних сполук. Реакції приєднання. Стехіометрія.
Завдання скеровано на перевірку знання хімічних властивостей бензену, уміння складати хімічні рівняння за його участю й аналізувати кількісні відношення речовин у хімічних реакціях.
Рівняння реакції гідрування бензену з утворенням циклогексану:
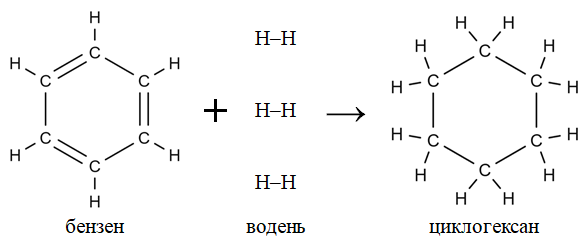
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Типи хімічних реакцій в органічній хімії. Гідрування, гідратація, дегідрування, дегідратація.
Завдання скеровано на перевірку вміння класифікувати органічні реакції за типом перетворення, знання механізмів гідрування та гідратації як реакцій приєднання, розуміння дегідрування як реакції відщеплення водню.
| Реакція 1 | альдегід → спирт | приєднання водню | гідрування |
| Реакція 2 | етен → спирт | приєднання води | гідратація |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова органічних сполук. Реакції з лугами. Повне окиснення.
Завдання скеровано на перевірку вміння аналізувати молекулярну будову органічної речовини за фрагментами, знання реакцій органічних сполук, розуміння стехіометрії повного окиснення – співвідношення між кількістю речовини та об’ємом вуглекислого газу.
Фрагмент 2:
Фрагмент 4:
Разом:
У молекулі етанової кислоти два атоми Карбону, унаслідок повного окиснення молекули утворюються дві молекули вуглекислого газу:
Етанова кислота реагує з натрій гідроксидом з утворенням натрій етаноату:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Будова органічних сполук. Характеристичні (функціональні) групи. Реакції дегідрування.
Завдання скеровано на перевірку вміння аналізувати структурні формули органічних речовин, розпізнавати альдегідну, гідроксильну характеристичні (функціональні) групи, типи реакцій органічних сполук.
А Склад сполук
Б Сполуки
В Сполука
Г Молекула сполуки
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Амінокислоти. Пептидний зв’язок. Будова дипептидів.
Завдання скеровано на перевірку розуміння механізму утворення пептидного зв’язку, уміння аналізувати структурні формули амінокислот і пептидів, розпізнавати залишки амінокислот у дипептиді.
У структурі дипептиду замісник
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Целюлоза як біополімер. Хімічний склад рослинних волокон.
Завдання скеровано на перевірку знання хімічного складу волокон рослинного походження, уміння класифікувати природні речовини за типом біополімеру й розпізнавати целюлозу як основний складник бавовняного волокна.
| Варіант відповіді | Назва речовини | Природа речовини | Властивості |
| А | Сахароза | Дисахарид | Розчинна, не волокниста |
| Б | Каучук | Полімер ізопрену | Не є рослинним волокном |
| B | Крохмаль | Полісахарид | Запасна речовина, не структурна |
| Г | Целюлоза | Полісахарид | Структурний компонент клітинної стінки рослин |
Целюлоза – це основний компонент бавовняного волокна
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні реакції: естерифікація, гідратація, бродіння. Продукти реакцій.
Завдання скеровано на перевірку знання типових органічних реакцій і їхніх продуктів, уміння зіставити назву реакції з відповідною речовиною-продуктом, класифікації органічних сполук за характеристичними (функціональними) групами.
Естерифікація – це утворення естеру. Продуктом естерифікації є метилетаноат.
Гідратація алкену – це приєднання молекули води до молекули алкену за місцем подвійного зв’язку з утворенням спирту. Продуктом гідратації алкену є гексан-3-ол.
Бродіння глюкози буває кількох видів – спиртове, молочнокисле. Продуктом молочнокислого бродіння глюкози є молочна кислота.
Відповідь: 1Б; 2В; 3А.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація солей. Реакції солей із лугами й кислотами. Ознаки утворення осаду й газу.
Завдання скеровано на перевірку вміння тлумачити спостереження і робити висновки з них.
| Варіант відповіді | Формула солі | Хімічні властивості | Реактанти | Посудина | |
| А | Не реагує з натрій гідроксидом і сульфатною кислотою, осад не утворюється | ||||
| Б | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з виділенням газу | ||||
| B | Не реагує з натрій гідроксидом і сульфатною кислотою | ||||
| Г | Не реагує з натрій гідроксидом і реагує із сульфатною кислотою з утворенням осаду | ||||
| Д | Реагує з натрій гідроксидом з утворенням осаду й не реагує із сульфатною кислотою | ||||
Відповідь: 1Г; 2Д; 3Б.
Знайшли помилку? Пишіть на
ТЕМА: Вуглеводні. Загальні формули. Обчислення кількості атомів у молекулі.
Завдання скеровано на перевірку знання загальних формул алканів, алкенів, алкінів, уміння обчислювати кількість атомів Карбону в молекулі вуглеводню за його загальною формулою і молярною масою.
Перевіривши можливі варіанти, легко дійти висновку, що йдеться про етен
| Загальна формула вуглеводнів | Кількість атомів Карбону в молекулі | |
| Молярна маса, г/моль | ||
| Алкани: |
||
| Алкени: |
||
| Алкіни: |
||
Відповідь: 2.
Знайшли помилку? Пишіть на
ТЕМА: Термічне розкладання солей. Стехіометричні обчислення.
Завдання скеровано на перевірку знання продуктів термічного розкладання кальцій карбонату, уміння обчислювати масу продукту реакції за масою реактанту.
Рівняння реакції розкладання кальцій карбонату:
За рівнянням:
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Масова частка речовини. Стехіометрія газів.
Завдання скеровано на перевірку вміння обчислювати масу розчину за масовою часткою розчиненої речовини, масу газу за його об’ємом (н. у.).
Відповідь: 15.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості гідроген пероксиду. Масова частка речовини в розчині.
Завдання скеровано на перевірку вміння обчислювати масу розчину за об’ємом газу, що утворився внаслідок розкладання гідроген пероксиду.
Рівняння реакції розкладання гідроген пероксиду:
За рівнянням:
Відповідь: 68.
Знайшли помилку? Пишіть на
ТЕМА: Реакції горіння. Відношення об’ємів газів у хімічних реакціях.
Завдання скеровано на перевірку знання рівняння реакції повного окиснення карбон(ІІ) оксиду, розуміння, що об’єм газів за однакових умов пропорційний кількості речовини, уміння визначити, який реактант у надлишку, зіставляти об’єми реактантів і продуктів за рівнянням реакції.
Рівняння реакції горіння карбон(ІІ) оксиду:
За рівнянням:
Прореагує карбон(ІІ) оксид:
Залишиться карбон(ІІ) оксид об’ємом
Після реакції:
Відповідь: 25.
Знайшли помилку? Пишіть на
ТЕМА: Повне окиснення вуглеводнів. Співвідношення мас реагентів і продуктів.
Завдання скеровано на перевірку вміння аналізувати рівняння повного окиснення органічної речовини, застосувати закону збереження маси для порівняння мас реактанту і продуктів, визначати хімічну формулу вуглеводню за масовим співвідношенням реактантів і продуктів реакції.
Рівняння реакції горіння вуглеводню:
Продукти реакції:
За умовою:
Формула вуглеводню
Відповідь: 5.
Знайшли помилку? Пишіть на




